Проблема лечения гнойно-воспалительных осложнений тотального эндопротезирования коленного сустава состоит в создании «комплекса мероприятий» по хирургической и послеоперационной реабилитации пациентов, направленной на микробную деконтаминацию области хирургического вмешательства, сохранение анатомических взаимоотношений в суставе и полной или ограниченной функциональности, что обеспечивает скорейшее восстановление опороспособности конечности и повышает эффективность последующего ревизионного эндопротезирования в случаях, когда оно показано. Ближе всего вышеуказанным условиям соответствуют операции двухэтапного ревизионного эндопротезирования с применением артикулирующих спейсеров, импрегнированных антимикробными химиопрепаратами [8; 14; 24; 30; 31].
Для борьбы с раневой инфекцией предложено множество вариантов доставки антимикробного агента непосредственно в очаг инфекции – от обкалывания раны антибиотиком или введения его в сосуд, обеспечивающий кровоснабжение необходимой области или органа, до формирования источника антимикробного химиопрепарата с помощью различного рода «носителей». Развитие медицинской науки, в особенности в области биокомпозитных материалов, позволило эффективно использовать полиметилметакрилат в качестве матрицы для создания длительно существующего депо антибиотика, что сразу нашло широкое распространение в лечении гнойно-воспалительных заболеваний опорно-двигательной системы, в частности – глубокой перипротезной инфекции [1; 4; 9; 11; 13; 27; 30; 33; 37].
Первое упоминание об использовании спейсеров на основе «костного цемента», импрегнированных антибиотиками, для лечения глубокой перипротезной инфекции, датируется 1988-89 годами [26; 40], а первый промышленный артикулирующий спейсер был представлен в 1992 году – система для коленного сустава PROSTALAC® - Prosthesis with Antibiotic-Loaded Acrylic Cement (DePuy, США) [30; 37].
Отечественные разработки до сих пор не имеют широкого распространения, а их производство не является промышленным и зависит от субъективных особенностей отдельных лечебных учреждений и квалификации оперирующих хирургов [16; 17; 20-22].
Спейсер - приспособление на основе биосовместимых материалов (полиметилметакрилата, полиэтилена, металлов) с включением в состав веществ с антимикробной активностью, применяемое для временного заполнения полости сустава в период между удалением инфицированного эндопротеза и установкой ревизионного у пациентов с перипротезной инфекцией [2; 13; 36; 37]. Имплантат должен обеспечивать выполнение ряда необходимых условий:
1) простоту изготовления;
2) микробную деконтаминацию раны;
3) создание условий для полной или ограниченной функциональности сустава и восстановления опороспособности конечности;
4) повышение эффективности последующего ревизионного эндопротезирования в случаях, когда оно показано.
Исходя из предъявляемых требований все спейсеры условно можно разделить на группы:
1) по технологии производства;
2) по исходному материалу;
3) с применением вакуума и без;
4) по количеству компонентов;
5) с армированием костно-мозгового канала и без;
6) по сохранению функции сустава;
7) по антимикробному агенту.
Наиболее просты в использовании преформированные имплантаты (например, PROSTALAC, DePuy). Промышленное производство обеспечивает высокую однородность базового материала, равномерное распределение антимикробного химиопрепарата по всему объему спейсера, соблюдение точных пропорций компонентов, необходимый уровень стерильности и быстроту имплантации. Существенным недостатком таких систем является невозможность при необходимости оперировать различными антибактериальными агентами и их комбинациями, высокая стоимость, а также привязанность к ограниченному числу производителей [20; 22; 30; 35; 37].
Динамические спейсеры изготавливают непосредственно во время операции. Существуют более дешевые промышленные наборы (типа Spaser-K, Tekres; VANCOGENX-SPACER KNEE), состоящие из формы для изготовления спейсера и дозы «костного цемента» и растворителя. Также распространен аналогичный вариант, но с использованием кустарно выполненных форм для изготовления спейсеров. Использование динамических спейсеров является более предпочтительным, так как предоставляет хирургу определенную свободу для «творчества» - возможность выбора полиметилметакрилата с необходимыми свойствами (вязкость, наличие антибиотика в составе, марка изготовителя), добавление в состав цемента необходимого количества антибиотика, соответствующего типу возбудителя и его чувствительности. Такие спейсеры отличаются низкой стоимостью, что также имеет существенное значение [4; 9; 11; 16; 21; 27].
 а
а  б
б
Рис. 1: а) преформированные спейсеры; б) форма для изготовления динамических спейсеров
Ряд авторов указывают на необходимость применения при интраоперационном изготовлении спейсера системы для вакуумного смешивания цемента. Эта методика позволяет более равномерно распределить антимикробный химиопрепарат по всему объему цемента и снизить хрупкость спейсера. В этом случае следует учитывать, что вакуумное смешивание значительно уменьшает пористость цемента, что, в свою очередь, снижает степень элюции антимикробного агента в окружающие ткани. Также имеются достоверные данные, что вымывание антибиотика происходит только из поверхностных слоев полиметилметакрилата, а значит нет необходимости добиваться одинаковой концентрации антибиотика по всему объему материала. На твердость «костного цемента» существенно влияет доза вводимого в состав антибиотика, что также необходимо учитывать и придерживаться рекомендуемых значений [4; 25; 27; 35].
Наиболее широкое применение в качестве антимикробного агента в составе спейсеров получили такие химиопрепараты, как гентамицин, ванкомицин и тобрамицин, но известны работы по применению в составе и других препаратов (цефалоспоринов, аминогликозидов, пенициллинов), но они встречаются гораздо реже. Предварительная верификация возбудителя с определением его чувствительности к антибиотикам позволяет определить препарат выбора при изготовлении спейсера, что наряду с дебридментом полости сустава обеспечит эффективную деконтаминацию раны [1; 3; 6; 13; 30; 35; 39].
Предпринимаются попытки внедрить в состав ПММА антисептики или частицы галогенов, металлов, обладающих антимикробной активностью (серебро, цинк, медь и др.), но эти работы пока единичны. Учитывая отсутствие формирования резистентности у микроорганизмов к подобным материалам и широкий спектр бактерицидной активности рассматриваемых веществ, возможность создания антимикробных покрытий компонентов, такие исследования сегодня являются перспективными и могут открыть новую страницу в лечении инфекционных осложнений тотального эндопротезирования суставов с применением спейсеров [5; 28; 32; 34].
Известны спейсеры, компоненты которых изготовлены из одного материала – чаще ПММА, так и комбинированные (цемент-металлические, цемент-полиэтиленовые, цемент-керамические и т.д.). Выбор материала обусловлен обеспеченностью лечебного учреждения и предпочтениями оперирующего хирурга. Но всегда необходимо учитывать трибологические свойства компонентов, так как при стирании поверхностных слоев ПММА происходит дальнейшая элюция антибиотика из более глубоких слоев цемента в ткани. При соблюдении асептики и антисептики, техники оперативного вмешательства, достаточной степени санации очага воспаления и создании депо антимикробного агента существенных различий в эффективности этих конструкций не наблюдается [12; 17; 21; 22; 27].
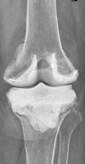
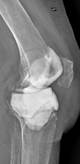 а
а 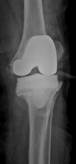
 б
б 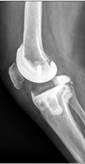
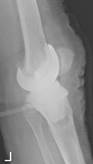
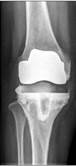 в
в
Рис. 2. Рентгенограммы пациентов с различными вариантами установленных артикулирующих спейсеров: а) цемент-цементный; б) металл-цементный;
в) комбинированный (металл-полимер-цемент)
Первоначально спейсеры коленного сустава являлись статическими однокомпонентными, то есть неартикулирующими, но к концу 1990-х годов были получены данные о большом количестве осложнений повсеместного применения этой методики. К наиболее частым из них относились – вторичные смещения, переломы конструкции, формирование сгибательных контрактур коленного сустава, дистрофические процессы мышц бедра, существенную роль играла необходимость постоянной иммобилизации конечности. Все эти факторы существенно усложняли последующее ревизионное оперативное вмешательство и часто приводили к возникновению новых осложнений и неудовлетворительным результатам реабилитации [10; 15; 33; 35; 36; 38].
На смену неартикулирующим спейсерам пришли двух- и трехкомпонентные артикулирующие, что позволило существенно повысить эффективность выполняемых двухэтапных ревизионных операций на коленном суставе и увеличить степень медико-социальной адаптации пациентов. Многокомпонентность спейсера коленного сустава обеспечивает высокий уровень артикуляции, сохранение анатомо-функциональных взаимоотношений в суставе и конечности, что оказывает существенное влияние на итоговый результат. Показаниями к применению неартикулирующего спейсера являются рецидивирующий инфекционный процесс, большие костные дефекты, повреждение связочного аппарата с возникновением нестабильности в суставе. Во всех остальных случаях предпочтительнее установка артикулирующего спейсера [6; 23; 27; 35].
Нет единого мнения о влиянии фиксации компонентов спейсера на результат оперативного вмешательства. После имплантации без цементной фиксации у пациентов часто отмечается сохранение болевых ощущений в суставе, более низкая степень артикуляции и опороспособности конечности. Этих негативных явлений позволит избежать цементная фиксация компонентов спейсера. У пациентов с таким вариантом имплантации отмечается больший объем движений 63-115° (в среднем 96,4°), отсутствие или более низкая интенсивность болевых ощущений, меньше степень разрушения костного массива бедренной и большеберцовой костей. К негативным моментам можно отнести определенные трудности при удалении компонентов спейсера, по сравнению с нефиксированными [2; 10; 23; 25; 29; 35].
При распространении инфекционного процесса в костно-мозговой канал возможно формирование у компонентов спейсера более длинной «ножки» для заполнения инфицированной полости цементом с антибиотиком либо применение различных биодеградируемых материалов с антимикробными химиопрепаратами [4; 7; 17; 35].
Единого подхода в определении сроков выполнения второго этапа оперативного вмешательства не существует, и у различных специалистов сроки составляют от двух недель до полугода и более. Едиными являются признаки купирования воспаления (отсутствие возбудителя в посевах пунктата сустава, отсутствие признаков воспаления как общих, так и в лабораторных анализах). При этом всегда следует учитывать наличие бессимптомных форм инфекции и бактериальных пленок, затрудняющих выделение патогенной микрофлоры [18; 19; 38].
Заключение
Установка артикулирующего спейсера с антибактериальным химиопрепаратом позволяет эффективно купировать воспаление, создать депо антибиотика до следующего этапа хирургической реабилитации, сохранить анатомо-функциональные взаимоотношения в суставе и конечности. Сочетание этих факторов позволяет обеспечить оптимальные условия для проведения реТЭП сустава при условии ремиссии воспаления. Эффективность таких оперативных вмешательств составляет 87-94,2%, что позволяет назвать их «золотым стандартом» в лечении поздней глубокой перипротезной инфекции, но совершенствование технологий производства компонентов спейсеров с разработкой современных антибактериальных покрытий увеличит эффективность оперативных вмешательств еще больше.
Рецензенты:
Павленко Н.Н., д.м.н., ведущий научный сотрудник Отдела инновационных проектов в травматологии и ортопедии ФГБУ «СарНИИТО» Минздрава России, г. Саратов;
Богатов В.Б., д.м.н., старший научный сотрудник Отдела инновационных проектов в травматологии и ортопедии ФГБУ «СарНИИТО» Минздрава России, г. Саратов.
Библиографическая ссылка
Шпиняк С.П., Барабаш А.П., Лясникова А.В. ПРИМЕНЕНИЕ СПЕЙСЕРОВ В ЛЕЧЕНИИ ИНФЕКЦИОННЫХ ОСЛОЖНЕНИЙ ТОТАЛЬНОГО ЭНДОПРОТЕЗИРОВАНИЯ КОЛЕННОГО СУСТАВА // Современные проблемы науки и образования. 2015. № 5. ;URL: https://science-education.ru/ru/article/view?id=21443 (дата обращения: 10.01.2026).



