Курение является одним из наиболее значимых факторов риска развития сердечно-сосудистых, бронхолегочных и онкологических заболеваний. Никотинассоциированные болезни занимают лидирующие позиции в структуре смертности цивилизованного общества. Тем не менее механизмы и последствия действия продуктов сгорания табака являются не до конца изученными. Метаанализ 22 исследований, посвященных изучению связи между курением и риском развития ишемического инсульта, показал, что при хроническом табакокурении происходит удвоение относительного риска развития ишемического инсульта [9]. Можно предположить наличие объединяющего механизма развития системной сосудистой дисфункции при хроническом табакокурении, в том числе ответственного за повреждение сосудов головного мозга. При этом нарушение церебрального кровотока происходит при срыве механизмов его ауторегуляции вследствие повреждения морфологической целостности эндотелиальной выстилки и разрушения межклеточного матрикса в сосудистой стенке. В ряде экспериментальных работ подтверждено, что агрессивные поллютанты табачного дыма (бензопирен, пероксинитрит, акролеин, цианиды, пероксиды и др.) способны прямо повреждать эндотелиоциты за счет экспрессии на их поверхности молекул адгезии и интенсификации процессов перекисного окисления липидов. В свою очередь окисленные липопротеиды в интиме сосуда играют роль аттрактантов для хемотаксиса лейкоцитов и моноцитов, которые начинают продуцировать в большом количестве провоспалительные цитокины ИЛ-1, 6, TNF-α [2]. Итогом этих процессов становятся запуск системного воспалительного ответа и дезорганизация гладкомышечного каркаса артерий.
В последние годы в экспериментальных исследованиях, направленных на раскрытие механизмов гипоксических повреждений гематоэнцефалического барьера (ГЭБ), изучаются матриксные металлопротеиназы (MMP) — семейство ферментов, разрушающих белки внеклеточного матрикса. Установлено, что MMP играют важную роль в ряде физиологических и патологических процессов, включая эмбриогенез, заживление ран, воспаление, сердечно-сосудистые болезни, болезни легких и рак. Один из ферментов этого семейства ММР-9 разрушает коллаген IV типа, который является главным компонентом базальной мембраны церебрального эндотелия, и, следовательно, создает условия для миграции клеток через ГЭБ [5].
Целью нашего исследования явилось изучение длительного воздействия табачного дыма на экспрессию матриксной металлопротеиназы ММР-9 и ее тканевого ингибитора TIMP-1 в головном мозге при экспериментальном моделировании хронического табакокурения.
Материалы и методы исследования
Для реализации поставленной цели нами была воспроизведена экспериментальная модель длительного табакокурения in vivo у крыс в соответствии с протоколом H. Zheng и колл. [3]. Материалом исследования послужили крысы-самцы линии Вистар 8-недельного возраста, разделенные произвольно на 2 группы. Контрольная группа дышала атмосферным воздухом, а животных экспериментальной группы обкуривали табачным дымом в специальной камере для ингаляций в течение 1 ч утром и 1 ч днем ежедневно в течение 6 месяцев. Для ингаляции использованы коммерческие нефильтрованные сигареты (торговая марка Прима, Россия), содержащие 16 мг смолы и 1,2 мг никотина в одной сигарете. Эксперименты проводились в соответствии с Хельсинской декларацией 1975 г. и ее пересмотренным вариантом от 2008 г. Через 6 месяцев после ингаляции табачного дыма животных фиксировали и анестезировали путем внутрибрюшинного введения рометара (Xylazinum, «Spora», Praha) в концентрации 5,5 мг/кг. Затем производилась декапитация животных и изготавливались гистологические препараты головного мозга. Для оценки локализации и экспрессии матриксной металлопротеиназы-9 (ММP-9) и ее тканевого ингибитора (TIMP-1) использовался непрямой иммуногистохимический метод. Была проведена иммунопероксидазная реакция с моно- и поликлональными антителами против МMP-9 и TIMP-1, а в качестве вторичных антител использованы антитела, помеченные пероксидазой хрена. Количественную оценку степени экспрессии МMP-9 и TIMP-1 проводили путем измерения суммарной плотности преципитата иммуногистохимической реакции, результат выражали в единицах оптической плотности (ЕОП). Гистологические препараты головного мозга просматривали в световом микроскопе AxioScope A1 (Carl Zeiss, Германия) и фотографировали при помощи цифрового фотоаппарата AxioCam ICc3 (Carl Zeiss, Германия). Обработку результатов осуществляли с помощью программ Adobe Photoshop 7.0 и Image J. Достоверность различий между группами (при p<0,05) оценивали с помощью коэффициента Манна—Уитни.
Результаты и обсуждение
Нам представилось интересным изучить содержание MMP-9 и TIMP-1 в различных структурах головного мозга, а именно в церебральных сосудах и нейроглии.
ММР-9 относится к коллагеназам IV типа и является протеолитическим ферментом, способным денатурировать фибриллярные коллагены и поддерживать баланс в составе экстрацеллюлярного матрикса за счет участия в деградации эластина, фибронектина и коллагена IV типа, главного компонента базальных мембран. [4].
Согласно полученным результатам ММР-9 локализуется как в сосудистой стенке, так и в нейроглии. При этом установлено достоверное повышение гистохимической активности ММР-9 в церебральных артериях у животных экспериментальной группы по сравнению с контролем (17,98 ЕОП и 11,07 ЕОП соответственно при р<0,05) (рис. 1).
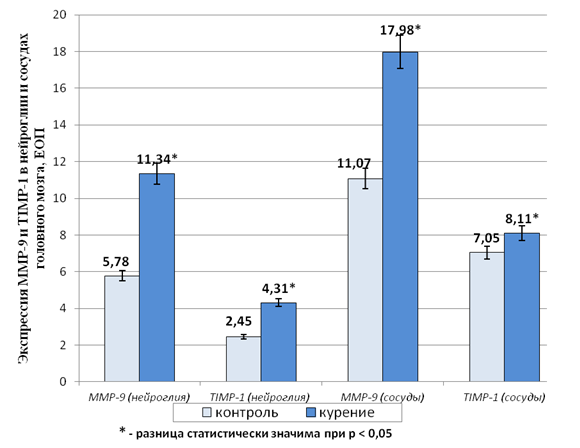
Рис. 1. Экспрессия MMP-9 и TIMP-1 в церебральных сосудах и нейроглии
Полученные результаты могут свидетельствовать об участии ММР-9 в ремоделировании сосудистой стенки церебральных артерий за счет деградации коллагена и нарушении межклеточного матрикса. Одним из механизмов повышения экспрессии MMP-9 в данном случае может быть оксидативный стресс, вызванный накоплением свободно-радикальных форм кислорода при длительном воздействии табачного дыма [6]. Активные формы кислорода не только вызывают свободно-радикальное окисление биомолекул, но и являются регуляторами активности ряда ферментов, включая матриксные металлопротеиназы, а через окисление специфических тиольных групп белков могут изменять конформацию белковых факторов транскрипции, что приводит к их активации или ингибированию. Так, прямое активирующее действие активных форм кислорода на матриксные металлопротеиназы наблюдалось при инкубации очищенных предшественников внеклеточных матриксных металлопротеиназ про-ММР-2 и про-ММР-9 гладких миоцитов человека с системой ксантин — ксантиноксидаза [8].
Нами также обнаружено, что у крыс экспериментальной группы содержание MMP-9 повышено не только в церебральных сосудах, но и в капиллярах и межклеточном веществе нейроглии (рис. 2).
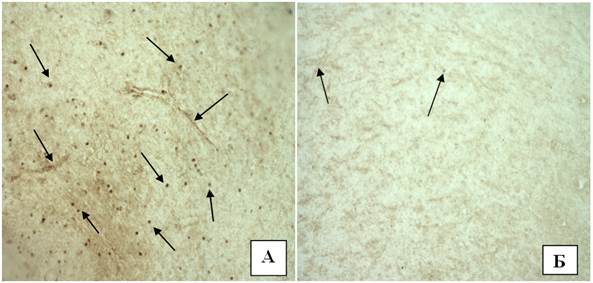
Рис. 2. Экспрессия ММР-9 в головном мозге крыс контрольной группы (Б) и у животных с моделью табакокурения (А), ув.х20. Стрелками указана локализация маркера к ММР-9 в межклеточном пространстве нейроглии и капиллярах
При этом в группе курения отмечено двукратное превышение MMP-9 по сравнению с контролем (11,34 ЕОП и 5,78 ЕОП соответственно при р<0,05) (рис. 1). По-видимому, это связано с тем, что MMP-9 является протеолитическим ферментом, с помощью которого лимфоциты повреждают базальную мембрану ГЭБ и проникают в ткань мозга [10]. Так, в ряде экспериментальных работ показано, что MMP-9 является молекулярным маркером прорыва ГЭБ у пациентов с инсультом. При этом в плазме крови его в два раза больше, чем у здоровых людей [7]. В других работах показано, что повышение MMP-9 в сыворотке крови также ассоциировано с разрушением ГЭБ в остром периоде ишемического инсульта [1].
В свою очередь изменять и контролировать активность матриксных металлопротеиназ могут их эндогенные регуляторы и специфические тканевые ингибиторы (TIMP). ТIМP различаются по их специфическому действию на ММP. Так, например, TIMP-1 значительно лучше ингибирует MMP-9, в то время как TIMP-2 подавляет активность MMP-2.
Одновременно с увеличением экспрессии MMP-9 нами зарегистрировано повышение плотности преципитата TIMP-1 как в сосудах головного мозга, так и в нейроглии у животных экспериментальной группы. Так, содержание TIMP-1 в сосудах и нейроглии при табакокурении составило 8,11 ЕОП и 4,31 ЕОП соответственно, что достоверно отличалось от группы контроля — 7,05 ЕОП и 2,45 ЕОП соответственно при р<0,05 (рис. 1). ТIMP-1 является одним из главных эндогенных ингибиторов ММР-9 в тканях и имеет центральную функцию в поддержании этого баланса.
Заключение
Установленный в нашем исследовании факт повышенной экспрессии ММР-9 свидетельствует о нарушении процессов деградации коллагена как в сосудистой стенке церебральных артерий, так и в капиллярах и межклеточном пространстве нейроглии и отражает системный характер соединительно-тканного дисбаланса при длительном воздействии табачного дыма. Выявленное одновременно с этим повышение TIMP-1 может рассматриваться как компенсаторная реакция, направленная на подавление стимулированной активности MMP-9.
Рецензенты:
Соляник Е.В., д.м.н., профессор кафедры пропедевтики внутренних болезней ГБОУ ВПО ТГМУ Минздрава России , г. Владивосток;
Суровенко Т.Н., д.м.н., профессор кафедры госпитальной педиатрии ГБОУ ВПО ТГМУ Минздрава России, г. Владивосток.
Библиографическая ссылка
Захарчук Н.В., Невзорова В.А., Гончар Е.Ю., Мокшина М.В. ЭКСПРЕССИЯ МАТРИКСНОЙ МЕТАЛЛОПРОТЕИНАЗЫ 9 И ЕЁ ТКАНЕВОГО ИНГИБИТОРА В СОСУДАХ ГОЛОВНОГО МОЗГА ПРИ ЭКСПЕРИМЕНТАЛЬНОМ МОДЕЛИРОВАНИИ ХРОНИЧЕСКОГО ТАБАКОКУРЕНИЯ // Современные проблемы науки и образования. 2015. № 4. ;URL: https://science-education.ru/ru/article/view?id=21063 (дата обращения: 25.02.2026).



