Связь кардиальной и почечной патологии давно привлекает внимание как кардиологов, так и нефрологов. Почки, клубочки которых являются частью микроциркуляторной системы организма, влияют на формирование сердечно-сосудистой патологии, в то же время сами вовлекаются в патологический процесс при различных сердечно-сосудистых заболеваниях (ССЗ). Для заболеваний сердца и почек существует ряд общих факторов риска (ФР): артериальная гипертензия (АГ), сахарный диабет (СД), ожирение, дислипидемия и др. [2, 3]. У пациентов с АГ, ишемической болезнью сердца (ИБС), особенно в сочетании с СД и хронической сердечной недостаточностью (ХСН), нарушения функции почек встречаются достаточно [2]. При этом нарушение функции почек является важным независимым ФР развития таких сердечно-сосудистых осложнений, как инфаркт миокарда (ИМ), сердечная недостаточность, фатальные аритмии [7, 9]. Почечная дисфункция ассоциируется с более частым развитием осложнений и смерти у больных с острым коронарным синдромом, в том числе при проведении тромболитической терапии, а у трети больных, перенесших ИМ, диагностируют ХБП 3–5-й стадии [10]. ХБП признана эквивалентом ИБС по риску сердечно-сосудистых осложнений. Снижение СКФ при ХСН является таким же значимым ФР, как и величина фракции выброса левого желудочка или функциональный класс ХСН [8].
Такая связь поражения сердечно-сосудистой системы и почек позволила в 2008 г. разработать и принять концепцию кардиоренальных взаимоотношений, при этом было выделено пять типов кардиоренального синдрома в зависимости от типа поражения (острого или хронического) и органа-инициатора [5]: тип 1 – острая сердечная недостаточность приводит к острому почечному повреждению; тип 2 – хроническая сердечная недостаточность приводит к хроническому почечному повреждению; тип 3 – острое почечное повреждение приводит к острой дисфункции миокарда; тип 4 – хроническая болезнь почек приводит к ХСН; тип 5 – одновременное поражение почек и сердца при системных заболеваниях, в том числе при васкулитах, СД, амилоидозе, сепсисе.
Многочисленные исследования показали связь снижения скорости клубочковой фильтрации (рСКФ) с увеличением общей и сердечно-сосудистой смертности, при этом фактором риска ССЗ и их осложнений являются даже самые ранние нарушения функции почек [6]. Поскольку снижение рСКФ является независимым ФР развития ССЗ, а ССЗ являются независимым ФР развития ХБП, нами проведено исследование, целью которого явилось выявление взаимосвязи функционального состояния почек с факторами сердечно-сосудистого риска у больных с верифицированным коронарным атеросклерозом, в том числе перенесших инфаркт миокарда.
Материалы и методы
В простое обсервационное исследование методом поперечного среза было включено 100 больных, перенесших ИМ более 6 месяцев назад, из них 86 (86%) мужчин и 14 (14%) женщин. Средний возраст пациентов составил 54 (51,0; 58,0) года. Пациенты обследованы сотрудниками кафедры пропедевтики внутренних болезней ГБОУ ВПО ОмГМУ Минздрава России на базе БУЗ ОО «Городская клиническая больница № 1 им. А.Н. Кабанова» г. Омска. Протокол исследования был утвержден локальным Этическим комитетом ГБОУ ВПО «Омский государственный медицинский университет». От каждого участника исследования было получено письменное информированное согласие.
Критерии включения: перенесенный ИМ со стабильным течением ИБС на протяжении трех месяцев, предшествующих точке включения в исследование, при наличии устойчивого синусового ритма. Критерии исключения: диагностированное заболевание почек, митральный стеноз, недостаточность клапанов с регургитацией III степени, злокачественные новообразования, СД тяжелой степени, тяжелые сопутствующие заболевания в фазе обострения, выраженная органная недостаточность, острые заболевания на момент включения в исследование.
Всем пациентам проводилось общеклиническое обследование, включавшее расспрос, физикальные и дополнительные методы исследования. Функциональный класс стенокардии определяли согласно классификации Канадского сердечно-сосудистого общества (появление типичной боли за грудиной при физической нагрузке), стадию и функциональный класс ХСН – согласно национальным клиническим рекомендациям по диагностике и лечению сердечной недостаточности. Антропометрическое исследование включало измерение массы тела и роста с последующим вычислением индекса массы тела по Кетле (ИМТ). Лабораторные методы исследования (общие анализы крови и мочи, биохимическое исследование крови) проводились по общепринятым методикам в лаборатории БУЗ ОО «Городская клиническая больница № 1 им. А.Н. Кабанова».
Инструментальные методы диагностики включали в себя ЭКГ и эходопплеркардиографию (ЭхоКГ). При проведении последней на аппарате «May Lab 20» определяли структурные и функциональные параметры левого желудочка (ЛЖ). Эхокардиографический протокол включал расчет массы миокарда ЛЖ (ММЛЖ) и индекса ММЛЖ (иММЛЖ). О наличии гипертрофии ЛЖ судили по иММЛЖ: при иММЛЖ более 115 г/м2 у мужчин и более 95 г/м2 у женщин.
Всем обследованным выполнялся расчет суммарного сердечно-сосудистого риска (ССР) по шкалам SCORE (риск сердечно-сосудистых событий со смертельным исходом в ближайшие 10 лет) и Framingham (абсолютный риск сердечно-сосудистых событий в течение ближайших 10 лет) на момент возникновения ИМ путем анализа медицинской документации. Высокий риск по SCORE определялся при показателе ≥ 5%, по шкале Framingham при показателе ≥ 20%.
С целью оценки функции почек использовался расчетный метод определения СКФ (рСКФ) по формуле CKD-EPI в мл/мин/1,73 м2 [4].
Анализ полученных данных проводился с использованием редактора электронных таблиц MS Excel 7.0 и статистической программы STATISTICA 6.0. Количественные данные на предварительном этапе статистического анализа оценивали на нормальность распределения по критерию Shapiro—Wilk. Непрерывные переменные представлены при нормальном распределении в виде средней арифметической (М±σ), при распределении, отличном от нормального, — в виде медианы и межквартильных интервалов (Ме, 25%; 75%). Номинальные данные представлены в виде относительных частот объектов исследования (n, %). Достоверность различий непрерывных данных оценивали с помощью непараметрических критериев: для несвязанных выборок – парного критерия Mann—Whitney U-test, для связанных – критерия Wilcoxon signed-ranks test. Для оценки различий номинальных данных использовали Fisher test при анализе несвязанных выборок и критерий McNemar's test — для связанных. Критический уровень значимости нулевой статистической гипотезы (р) принимали равным 0,05; при р<0,05 различия считались статистически значимыми.
Результаты и их обсуждение
При оценке функционального состояния почек у больных, перенесших ИМ, выявлено, что у 12 (12%) пациентов при рСКФ более 90 мл/мин/1,73 м2 наблюдалась протеинурия, что соответствует 1-й стадии ХБП. 59 (59%) больных имеют рСКФ менее 90 мл/мин1,73 м2, при этом у 19 из них (19%) снижение рСКФ в пределах от 60 до 89 мл/мин/1,73 м2 сочеталось с протеинурией, что соответствует 2-й стадии ХБП, у 5 (5%) больных рСКФ была в пределах от 30 до 59 мл/мин/1,73 м2, что соответствует 3-й стадии ХБП. Снижения рСКФ менее 30 мл/мин/1,73 м2, соответствующего 4–5-й стадиям ХБП, в обследованной группе пациентов не выявлено.
При определении рСКФ у больных с различными ФР ССЗ и признаками поражения органов-мишеней установлено, что у пациентов, перенесших ИМ, при наличии АГ, дислипидемии, гипертрофии ЛЖ и протеинурии рСКФ статистически значимо ниже, чем при их отсутствии. При наличии ожирения/избыточной массы тела, курения и СД различия не достигали статистической значимости, однако имели подобную тенденцию (табл. 1).
Таблица 1
Скорость клубочковой фильтрации у больных, перенесших инфаркт миокарда, с различными факторами риска и признаками поражения органов-мишеней (мл/мин/1,73 м2)
|
Факторы риска и признаки поражения органов-мишеней |
Есть |
Нет |
Статистическая значимость различий (р) |
|
Артериальная гипертензия |
82,4 ±15,4 (n=88) |
85,3 ±19,0 (n=12) |
0,04 |
|
Дислипидемия |
81,8 ±16,1 (n=74) |
85,6 ±14,4 (n=26) |
0,02 |
|
Ожирение/ избыточная масса тела |
82,5 ±15,7 (n=84) |
84,0 ±15,7 (n=16) |
0,19 |
|
Сахарный диабет |
81,7 ±14,5 (n=14) |
83,0 ±16,1 (n=86) |
0,37 |
|
Курение |
82,3 ±16,3 (n=62) |
83,4 ±14,8 (n=38) |
0,37 |
|
Гипертрофия ЛЖ |
78,6 ±14,4 (n=32) |
83,6 ±15,9 (n=68) |
0,02 |
|
Протеинурия |
79,9 ±15,8 (n=38) |
84,0 ±15,3 (n=62) |
0,04 |
При анализе влияния степени АГ на выраженность почечной дисфункции установлено, что у пациентов, перенесших ИМ, величина рСКФ не зависела от степени АГ (р=0,38), т.е. фактором, усугубляющим почечную дисфункцию, является само по себе наличие АГ, а не ее степень (рис. 1).
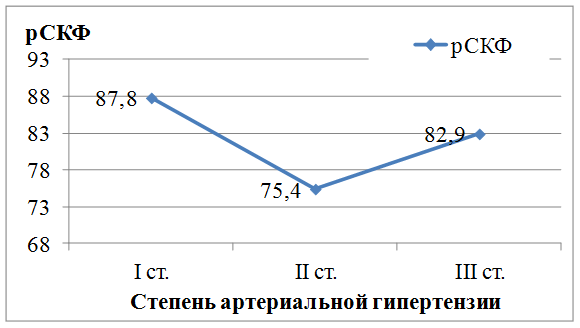
Рис. 1. Зависимость величины скорости клубочковой фильтрации от степени артериальной гипертензии у пациентов, перенесших инфаркт миокарда
Все обследованные больные имели стенокардию напряжения I–III функциональных классов и ХСН, соответствующую I–III функциональным классам по классификации NYHA. При расчете СКФ у больных в зависимости от функционального класса стенокардии и ХСН выявлено снижение рСКФ по мере нарастания тяжести стенокардии и ХСН (рис. 2).
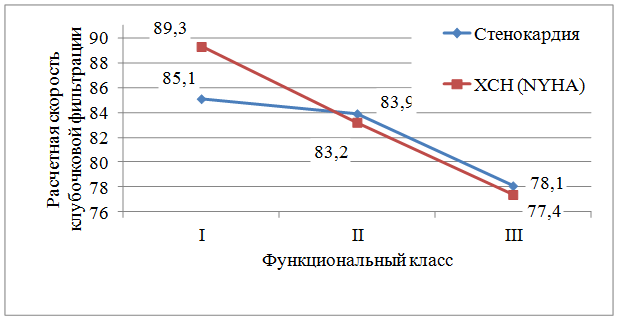
Рис. 2. Скорость клубочковой фильтрации у больных, перенесших инфаркт миокарда, в зависимости от функционального класса стенокардии и хронической сердечной недостаточности (NYHA)
При распределении больных по подгруппам высокого и низкого/умеренного риска СС событий по шкалам SCORE и Framingham выявлено, что у больных высокого риска по шкале SCORE рСКФ была статистически значимо ниже, чем в группе низкого/умеренного риска. При анализе риска по шкале Framingham выявлена подобная тенденция, указывающая на более низкую рСКФ в группе пациентов высокого риска (табл. 2).
Таблица 2
Скорость клубочковой фильтрации у пациентов, перенесших инфаркт миокарда, в зависимости от величины суммарного сердечно-сосудистого риска (мл/мин/1,73 м2)
|
|
Высокий риск |
Низкий и умеренный риск
|
статистическая значимость различий (р) |
|
SCORE |
78,9 ±16,0 (n=58) |
90,0 ±13,7 (n=42) |
0,0002 |
|
Framingham |
81,0 ±16,3 (n=35) |
85,1 ±15,7 (n=65) |
0,07 |
Наличие более низкого уровня рСКФ у пациентов с высоким ССР подтверждают данные многочисленных проспективных исследований, указывающих на увеличение риска ССЗ и смерти по мере снижения почечной функции [2]. Данное положение подтверждается наличием средней силы статистически значимой связи между суммарным ССР и рСКФ: для шкалы SCORE – r = –0,33, р<0,001; для шкалы Framingham – r= –0,27, р<0,001.
Заключение
В нашем исследовании у больных с верифицированным коронарным атеросклерозом, в том числе перенесших ИМ, установлена встречаемость факторов сердечно-сосудистого риска в зависимости от функционального состояния почек. Выявлено, что более трети больных, перенесших ИМ, имеют признаки почечной дисфункции в виде ХБП 1–3-й стадии, при этом наличие у них ФР ССЗ усугубляет тяжесть почечной дисфункции. Функциональное состояние почек ухудшается с увеличением тяжести стенокардии и ХСН. Полученные результаты согласуются с данными других исследователей [1, 2, 3].
Оценка функционального состояния почек у больных ССЗ, в том числе перенесших ИМ, важна для стратификации риска, а также выбора профилактических и терапевтических мероприятий. Методы оценки функции почек у больных с кардиоренальной патологией отражены в национальных междисциплинарных клинических рекомендациях [2]. На сегодняшний день для расчета СКФ признана оптимальной формула CKD-EPI, поскольку ее результаты близко сопоставимы с определением СКФ клиренсовым методом (методом клиренса mTc-DTPA), в том числе у лиц с сохранной функцией почек. У больных с ССЗ также рекомендуется определять альбумин или соотношение альбумин/креатинин в утренней порции мочи и проводить визуализирующие исследования почек для уточнения почечного повреждения.
При выявлении у больного с ССЗ дисфункции почек необходимо назначить нефропротективную терапию – комплекс мер, направленных на сохранение функции почек или торможение скорости ее снижения, что позволит снизить смертность этих больных прежде всего от сердечно-сосудистых осложнений, поскольку их риск резко повышается на каждой стадии ХБП и задолго до терминальной хронической почечной недостаточности, а вероятность развития сердечно-сосудистых осложнений при наличии ХБП в 25–100 раз выше, чем риск развития терминальной хронической почечной недостаточности. На фоне нефропротективной терапии должны быть достигнуты следующие целевые показатели:
1) максимальное снижение альбуминурии/протеинурии (≥ в 1,5 раза), в идеале – до нормоальбуминурии – менее 10 мг/сут.;
2) динамика снижения СКФ – менее 2 мл/мин/1,73 м2;
3) целевое артериальное давление < 140/90 мм рт. ст.; при наличии протеинурии, или альбуминурии более 300 мг/сут., или соотношении альбумин/креатинин >30 мг/ммоль целевое систолическое АД < 130 мм рт. ст.; у больных СД – целевое диастолическое АД < 85 мм рт. ст. Следует избегать снижения АД ниже 120/80 мм рт. ст.;
4) целевые показатели липидного спектра крови: Хс ЛПНП < 2,5 ммоль/л у больных при СКФ от 30 до 60 мл/мин, и <1,8 ммоль/л при СКФ менее 30 мл/мин;
5) для больных сахарным диабетом – альбуминурия менее 30 мг/сут. и уровень гликированного гемоглобина ≤ 7%.
Основной фактор прогрессирования нефропатий, в том числе и у больных с ССЗ, – внутриклубочковая гипертензия, которая неизбежно возникает как при высоком АД, так и при снижении количества функционирующих нефронов из-за повышения нагрузки на действующие клубочки. Давление в клубочке зависит не только от системного АД, но и от разницы в диаметре между афферентной и эфферентной артериолами. Внутриклубочковую гипертензию усиливают гипергликемия и ожирение, которые вызывают вазодилатацию афферентной артериолы, а также длительный прием высокобелковой пищи даже при нормальном количестве действующих нефронов. Основными патогенетическими факторами внутриклубочковой гипертензии являются активация ренин-ангиотензин-альдостероновой системы (РААС) и констрикция эфферентной артериолы под действием ангиотензина II. Основной стратегией нефропротекции поэтому следует считать блокаду РААС, особенно при наличии у больного альбуминурии/протеинурии. Препараты из группы ИАПФ/сартанов расширяют эфферентную артериолу, приводя к снижению давления внутри почечного клубочка. Однако при назначении этих препаратов следует помнить о необходимости мониторинга показателей уровня калия и креатинина крови с расчетом СКФ: при первичном назначении через 7–10 дней от начала лечения, а затем реже в зависимости от уровня АД, рСКФ, уровня калия плазмы, а также сопутствующих заболеваний и приема нефротоксичных препаратов. На сегодняшний день основные направления нефро- и кардиопротекции совпадают. Однако при выборе доз и тактики применения препаратов с двойным нефро- и кардиопротективным действием задачи нефропротекции (максимальное снижение альбуминурии/протеинурии и замедления снижения СКФ) являются первостепенными.
Исследование выполнено при финансовой поддержке РГНФ и Омской области в рамках научного проекта № 15-16-55006 (название проекта: Предотвращение социальных потерь трудоспособного населения Омской области путем профилактики инфаркта миокарда).
Рецензенты:
Совалкин В.И., д.м.н., профессор, заведующий кафедрой госпитальной терапии с курсом эндокринологии ГБОУ ВПО «Омский государственный медицинский университет» Минздрава России, г. Омск;
Ахметов В.А., д.м.н., профессор кафедры факультетской терапии с курсом профессиональных болезней ГБОУ ВПО «Омский государственный медицинский университет» Минздрава России, г. Омск.
Библиографическая ссылка
Усачева Е.В., Михайлова Л.В., Нелидова А.В., Замахина О.В. ФУНКЦИОНАЛЬНОЕ СОСТОЯНИЕ ПОЧЕК У ПАЦИЕНТОВ, ПЕРЕНЕСШИХ ИНФАРКТ МИОКАРДА // Современные проблемы науки и образования. 2015. № 4. ;URL: https://science-education.ru/ru/article/view?id=20996 (дата обращения: 25.02.2026).



