Целью исследования было изучить опыт медикаментозного лечения гемангиом при различных протоколах ведения.
Материалы и методы
Дизайн исследования
Исследование носило характер нерандомизированного контролируемого, в параллельных группах. Количество пациентов – 250 детей с инфантильными гемангиомами. Распределение пациентов в подгруппы «С-1, длинная программа лечения» и «С-2, короткая программа лечения» производилось случайным образом, согласно заполнению коек двух разных педиатрических отделений (ограниченная рандомизация). Специального алгоритма рандомизации не применяли, исследование носило характер нерандомизированного и ретроспективного. Группу сравнения составили 100 здоровых детей, не получавших пропранолола, которым проводились плановые медицинские осмотры в 2012-2014 гг. в стационаре одного дня, в возрастные сроки 1, 3, 6, 12 мес.
Продолжительность исследования
Сроки проведения исследования – 2012-2014 гг.
Условия проведения
Стационарный этап исследования проводился в Детской республиканской клинической больнице Минздрава Республики Татарстан. Амбулаторный этап исследования состоял из ряда визитов к врачу, осуществлялся консультативный приём педиатра и детского хирурга.
Критерии включения: гемангиома множественная (более 3 независимых элементов); гемангиома прогрессирующая; гемангиома обширная (более 5 кв. см); гемангиома подкожной локализации, труднодоступных областей; возраст ребенка до 1 года (табл. 1).
Критерии невключения: системные заболевания, заболевания дыхательной системы, заболевания сердца, нарушения ритма, в том числе атриовентрикулярная блокада II и III степеней, гипергликемия; сахарный диабет; противопоказания к приему пропранолола.
Критерии завершения лечения: факт полной инволюции гемангиомы, отказ родителей пациента продолжать лечение, отсутствие положительной динамики в течение последних 3 месяцев.
Для тех случаев, когда
необходимость начала лечения гемангиомы была неочевидна, применяли собственный
разработанный алгоритм выставления показаний к лечению гемангиом, на который
был получен патент РФ
«Способ определения показаний к лечению гемангиом», № 2515464 от
17.03.2014 г. В основе способа – вычисление скорости увеличения роста
площади гемангиомы относительно скорости увеличения площади тела ребенка. При
обращении пациента (ребенка) определяли площадь гемангиомы. При этом для
круглых гемангиом площадь в кв. см вычисляли по формуле ![]() , где S – площадь гемангиомы, кв. см; d –
диаметр округлой гемангиомы, см; π – число пи, 3.1415926..,
, где S – площадь гемангиомы, кв. см; d –
диаметр округлой гемангиомы, см; π – число пи, 3.1415926..,
Для гемангиом неправильной формы площадь определяли с применением прозрачной пленки – палетки, расчерченной на квадраты со стороной в 1 см и 0,5 см. Вышеописанным образом получали два значения: S2 – измерение площади при повторном осмотре, кв. см; S1 – измерение площади при первичном осмотре, кв. см.
В последующем определяли
площадь поверхности тела пациента по формуле Мостеллера, ![]() , где в.тела – вес тела в кг, рост – рост
в см, 10000 – коэффициент пересчета в кв. см. В результате двух посещений врача
получали два значения площади поверхности тела: Sтела2 – площадь
поверхности тела при повторном осмотре, кв. см; Sтела1 – площадь
поверхности тела при первичном осмотре, кв. см. Оценка динамики размеров каждой
гемангиомы производилась одним и тем же специалистом, результат измерений
квалифицировался как наличие/отсутствие показаний к лечению.
, где в.тела – вес тела в кг, рост – рост
в см, 10000 – коэффициент пересчета в кв. см. В результате двух посещений врача
получали два значения площади поверхности тела: Sтела2 – площадь
поверхности тела при повторном осмотре, кв. см; Sтела1 – площадь
поверхности тела при первичном осмотре, кв. см. Оценка динамики размеров каждой
гемангиомы производилась одним и тем же специалистом, результат измерений
квалифицировался как наличие/отсутствие показаний к лечению.
Лечение гемангиомы показано,
если значение 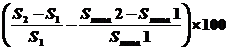 превышает 10.
Предложенный способ позволил объективизировать процесс определения показаний с
чувствительностью измерений и высокой точностью критерия.
превышает 10.
Предложенный способ позволил объективизировать процесс определения показаний с
чувствительностью измерений и высокой точностью критерия.
Описание медицинского вмешательства
Лечебный процесс состоял из стационарной и амбулаторной фаз. Стационарная фаза проводилась в двух основных вариантах исполнения. 1. Программа С-1. Стартовая доза пропранолола – 0,16 мг/кг/каждые 8 часов, per os. Основная (рабочая) доза 2 мг/кг/сутки, per os, в три приема. Достижение основной дозы проводится в течение 6-10 дней стационарного наблюдения за пациентом. 2. Программа С-2. Стартовая доза пропранолола – 1 мг/кг/сут, per os. Достижение основной дозы проводится в течение 3 дней стационарного наблюдения за пациентом. Стандартная рабочая доза – 2 мг/кг/сутки, per os, в три приема. Гипотезой, требующей доказательств в настоящем исследовании, было утверждение, что протокол С-2 не уступает протоколу С-1 по безопасности и эффективности, выигрывая в длительности госпитализации и затратах ресурсов медицинского учреждения.
Первый визит амбулаторного ведения – через 2 недели, далее ежемесячно. Каждый визит – оценка уровня ЧСС, АД, глюкозы крови, измерение массы тела, оценка состояния гемангиомы, фотодокументация визита, корректировка дозы. Завершение лечения – постепенная отмена препарата с типовым контрольным визитом спустя 1 мес.
Исходы исследования
Основным исходом исследования считали полное излечение с применением только лишь медикаментозного лечения, когда гемангиома исчезала полностью, исход достигался без выявленных отклонений в показателях, критериев исключения. Дополнительный исход – неполное исчезновение гемангиомы с необходимостью завершения лечения путем лазерного воздействия из-за сохраняющихся резидуальных телеангиэктазий.
Методы регистрации исходов
В отношении пациентов основной группы применяли врачебный осмотр (педиатр, детский хирург), фотодокументацию местного статуса, ЭКГ, УЗИ сердца, УЗИ внутренних органов, определение показателей артериального давления, частоты сердечных сокращений, веса ребенка. В подгруппах С-1 и С-2 выполняли сравнительный анализ показателей гемодинамики, оценку исходов лечения гемангиом, сравнивали длительность госпитализации и риски внутрибольничного инфицирования детей.
Этическая экспертиза
Исследование было одобрено Локальным этическим комитетом при ГБОУ ВПО «Казанский ГМУ Минздрава РФ», протоколы № 9 от 27.11.2012 г. и № 3 от 25.03.2014 г.
Статистический анализ
Оценка исследуемых групп проводилась с использованием таких величин, как среднее значение параметра, стандартное отклонение. Оценка значимости различий между изменениями показателей осуществлялась на основании критерия t, хи-квадрат (χ2). Анализ данных проводился с помощью компьютерных программ для статистической обработки данных BIOSTAT 2009 и БИОСТАТИСТИКА с применением методов, описанных в Primer of Biostatistics, 4th Edition, S.A.Glantz, McGraw-Hill (пер. на русск. яз. - М.: Практика, 1999). Сравнение групп малых объемов осуществлялось с использованием непараметрических методов статистики, где достоверность различий между величинами оценивалась по критерию знаков (Гублер Е.В. с соавт., 1973; Вахитов Ш.М. с соавт., 2003).
Результаты
Участники исследования
В основную группу вошло 250 детей с диагнозом «гемангиома», возраст пациентов от 30 дней до 10 мес 8 дней (среднее 5,1 мес±15 дн). Половой состав: девочек 183 (73,2%), мальчиков 67 (26,8%). Включение в основную группу носило характер сплошной выборки (в исследование вошли все пролеченные пациенты); распределение в подгруппы носило случайный характер. Подгруппа С-1 – 140 пациентов, С-2 – 110 пациентов, таблица 1.
Таблица 1
Сведения о распределении пациентов в группы (n=350)
|
|
Основная группа |
Группа сравнения |
|
|
Группа |
Подгруппа С-1 |
Подгруппа С-2 |
|
|
Численность группы |
140 |
110 |
100 |
|
Возраст, дней* |
158,6±70,56 |
163,7±64,3 |
162,7±65,52 |
* на момент начала лечения.
Показания к инициации лечения отражены в таблице 2.
Таблица 2
Распределение гемангиом по показаниям к инициации лечения (n=250)
|
Показания к лечению |
Количество |
Доля |
|
Множественная гемангиома |
11 |
4,4 |
|
Гемангиома области головы, лица, половых органов |
196 |
78,4 |
|
Гемангиома, осложненная кровотечением, изъязвлением |
7 |
2,8 |
|
Комбинация 3-х и более элементов по критериям включения |
82 |
32,8 |
|
В том числе определение прогрессирования гемангиомы, способ № 2515464 |
42 |
16,8 |
* в ряде случаев отмечали два и более различных показания.
Всего скринировано 253 пациента, из них включены в исследование – 250. В трех случаях дети были исключены из исследования. У первого пациента была выявлена врожденная атриовентрикулярная блокада II степени, у второго – врожденный порок сердца ДМЖП (дефект межжелудочковой перегородки). Один пациент выбыл из исследования ввиду отказа родителей, была выполнена конверсия тактики «медикаментозное лечение»→«лазерное лечение».
В статистический анализ включены результаты лечения 250 пациентов.
Основные результаты исследования
Основные жалобы больных представлены в табл. 3, чаще отмечали жалобы на гемангиомы области головы (всего 76%).
Таблица 3
Распределение гемангиом в группе исследования по локализации (жалобы) (n=250)
|
Локализация |
Количество |
Доля |
|
|
Тело |
|
47 |
18,8 |
|
Голова |
Лицо |
102 |
40,8 |
|
Глаз (и веко) |
13 |
5,2 |
|
|
Прочее |
75 |
30 |
|
|
Печень |
2 |
0,8 |
|
|
Множественные поражения |
11 |
4,4 |
|
|
Всего |
250 |
100 |
|
Во всех случаях отмечено улучшение/выздоровление пациентов. Фотодокументация позволила констатировать излечение с опорой на фактические исходные данные пациентов во всех случаях.
Исследования в подгруппах выполняли по процедуре intention-to-treat. В рамках протокола стационарного ведения пациентов осуществляли регулярный контроль показателей гемодинамики.
Критерии безопасности лечения. Пограничными значениями контролируемых показателей (ЧСС, АД, уровень глюкозы крови) считали возрастные показатели, общепринятые в педиатрии. Препарат-специфическим отклонением показателей ЭКГ является удлинение интервала PQ; допустимым верхним значением в работе считали 0,140 c.
ЧСС. У большинства пациентов показатели ЧСС демонстрировали вариабельность и колебались в широком диапазоне в пределах 100-160 уд/мин. У 3 (1,2%) детей ко дню выписки из стационара была выявлена брадикардия (ЧСС 98, 91 и 86 уд/мин, соответственно), и это потребовало корректировки дозы препарата. Среднее значение ЧСС за время исследования снижалось с 127,87±2,5 уд./мин. до 120,77±2,9 уд./мин., (р≥95%), однако показатель не выходил за рамки возрастной нормы. С группой сравнения достоверных различий не выявлено (p>0,05).
АД достоверно (р≥95%) снижалось на стационарной фазе лечения с 101,56±3,6 мм рт.ст. до минимального значения в 78,25±2,09 мм рт.ст. с последующим возвращением показателя к норме к началу амбулаторной фазы. Следует отметить, что широкий коридор допустимого диапазона колебаний АД позволил констатировать факт сохранения нормальных значений во всех случаях. С группой сравнения достоверных различий не выявлено (p>0,05).
ЭКГ. В повторных ЭКГ исследованиях были отмечены «доброкачественные» отклонения: у 10 (4,00%) – признаки нарушений процессов реполяризации, у 47 (18,80%) – неполная блокада пучка Гиса, у 32 (12,8%) выявлена миграция водителя ритма по предсердиям. Всего 62 (25,20%) пациента (в ряде случаев отмечали сочетание признаков). Достоверных различий с группой сравнения не выявлено (p>0,05).
Таблица 4
Результаты электрокардиографического исследования (n=250)*
|
Результат |
Количество |
Группа сравнения |
p** |
|
|
До лечения |
В процессе лечения |
|||
|
ЭКГ без патологических отклонений: (ЧСС в пределах нормативного диапазона, ось сердца в пределах нормативного диапазона, АВ-проводимость в пределах возрастного диапазона) |
246 (98,4%) |
229(91,6%) |
99 |
>0,05 |
|
АВ-блокада 1 степени |
3(1,2%) |
17(6,8%) |
1 |
>0,05 |
|
АВ-блокада 2 степени |
0 |
0 |
0 |
- |
|
Полная АВ–блокада |
2(0,8%) |
0 |
0 |
>0,05 |
|
АВ- блокада корригированная (ритм ЭКС) |
0 |
1(0,4%) |
0 |
- |
|
Брадикардия |
0 |
3 |
0 |
- |
* в ряде случаев отмечали сочетание выявленных отклонений.
У 17 (6,8%) детей значения интервала PQ превысили принятые в работе границы зоны риска нормативных показателей (≤0,140 c). Отмечено удлинение среднего значения интервала PQ (p<0,05), Критические значения (длительность более 0,14 с) были отмечены 12 раз (8,57%) при применении алгоритма c-II, и 5 раз (4,55%) при применении алгоритма с-I (табл. 5).
Таблица 5
Результаты изучения АВ-проводимости пациентов на стационарной фазе лечения (n=250)
|
Протокол |
Количество больных
|
Число пациентов с пограничными значениями интервала PQ, чел. (%) |
t |
p* |
|
C-I |
110 |
5 (4,55%) |
1,09 |
0,277 |
|
C-II |
140 |
12 (8,57%) |
Примечание: *- достоверность различий, критерий t.
Таким образом, достоверных различий в потенциальном риске удлинения PQ-интервала между группами С‑1 и С‑2 нет (р=0,277). Ко дню выписки домой у 99,6% пациентов обеих групп длительность PQ-интервала не выходила за пределы допустимого диапазона (табл. 6).
Таблица 6
Результаты изменения АВ проводимости пациентов на стационарной фазе лечения C-II, повторные измерения (n=140)
|
Измерение, № |
Количество больных со значением проводимости «зона риска» |
Доля, % |
|
1 |
3 |
2,14 |
|
2 |
12 |
8,57 |
|
3 |
1 |
0,71 |
Лишь у одного пациента (0,7%) были отмечены критические значения интервала PQ на этапе амбулаторного лечения, в связи с чем лечебную дозу для ребенка сократили до 50% от основной, 1 мг/кг/сутки, в четыре приема (по 0,25 мг/кг).
Средний уровень глюкозы крови достоверно (р<0,05) повысился с 3,867±0,103 до 4,114±0,086 ммоль/л (С-1) и с 3,942±0,120 до 4,2±0,094 ммоль/л (С-2). Тем не менее отклонения не выходили за рамки возрастных норм, достоверных различий с группой сравнения не выявлено (p>0,05) (табл. 7). В одном случае (протокол С-2) была отмечена гипергликемия (6,3 ммоль/литр). Продолжение терапии согласовано с эндокринологом.
Таблица 7
|
|
Средний уровень глюкозы крови, ммоль/литр, до лечения |
Число пациентов с отклонением, чел (%) |
Средний уровень глюкозы крови, ммоль/литр, время лечения |
Число пациентов с отклонением, чел (%) |
Группа сравнения (n=100) |
p* |
|
|
Средний уровень глюкозы крови, ммоль/литр |
Число пациентов с отклонением, чел (%) |
||||||
|
С-1 (n=110) |
3,86±0,103 |
0 (0%) |
4,11±0,086 |
0 (0%) |
3,66±0,11 |
0(0%) |
>0,05 |
|
C-2 (n=140) |
3,94±0,120 |
1 (0,7%) |
4,2±0,094 |
1 (0,7%) |
>0,05 |
||
В сравнении алгоритмов стационарного ведения С-1 и С-2 можно выделить отдельные параметры для оценки (табл. 8-10).
Таблица 8
Сравнение стационарных фаз лечения по длительности госпитализации в зависимости от алгоритма ведения (n=250)
|
Протокол |
N |
Длительность госпитализации, число койко-дней |
t |
p* |
|
С-1 |
110 |
8,9±0,23 |
28,9 |
<0,01 |
|
С-2 |
140 |
3±0 |
Примечание: *- достоверность различий, критерий t.
Как следует из таблицы 8, между группами С-1 и С-2 отмечается достоверная разница в 2,97 раза в сроках госпитализации.
Таблица 9
Сравнение стационарных фаз лечения по числу случаев внутрибольничного инфицирования в зависимости от протокола ведения (n=250)
|
Протокол |
N |
Число случаев внутрибольничной инфекции, чел., % |
T |
p* |
|
С-1 |
110 |
9; 8,18% |
2,609 |
<0,05 |
|
С-2 |
140 |
2; 1,43% |
Примечание: *- достоверность различий, критерий t.
В то же время параметр внутрибольничного инфицирования, напрямую зависящий от сроков нахождения в стационаре, однозначно говорит о том, что в 5,72 раза чаще указанное инфицирование происходило при С-1 алгоритме (табл. 9).
В обоих протоколах ведения были отмечены хорошие результаты, 100% пациентов были излечены.
Таблица 10
Результаты лечения пациентов в зависимости от протокола ведения (n=250)
|
Протокол |
N |
Основной исход исследования, чел., % |
Дополнительный исход исследования, чел., % |
t |
p* |
|
С-1 |
110 |
109; 99,09% |
1; 0,91% |
1,09 |
0,277 |
|
С-2 |
140 |
136; 97,14% |
4; 2,86% |
Примечание: *- достоверность различий, критерий t.
Основной исход исследования был отмечен у большинства (98%) пациентов, когда полное излечение произошло с применением лишь медикаментозного лечения. Лишь в 5 случаях (2%) отмечали дополнительный исход исследования, когда на финальной стадии лечения потребовалось применение лазерного фототермолиза для удаления резидуальных телеангиэктазий. Достоверных различий между протоколами С-1 и С-2 нет (табл. 10).
Во всех случаях промежуточными точками оценки были измерения, проводившиеся на визитах амбулаторного ведения. Оценивали динамику локального статуса, показатели АД, ЧСС, ЭКГ и уровень глюкозы крови. На всех этапах лечения были отмечены нормальные значения контролируемых показателей, равно как и на финальном визите.
Нежелательных явлений, связанных с проводимым исследованием, отмечено не было.
Обсуждение
В исследовании была изучена пропранолол-терапия, как отдельно, так и в сочетании с топическим лазерным лечением гемангиом. В настоящее время возможности лазерной коагуляции гемангиом хорошо изучены, выполнение процедур позволяет достичь вполне удовлетворительных результатов при работе с гемангиомами небольших размеров [4; 14; 18]. Применение пропранолола, однако, характеризуется влиянием на артериальное давление (АД), частоту сердечных сокращений (ЧСС) и сердечный ритм и проводимость [8; 15]. Хорошо известно, что передозировка β-адреноблокаторов чревата серьезными осложнениями [11; 17].
В соответствии с критериями включения и невключения из 253 пациентов скрининговое обследование позволило включить в группу лечения и статистической обработки результаты лечения 250 пациентов (98,8%). При этом все прошедшие скрининг пациенты были излечены. Проведенное исследование показало возможность достижения основного результата более чем в 98% случаев. Лишь в 2% случаев результат имел характер дополнительного, когда завершение лечения требовало сочетания лекарственной терапии и лазерного воздействия.
Представляет интерес возможность укорочения периода подбора дозы пропранолола, особенно во взаимосвязи с потенциальным риском передозировки препарата [11; 17]. Гипотеза о том, что возможно безопасное и эффективное укорочение программы терапии на стадии стационарного этапа, была доказана результатами исследования. В работе случайным образом были сформированы две группы пациентов, 140 и 110 человек, длительность лечения 10 дней и 3 дня соответственно. Гемодинамические эффекты пропранолола и его влияние на сердечную проводимость оценивали по показателям ЭКГ, уровню артериального давления и ЧСС. Короткая программа стационарного лечения потенциально носила риск значимых отклонений всех изучаемых параметров. Тем не менее гемодинамические отклонения, сопровождавшие лечебный процесс при реализации обоих протоколов лечения пропранололом, носили временный характер. Отдельные измерения стационарного этапа выходили за границы нормы, что диктует необходимость тщательного мониторинга показателей и врачебного наблюдения. В то же время протокол-специфических и протокол-зависимых гемодинамических отклонений выявлено не было. Амбулаторный этап лечения был идентичен в обоих протоколах, и статистической разницы в результатах отмечено не было. Для квалификации гемодинамических показателей детей основных (лечебных) подгрупп была сформирована группа сравнения из ста здоровых пациентов.
Ограничения исследования
По этическим соображениям группа сравнения не могла быть представлена детьми с гемангиомами, не получающими медикаментозного (или иного) лечения.
Заключение
Медикаментозное лечение гемангиом с применением пропранолол-терапии видится перспективным и имеющим высокую результативность. При этом по-прежнему не отработаны алгоритмы ведения пациентов, особенно с учетом возможных отклонений, не изучены оптимальные сроки стационарного лечения пациентов. Проведенное исследование продемонстрировало эффективность и безопасность тактики медикаментозного ведения пациентов. В то же время профиль безопасности характеризовался как идентичный для различных по длительности протоколов стационарных фаз лечения. Соответственно этому, можно рекомендовать укорочение стационарного пребывания пациентов на этапе инициации терапии с возможностью сократить койко-дни и сэкономить ресурсы системы здравоохранения. Представляется возможным развитие исследования, с потенциалом дальнейшего сокращения длительности госпитализации. Одним из путей видится увеличение частоты приема препарата с постоянным повышением дозы.
Нерешенной остается проблема возможности лечения по изложенным в статье алгоритмам в группе детей старшего возраста.
Конфликт интересов: авторы данной статьи подтвердили отсутствие финансовой поддержки исследования / конфликта интересов, о которых необходимо сообщить.
Рецензенты:Сафина А.И., д.м.н., профессор, заведующая кафедрой педиатрии и неонатологии ГБОУ ДПО «Казанская государственная медицинская академия» Министерства здравоохранения РФ, г. Казань;
Вахитов Х.М., д.м.н., доцент кафедры пропедевтики детских болезней ГБОУ ВПО «Казанский государственный медицинский университет» Министерства здравоохранения РФ, г. Казань.
Библиографическая ссылка
Миролюбов Л.М., Нурмеев И.Н., Нурмеева А.Р., Осипов А.Ю., Нурмеев И.Н., Миролюбов Л.М., Нурмеева А.Р., Осипов А.Ю., Нурмеев Н.Н., Рашитов Л.Ф., Кадриев А.Г. ЭФФЕКТИВНОСТЬ И БЕЗОПАСНОСТЬ РАЗЛИЧНЫХ ПО ДЛИТЕЛЬНОСТИ ПРОГРАММ МЕДИКАМЕНТОЗНОГО ЛЕЧЕНИЯ ГЕМАНГИОМ У ДЕТЕЙ (СРАВНИТЕЛЬНОЕ ИССЛЕДОВАНИЕ В ПАРАЛЛЕЛЬНЫХ ГРУППАХ) // Современные проблемы науки и образования. 2015. № 4. ;URL: https://science-education.ru/ru/article/view?id=20926 (дата обращения: 25.02.2026).



