Количество нанесенной платины составляет 0,4 массовых процента, исходя из разницы концентраций платинохлороводородной кислоты до и после облучения (определено спектрофотометрически). Количество нанесенной платины, определенное рентгено-флуориесцентным анализом, равно 0,49 массовых процентов. Размер частиц платины от 0,8 до 1,5 нм. Дальнейшее модифицирование поверхности платинированного TiO2 проводили с водным раствором H2SO4. Навеску 1 г катализатора помещали в колбу объемом 100 мл и добавляли 50 мл раствора H2SO4 заданной концентрации: 0,1; 1,0; 4,0; 10,0 м и помещали в термостат, выдерживая при температуре 500С в течение 2 часов. После эксперимента колба 12 часов находилась при комнатной температуре. Раствор от образцов отделяем центрифугированием при V=7000 об/мин в течение 10 минут, после чего определяем электропроводность раствора. Осадок TiO2 заливаем 100 мл дистиллированной водой с последующим центрифугированием. Такая операция осуществлялась до тех пор, пока электропроводность смывной воды была близка к электропроводности исходной дистиллированной воды (10-5 Сименс). Также определяем наличие сульфат анионов качественной реакцией с хлоридом бария[1]. Полученные результаты позволяют перейти к испытанию фотокатализатора, пригодного для практического применения очистки воздуха, положа в основу следующие требования:
- иметь максимально возможный квантовый выход в реакциях фотоокисления;
- полностью окислять различные классы органических, элементоорганических и неорганических соединений;
- не дезактивироваться как исходными веществами, так и промежуточными продуктами фотокаталитических реакций.
Исследования фотокатализаторов проводили в герметическом статическом реакторе, в котором задавалась начальная концентрация исследуемого вещества. В дальнейшем осуществлялся контроль изменения концентрации как исходного реагента, так и продуктов реакции, образующихся в процессе фотокаталитического окисления.
Взвешенный на электронных весах порошкообразный катализатор TiO2 наносится на стеклянную пластину площадью 3 см2 с образованием пленки фотокатализатора плотностью 2 мг/см2. После сушке при комнатной температуре пластина помещалась в кварцевый реактор с оптическим окном (рис. 1).
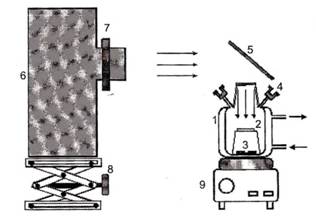
1- реактор; 2 - образец; 3 – якорек; 4 – пробоотборник; 5 – зеркало; 6 – источник УФ-света ЛОС-2; 7 – держатель для светофильтров; 8 – подставка; 9 – магнитная мешалка.
Рис. 1. Экспериментальная установка для испытания фотокатализатора
Реакционная смесь в реакторе перемешивалась пропеллером 3, изготовленным на основе якорька магнитной мешалки. Облучение УФ-ультрафиолетовым светом с τ от 320 до 400 нм осуществлялось спектральным осветителем ЛОС-2, с интенсивностью излучения на образце 220 мВт/см2.
В герметично закрытый реактор аналитическим микрошприцем вводятся исследуемые вещества и выдерживаются от 5 до 15 минут для установления в реакторе адсорбционно-десорбционного равновесия, которое определялось хроматографически по отсутствию изменения концентрации исходного реагента во времени. После установления равновесия измерялись начальные концентрации исходных веществ, находящихся в газовой фазе реактора, и на исследуемый образец подавалось УФ-излучение. Пробы для анализа отбирались из реактора каждые 30 секунд.
В целях сравнения активности различных образцов TiO2 измеряли скорости реакций фотокаталитической минерализации бензола – С6Н6 и угарного газа – СО. При проведении испытаний с тремя типами фотокатализаторов их концентрация в реакторе составляла: бензола – 500 ppm; угарного газа – 300 ppm.
Для эксперимента изготовлено 6 образцов (по 3 на каждый тип фотокатализатора) диоксида титана; основанием для всех образцов является Hombifine M (Sуд=341 м/г2; 100% анитаз) фирмы Sachtleben Chemie GmbH, т.е. образы: № 1 Hombifine M; № 2 Hombifine M, допированный платиной; № 3 Hombifine M, допированный платиной и модифицированный серной кислотой. Для экспериментального определения дезактивации фотокатализатора, на каждом образце проводили три серии последовательных экспериментов с одним тест веществом. По окончании эксперимента реактор открывали и продували в течение 30 минут воздухом из газовой линии, очищенным от СО2 и следов органических веществ, на блоке очистки газов БОГ-85. Результаты исследований представлены на рис. 2 – 4.
1-й эксперимент
2-й эксперимент
3-й эксперимент
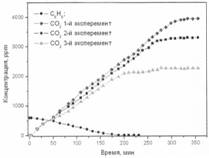
Образец 1
1-й эксперимент
2-й эксперимент
3-й эксперимент
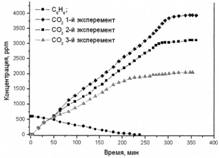
Образец 2
1-й эксперимент
2-й эксперимент
3-й эксперимент
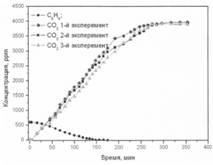
Образец 3
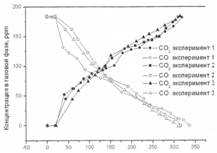
Рис. 2. Фотоокисление бензола на образцах 1-3

Образец 1 Образец 2 Образец 3
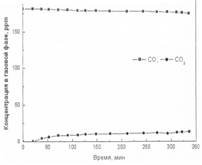
Рис. 3. Фотоокисление угарного газа на образцах 1-3
Образец № 1 – окисление бензола.
Значительного различия в начальных скоростях фотоокисления бензола не наблюдалось, однако, как видно из графика, после 100 минуты эксперимента различие в скоростях стало существенным. Во всех трех экспериментах значительного различия в скорости адсорбции бензола на поверхности фотокатализатора не наблюдалось.
Таблица 1
Результаты эксперимента по фотоокислению бензола на образце № 1
|
№ эксперимента |
Скорость выделения СО2 на начальном участке, ppm/мин |
Выход СО2, ppm |
|
1-й эксперимент |
12,7 |
3629 |
|
2-й эксперимент |
11,9 |
3104 |
|
3-й эксперимент |
10,1 |
2236 |
При проведении 2-го эксперимента наблюдается падение полного выхода СО2 в газовую фазу реактора на 15%, а при проведении 3-го эксперимента – на 39% от расчетного ~ 3600 ppm. При увеличении времени эксперимента на 30 минут, концентрация СО2 ни во втором, ни в третьем случае не изменилась, что свидетельствует о дезактивации бензолом образца № 1. В процессе проведения реакции происходило потемнение поверхности фотокатализатора.
Образец № 2 – окисление бензола.
Значительного различия в начальных скоростях фотоокисления бензола также не наблюдалось, однако, как видно из графика, после 100 минут эксперимента различие в скоростях стало существенным. Во всех трех экспериментах значительного различия в скорости адсорбции бензола на поверхности фотокатализатора не наблюдалось.
Таблица 2
Результаты эксперимента по фотоокислению бензола на образце № 2
|
№ эксперимента |
Скорость выделения СО2 на начальном участке, ppm/мин |
Выход СО2, ppm |
|
1-й эксперимент |
12,6 |
3658 |
|
2-й эксперимент |
10,9 |
3136 |
|
3-й эксперимент |
8,9 |
2052 |
При проведении 2-го эксперимента наблюдается падение полного выхода СО2 в газовую фазу реактора на 14%, а при проведении 3-го эксперимента – на 44% от расчетного ~ 3600 ppm. При увеличении времени эксперимента на 30 минут, концентрация СО2 ни во втором, ни в третьем эксперименте не изменилась, что свидетельствует о дезактивации образца № 2 бензолом. В процессе проведения исследования происходило потемнение поверхности фотокатализатора.
Образец № 3 – окисление бензола.
При фотоокислении бензола на образце № 3 значительного различия ни в начальных, ни в конечных скоростях не наблюдалось. Во всех проведенных экспериментах на образце № 3 скорости адсорбции бензола на поверхности фотокатализатора имеют несущественные отклонения.
Таблица 3
Результаты экспериментов по фотоокислению бензола на образце №1
|
№ эксперимента |
Скорость выделения СО2 на начальном участке, ppm/мин |
Выход СО2, ppm |
|
1-й эксперимент |
17,6 |
3693 |
|
2-й эксперимент |
16,8 |
3655 |
|
3-й эксперимент |
16,6 |
3671 |
При проведении 3-х экспериментов различие в полном выходе СО2 в газовую фазу составляло не более 3%, что можно считать погрешностью метода измерения. Дезактивация фотокатализатора образца № 3 не наблюдалась. В процессе исследования реакции потемнения поверхности фотокатализатора не происходило.
Образец № 1 – окисление оксида углерода.
При фотоуничтожении оксида углерода на образце № 1 в течение 340 минут изменение начальной концентрации СО составило 14 ppm, изменения концентрации СО2 в газовой фазе реактора не наблюдалось.
На основании полученных результатов можно сделать вывод: реакция фотокаталитического окисления оксида углерода на образце № 1 не идет.
Образец № 2 и № 3 – окисление оксида углерода.
Во всех трех экспериментах по фотокаталитическому окислению оксида углерода значительного различия в скоростях выделения СО2 в газовую фазу реактора и в скорости адсорбции оксида углерода не обнаружено. Дезактивация образцов № 2 и № 3 при фотоокислении СО не происходит.
При проведении исследований по фотокаталитическому уничтожению бензола на образцах № 1 и № 2 происходило потемнение поверхности фотокатализатора, что приводило к дезактивации, а на образце № 3 такого эффекта не наблюдалось и не происходило дезактивации катализатора. Следовательно, необходимо определить вещества, вызывающие дезактивацию и определить промежуточные соединения при фотоокислении бензола. С этой целью после эксперимента образцы № 1 и № 2 анализировали, используя метод FTIR-спектроскопии. При анализе адсорбированных веществ на образце № 3 эксперимент после 50 минут останавливали. В результате было обнаружено, что в процессе глубокого окисления бензола на поверхности фотокатализаторов, не модифицированных минеральными кислотами, образуются фенольные пленки, которые, как предполагается, и вызывают дезактивацию. Анализ поверхности образцов № 3 показал, что при неполном фотоокислении бензола на поверхности образуются фенол, гидрохинон, резорцин и пирокатехин, однако, при увеличении времени УФ-облучения образцов, обработанных серной кислотой, бензол и все промежуточные продукты реакции окисляются до углекислого газа и воды. Предположительная схема фотоокисления бензола представлена на рис. 4.
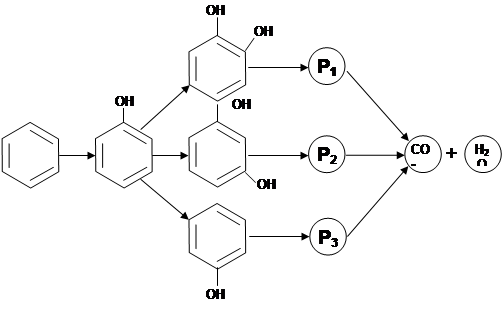
Рис. 4. Схема процесса фотокаталитического окисления бензола до СО2 и Н2О через образование промежуточных продуктов реакции
Выводы
Полученные результаты позволяют сделать следующие выводы:
- в реакции фотоокисления оксида углерода исходный фотокатализатор Hombifine M не проявляет активности и его использование для уничтожения СО2 нецелесообразно;
- фотокаталитическая реакция окисления оксида углерода с помощью фотокатализатора, допированного платиной, идет с определенной скоростью. При окислении бензола платинированный фотокатализатор теряет свою активность и дезактивируется медленно, чем чистый TiO2;
- платинированный и модифицированный серной кислотой фотокатализатор Hombifine M окисляет оксид углерода до СО2. При окислении газофазного бензола дезактивация фотокатализатора не происходит;
- используя метод FTIR-спектроскопии определено, что при фотокаталитичеком окислении бензола веществом, вызывающем дезактивацию фотокатализатора, является фенол. Экспериментально показано, что фотокатализатор, модифицированный серной кислотой, в процессе фотоокисления бензола не дезактивируется.
Суммируя полученные данные, заключаем, что катализатор Hombifine M |Pt| H2SO4 наиболее перспективен для использования в фотокаталитическом воздухоочистительном оборудовании [1,2].
Рецензенты:Шаталов Р.Л., д.т.н., профессор, Кафедра машин и технологий обработки металлов давлением, Университет машиностроения, г. Москва;
Невская Г.Ф., д.м.н., профессор, зав. кафедрой экологии Московского государственного открытого университета, г. Москва.
[1]Исследования по модификации поверхности TiO2 выполнялись в институте Катализа СО РАН совместно с кандидатами химических наук Бавыкиным Д.В. и Козловым Д.В.
Библиографическая ссылка
Курылев В.В., Владимиров С.Н. РАЗРАБОТКА ФОТОКАТАЛИЗАТОРА ДЛЯ ВОЗДУХООЧИСТИТЕЛЬНОГО ОБОРУДОВАНИЯ // Современные проблемы науки и образования. 2015. № 4. ;URL: https://science-education.ru/ru/article/view?id=20751 (дата обращения: 11.02.2026).



