За последние 20 лет отмечен неуклонный рост частоты рака тела матки [6], который занимает 4-е место среди злокачественных новообразований, встречающихся у женщин.
В последние годы получены новые данные о патогенетических механизмах формирования и развития рака эндометрия [1, 5, 9]; в частности, установлена тесная взаимосвязь репродуктивной и иммунной систем. В ряде научных исследований убедительно доказан тот факт, что состояние клеточного и гуморального иммунитета является одним из основных факторов, определяющих течение заболевания, в том числе рака эндометрия [4, 7]. Работы последних лет показали, что состояние Т- и В-звеньев иммунной системы у женщин с гиперплазией эндометрия характеризуется угнетением количества и функциональной активности Т-клеток, тенденцией к усилению продукции сывороточных рецепторов; при атипической гиперплазии эндометрия описана активация показателей В-клеточного иммунитета, а изменения в системе Т-лимфоцитов оказались менее выраженными [7]. Потенциально важную роль в формировании новообразований играют цитокины, являющиеся не только регуляторными молекулами иммунной системы, но и посредниками межсистемных взаимодействий, но до настоящего времени нет единого мнения о степени их участия в патогенезе гиперпластических процессов эндометрия. Возможная роль факторов иммунной системы в патогенезе рака эндометрия привлекает внимание исследователей; при этом факторы локального иммунитета, присутствующие в опухоли и прилежащей к ней ткани, остаются малоизученными, а сведения о них немногочисленны и противоречивы.
Целью настоящего исследования явилось изучение некоторых факторов локального иммунитета у больных раком эндометрия и миомой матки.
Материалы и методы. В исследование были включены 45 больных раком эндометрия (РЭ) Т1-2N0M0 (30 больных), миомой матки (ММ, 9 больных), а также раком эндометрия в сочетании с миомой матки (РЭ+ММ, 6 больных), которым первым этапом лечения было выполнено хирургическое вмешательство в соответствии с существующими стандартами в отделении онкогинекологии ФГБУ «РНИОИ» МЗ РФ. Сравнительная характеристика групп больных по возрасту и сопутствующей патологии не выявила достоверных различий, что позволило провести анализ результатов исследования.
Состояние локального иммунитета изучали в образцах тканей опухоли и здоровой ткани, взятых при проведении оперативного вмешательства. Удаленные опухоли подвергались патоморфологическому исследованию; кроме того, отдельные фрагменты опухолевой и визуально немалигнизированной ткани, которую считали здоровой, гомогенизировали с помощью дезагрегирующего устройства BD Medimachine. В гомогенатах тканей определяли популяционный и субпопуляционный состав лимфоцитов на проточном цитометре FACSCantoII (BD) с панелью антител T-, B-, NK (CD45, CD3, CD4, CD8, CD19, CD16/56), результаты выражали в процентах от общего количества лимфоцитов.
Статистическую обработку данных выполняли с помощью параметрических и непараметрических методов (t-критерий Стьюдента, критерий Уилкоксона, метод непрямых разностей).
Результаты исследования
Результаты исследования представлены в табл. 1 и на рис. 1, 2.
Таблица 1
Показатели локального клеточного иммунитета в образцах тканей больных РЭ и ММ
|
Образцы тканей |
Субпопуляции лимфоцитов, % |
||||
|
CD3+ |
CD3+CD4+ |
CD3+CD8+ |
CD19+ |
CD16/56+ |
|
|
Опухоль РЭ (n=21) |
85,75±2,17* ** |
37,47±4,37* ** |
45,5±3,8 ** |
1,48±0,46 |
10,2±2,14* ** |
|
Опухоль ММ (n=9) |
64,24±5,66
|
23,2±3,07
|
31,5±3,5
|
1,01±0,4 |
32,84±6,12
|
|
Здоровая ткань больных РЭ (n=19) |
73,5±3,17 *** |
24,4±1,5 |
43,0±3,74 *** |
1,82±0,68 |
22,0±3,0 *** |
|
Здоровая ткань больных ММ (n=9) |
59,24±4,76
|
20,14±3,17 |
29,14±2,34
|
0,76±0,11 |
38,0±4,8
|
Примечание. * – статистически достоверные отличия показателей опухолевой ткани РЭ от здоровой (p<0,05); ** – статистически достоверные отличия показателей опухолевой ткани РЭ от ММ; *** – статистически достоверные отличия показателей здоровой ткани РЭ от ММ.
Как видно из табл.1, показатели количества лимфоцитов некоторых субпопуляций, присутствующих в образцах опухолевой ткани, статистически достоверно отличаются от соответствующих показателей немалигнизированной ткани. Так, процентное содержание Т-лимфоцитов в ткани РЭ оказалось выше за счет CD3+CD4+ клеток, а NK-лимфоцитов – ниже, чем в непораженной ткани; уровни CD3+CD8+ и В-лимфоцитов не различаются. При проведении аналогичного анализа показателей локального клеточного иммунитета в образцах тканей больных ММ статистически достоверных отличий от показателей здоровой ткани не отмечено. Сопоставление факторов локального иммунитета в ткани злокачественной и доброкачественной опухолей показало, что содержание Т-лимфоцитов исследованных субпопуляций было статистически достоверно выше в ткани РЭ по сравнению с тканью ММ, а содержание натуральных киллеров, напротив, выше в ткани ММ (табл. 1). Обращает на себя внимание, что характеристики непораженной ткани также имеют статистически значимые различия: при РЭ в ее образцах уровни CD3+ и CD3+CD8+ лимфоцитов были выше, а уровень CD16+/56+ клеток, напротив, ниже, чем при ММ.
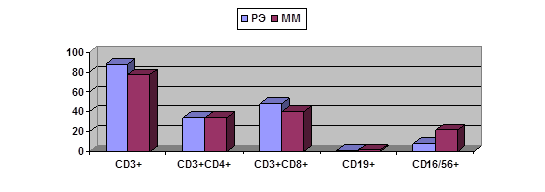
Ситуация развития в одном органе двух опухолей, одна из которых злокачественная, а другая доброкачественная, может отразиться на их лимфоцитарном микроокружении и детализировать взаимоотношения «опухоль-организм» в таких случаях. Сравнительная характеристика исследованных показателей в образцах тканей РЭ и ММ, развивающихся по отдельности и вместе, представлена на рис. 1 и 2.
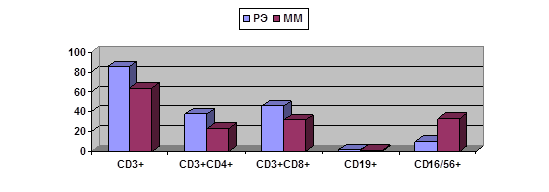
А
Б
Рис. 1. Сравнительная характеристика тканевого содержания лимфоцитов в опухолях больных РЭ и ММ при их раздельном и совместном развитии.
А – при РЭ и ММ, выявленных у разных больных;
Б – при РЭ и ММ, выявленных у одной больной
Как видно из рис. 1, при одновременном развитии злокачественной и доброкачественной опухоли характеристики лимфоцитарного микроокружения доброкачественной опухоли оказываются ближе к наблюдаемым при злокачественной. Так, если при ММ в отсутствии РЭ показан ряд отличий содержания лимфоидных субпопуляций от обнаруженных при РЭ (рис. 1А), то при одновременном наличии ММ и РЭ большинство этих различий нивелируется (касающиеся содержания CD3+, CD3+CD4+, CD3+CD8+ клеток); статистически значимые различия сохраняются только для NK-клеток (рис. 1Б). Возможно, это отражает дистантное влияние злокачественной опухоли на окружение доброкачественной.
Интересно, что непораженная ткань эндометрия у больных ММ и у больных РЭ+ММ, также имела ряд различий по составу лимфоцитов исследованных субпопуляций (рис. 2), а именно, в первом случае ткань содержала меньше Т- и В-лимфоцитов и больше NK-клеток (59,24±4,76, 0,76±0,11 и 38,0±4,8% против 71,4±1,89, 2,98±0,97 и 19,4±1,4% соответственно; для всех показателей p<0,05). Напротив, при РЭ лимфоцитарный состав как опухоли, так и немалигнизированной ткани вне зависимости от наличия или отсутствия у больных ММ был аналогичен.
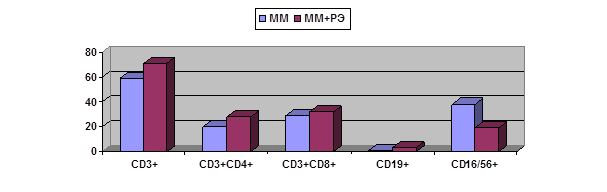
Рис. 2. Сравнительная характеристика тканевого содержания лимфоцитов в немалигнизированной ткани при ММ в зависимости от наличия у больной РЭ
Заключение
Таким образом, при ММ, развивающейся вместе с РЭ, в формировании иммунологического окружения доминирует влияние последнего, т.е. лимфоцитарный состав ткани опухоли и близлежащей непораженной ткани менее значительно отличается от показателей, обнаруженных при РЭ, чем при ММ в отсутствии РЭ. Нами ранее получены подобные различия при анализе тканевого цитокинового состава в одновременно удаленных аденоматозных полипах и аденокарциномы толстой кишки, т.е. влияние злокачественной опухоли на спектр факторов локального иммунитета оказалось преобладающим над доброкачественной [2].
Итак, обнаружены черты как сходства, так и различий показателей локального иммунитета в доброкачественных и злокачественных опухолях эндометрия. К первым относится выраженное преобладание лимфоцитов Т-ряда над В-клетками в ткани обеих опухолей и немалигнизированных образцов, что присуще многим тканям по сравнению с периферической кровью [2, 3]. Вторые определяются преимущественным накоплением CD3+CD4+ и CD3+CD8+ клеток в ткани злокачественной опухоли, а NK-лимфоцитов – в ткани доброкачественной. Частично такие различия найдены и в непораженной ткани, что, по нашему мнению, свидетельствует о дистантном влиянии РЭ на состав иммунологического микроокружения, о чем также говорит приближение характеристик последнего в ткани ММ и прилежащей к ней здоровой ткани к характеристикам, наблюдаемым при РЭ, в случае развития обоих новообразований у одной больной. Описанные в литературе сведения о более высоком содержании CD3+СD8+ клеток и более низком количестве NK-лимфоцитов в крови больных ММ по сравнению с РЭ при высоком уровне В-лимфоцитов при обоих новообразованиях [7], на наш взгляд, подтверждают особенности локального иммунитета по сравнению с системным и необходимость их исследования для понимания процессов взаимодействия «опухоль-организм», происходящих на органном и тканевом уровне.
Рецензенты:
Николаева Н.В., д.м.н., ассистент кафедры онкологии ГБОУ ВПО Ростовского государственного медицинского университета Минздрава РФ, г. Ростов-на-Дону;
Каймакчи О.Ю., д.м.н., ассистент кафедры онкологии ГБОУ ВПО Ростовского государственного медицинского университета Минздрава РФ, г. Ростов-на-Дону.
Библиографическая ссылка
Златник Е.Ю., Никитин И.С., Никитина В.П., Новикова И.А., Кравцова О.Е., Бахтин А.В., Селютина О.Н. ФАКТОРЫ ЛОКАЛЬНОГО ИММУНИТЕТА ПРИ РАКЕ ЭНДОМЕТРИЯ И МИОМЕ МАТКИ // Современные проблемы науки и образования. 2015. № 4. ;URL: https://science-education.ru/ru/article/view?id=20478 (дата обращения: 25.02.2026).



