В растительных объектах ароматические кислоты представлены, в основном, двумя подгруппами: производными коричной и производными бензойной кислот [7].Учитывая разнообразие представителей данных подгрупп, существенным вкладом при разработке методик их анализа может служить возможность прогноза электрофоретического поведения за счет теоретического расчета подвижности.
Определяющим фактором в КЗЭ является эффективная или собственная электрофоретическая подвижность частицы (µэф), которая, в свою очередь, зависит от двух основополагающих факторов: заряда и радиуса частицы при условии постоянных значений вязкости [6] (формула 1).
q – заряд иона;
η – вязкость раствора;
r – радиус иона.
В экспериментеµэф рассчитывают по разности между общей (наблюдаемой) электрофоретической подвижностью и электрофоретической подвижностью электроосмотического потока (ЭОП) по формуле 2 [6,8]:
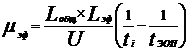 (2)
(2)
Lобщ- общая длина капилляра, см
Lэф- эффективная длина капилляра, см;
U- величина рабочего напряжения, вольт;
ti- время миграции компонента, с;
tЭОП- время миграции маркера ЭОП, с;
Теоретические модели расчета электрофоретической подвижности в электрофорезе основаны на соотношении заряд/молекулярная масса, а не заряд/радиус, ввиду сложности определения последнего. При этом заряд предлагается оценивать из значений pKa, как функции от рН, через уравнение Гендерсона-Хассельбаха [14,20]. В этом случае рН буфера является наиболее важной переменной при теоретических расчетах.Для кислот данное уравнение выглядит следующим образом (формула 3) [1]:
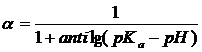 (3)
(3)
где α – доля ионизированной формы (применительно к моделям – заряд (q)).
Среди известных моделей (уравнения Grossman, Compton, Offord, CifuentesandPoppe), наиболее предпочтительной считается модель Offord (Оффорда) (формула 4)[14,20]:
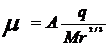 (4)
(4)
q –заряд (знак заряда зависит от свойств аналита (анион/катион));
A– константа (определяется эмпирически);
Mr– молекулярная масса.
Определенный вклад в подвижность могут вносить также такие параметры системы, как состави концентрация буферного раствора, что также необходимо учитывать при теоретическом прогнозе электрофоретического поведения.
Цель работы
На примере ароматических кислот, содержащихся в ЛРСизучить возможность прогноза электрофоретического поведения веществ, исходя из значений констант ионизации и молекулярных масс, провести оценку зависимости данного прогноза от концентрации и состава ведущего электролита. Сформулировать ряд методологических подходов к анализу ароматических кислот в условиях КЗЭ.
Материалы и методы исследования
Работу вели на системе капиллярного электрофореза Капель 105 (группа компаний Люмэкс, Россия) с кварцевым капилляром (диаметр 75 мкм, Lобщ/Lэф= 60/50 см). Детектирование осуществляли спектрофотометрически при 280нм, напряжение составляло +20 кВ, температура 20 0С.
Все анализируемые соединения являются анионами уже при рН 3-4, ионизируясь по карбоксильной группе. Однако при таких значениях рН электролита вести анализ в условиях зонного электрофореза будет затруднительно, ввиду того, что подвижность электроосмотического потока будет практически подавлена. В этой связи для того, чтобы достичь приемлемых параметров миграции кислот, необходимо использовать электролит, имеющий рН от 8 до 11, так как скорость потока в этом случае будет максимальна [3]. Готовились две буферные системы: буферная система №1 включала боратный электролит с рН 8,0, 9,2, 10,0 и 10,8; буферная система №2 включала карбонатный электролит с рН 9,2, 10,0 и 10,8. Учитывая, что карбонатный буферный раствор готовится только в диапазоне рН от 9,2 до 11, то электролит с рН 8,0 для буферной системы №2 создавали с помощью фосфатного буферного раствор. Все растворы готовили в соответствии с [2, 9], с контролем полученных значений потенциометрически.
Целесообразно также было проверить влияние существенных изменений в концентрации электролита на прогноз электрофоретического поведения веществ. Поэтому все электролиты готовили на двух уровнях концентраций 10 и 25 мМ.Выбор верхнего уровня концентрации буферных системобусловлен значениями силы тока, которые рекомендуются производителем (до 75 мкА) [3].
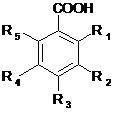
Среди представителей ароматических кислот использовалисьстандартные образцы производных коричной кислоты(кофейная, 99,7%,п-кумаровая, 99,5%, синаповая, 99,5%, коричная, 99,7%(производства «Сигмабиосинтез»), феруловая, 99% (производства ООО «НПО АЛЬФАРМ»)и производных бензойной кислоты(бензойная, 99%, салициловая, 99,5%,галловая, 99%, сиринговая, 97% (производства «Сигмабиосинтез»), п-гидроксибензойная, ≥99%, протокатеховая, ≥97%, β-резорциловая, ≥97%,гентизиновая,≥98%, ванилиновая ≥97% (производства Sigma-Aldrich).
Для теоретического расчета подвижности, согласно модели Оффорда, применялись описанные в литературе параметры молекул (pKa и молекулярная масса) (табл. 1-2).
Таблица 1
Формулы и характеристики (pKa, Mr) производных коричной кислоты
|
Общая формула |
R1 |
R2 |
R3 |
Название кислоты |
рКа |
Mr |
|
|
Н |
Н |
Н |
Коричная (cin) |
4,51[12] |
148,16 |
|
Н |
ОН |
Н |
п-кумаровая (p-coum) |
4,34; 8,83 [10] |
164,16 |
|
|
ОН |
ОН |
Н |
Кофейная (caf) |
4,37; 8,55; 12,5 [15] |
180,16 |
|
|
ОСН3 |
ОН |
Н |
Феруловая (fer) |
4,3; 8,81 [10] |
194,18 |
|
|
ОСН3 |
ОН |
ОСН3 |
Синаповая (sin) |
4,25; 8,89 [10] |
224,21 |
Таблица 2
Формулы и характеристики (pKa, Mr) производных бензойной кислоты
|
Общая формула |
R1 |
R2 |
R3 |
R4 |
R5 |
Название кислоты |
рКа |
Mr |
|
|
Н |
Н |
Н |
Н |
Н |
Бензойная (benz) |
4,08 [12] |
122,12 |
|
ОН |
Н |
Н |
Н |
Н |
Салициловая (sal) |
2,79; 13,23 [12] |
138,12 |
|
|
Н |
Н |
ОН |
Н |
Н |
п-гидроксибензойная (p-hob) |
4,38; 9,67 [12] |
138,12 |
|
|
Н |
ОН |
ОН |
Н |
Н |
Протокатеховая (prot) |
4,16; 9,4; 12,84 [12] |
154,12 |
|
|
ОН |
Н |
ОН |
Н |
Н |
β-резорциловая (res) |
3,1; 9,81; 13,35 [12,17] |
154,12 |
|
|
ОН |
Н |
Н |
ОН |
Н |
Гентизиновая (gen) |
3.1; 10.20; 13.41 [16,17] |
154,12 |
|
|
Н |
ОН |
ОН |
ОН |
Н |
Галловая (gal) |
3,94; 9,04; 11,17; 14,8 [12] |
170,12 |
|
|
Н |
ОСН3 |
ОН |
Н |
Н |
Ванилиновая (van) |
4,42; 9,39 [11] |
168,15 |
|
|
Н |
ОСН3 |
ОН |
ОСН3 |
Н |
Сиринговая (syr) |
4,34; 9,49 [13] |
198,17 |
Результаты исследования и их обсуждение
На первом этапе определялизависимостьпрактических значений электрофоретической подвижности веществ(формула 2)от соотношения q/М2/3, для разных буферных систем в указанном диапазоне рН.Результаты оценки данной зависимости представлены в табл. 3, а также графическина примере буферной системы №2 (рис.1 и 2).
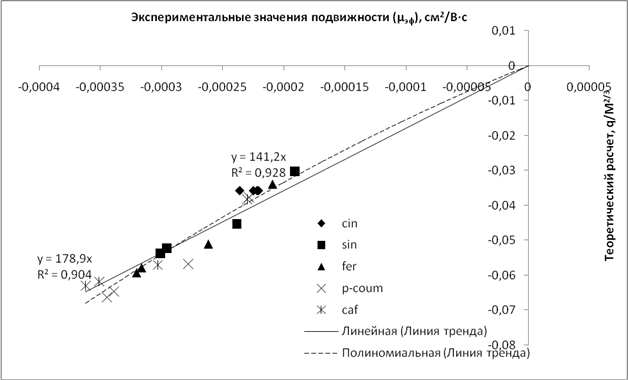
Рис.1.Зависимость экспериментальных значений µэфпроизводных коричной кислоты от соотношения q/M2/3в условияхбуферной системы №2 с концентрацией 25 мМ
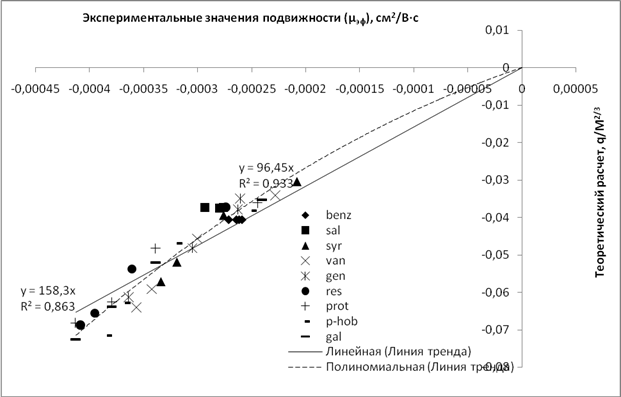
Рис.2.Зависимость экспериментальных значений µэфпроизводных бензойной кислоты от соотношения q/M2/3в условияхбуферной системы №2 с концентрацией 25 мМ
Таблица 3
Результаты оценки величины достоверности аппроксимациимежду экспериментальными значениями μэфвеществитеоретическими расчетами(q/М2/3) для буферных систем различных составов и концентраций
|
Группа соединений (тип линии тренда) |
Буферная система №1 |
Буферная система №2 |
||||||
|
Боратный электролит (10 мМ) |
Боратный электролит (25 мМ) |
Фосфатный/карбонатный электролит (10 мМ) |
Фосфатный/карбонатный электролит (25 мМ) |
|||||
|
Уравнениеграфика |
R2 |
Уравнениеграфика |
R2 |
Уравнениеграфика |
R2 |
Уравнениеграфика |
R2 |
|
|
Производные коричной кислоты (линейная) |
y = 188,34x |
0,5687 |
y = 192,79x |
0,5722 |
y = 174,52x |
0,9253 |
y = 178,94x |
0,9041 |
|
Производные коричной кислоты (полиномиальная) |
y = 6598,2x2 + 190,15x |
0,5687 |
y = -14817x2 + 188,84x |
0,5724 |
y = -106958x2 + 142,24x |
0,9442 |
y = -128648x2 + 141,2x |
0,9281 |
|
Производные бензойной кислоты (линейная) |
y = 172,05x |
0,3812 |
y = 177,05x |
0,3836 |
y = 156,61x |
0,8427 |
y = 158,38x |
0,8639 |
|
Производные бензойной кислоты (полиномиальная) |
y = 7277,5x2 + 174,21x |
0,3813 |
y = -9480,7x2 + 174,31x |
0,3837 |
y = -177113x2 + 97,055x |
0,9060 |
y = -186037x2 + 96,452x |
0,9331 |
Сравнение полученных результатов показывает, что наилучшая аппроксимация между теоретическими и практическими данными наблюдается в случае использованиябуферной системы №2. Для концентрации 25 мМ данная зависимость может быть описана уравнениями линейной регрессии с коэффициентами аппроксимации 0,9041 и 0,8639для производных коричной и бензойной кислот соответственно, что в целом позволяет использовать данные уравнения для теоретического расчета электрофоретической подвижности обеих групп соединений.При этом, исходя из уравнений, для производных коричной кислоты константа пересчета (А) составляет178,94, для производных бензойной кислоты – 158,38. В случае использования полиномиальной линии тренда для обеих групп соединений обеспечиваются несколько лучшие параметры коэффициента аппроксимации. Нужно также отметить, что концентрация ведущего электролита не оказывает существенного влияние ни на коэффициент аппроксимации, ни на уравнения графиков, что свидетельствует о том, что эффективная электрофоретическая подвижность анализируемых соединений значимо не зависит от концентрации используемого буфера.
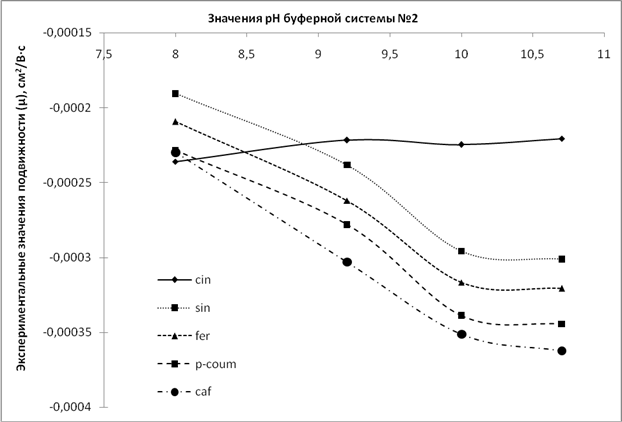
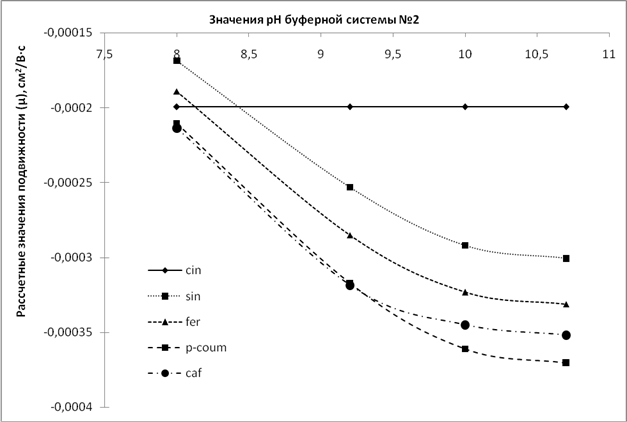
При применениибуферной системы №1 наблюдается достаточно низкая аппроксимация между двумя переменными, в том числе и при использовании для ее описания полиномиальной линии тренда. Данный факт может быть связан с возможными процессами комплексообразования, в которые вступают определяемые вещества и компонентыборатного электролита, что существенно влияет на подвижность веществ[14, 18]. В свою очередь это не позволит использовать данную буферную системудля воспроизведения теоретических расчетов.Кроме того, приведенные в различных источниках значения рКа, могут отличаться,особенно в случае многозарядных соединений, что дополнительно будет вносить погрешность прогноза электрофоретического поведения веществ.На следующем этапе необходимым было провести оценку целесообразности данной модели для прогноза электрофоретического поведения веществ, в частности для установления последовательности миграции анализируемых компонентов и их степени разделения. На рисунке 3 и 4 приводятся графики зависимости расчетных и экспериментальных значений подвижности от рН буферной системы №2 для производных коричной и бензойной кислот.Примеры поведения анализируемых веществ при изменении значений рН буферной системы №2 представлены на рис.5 и 6.
|
|
||
|
|
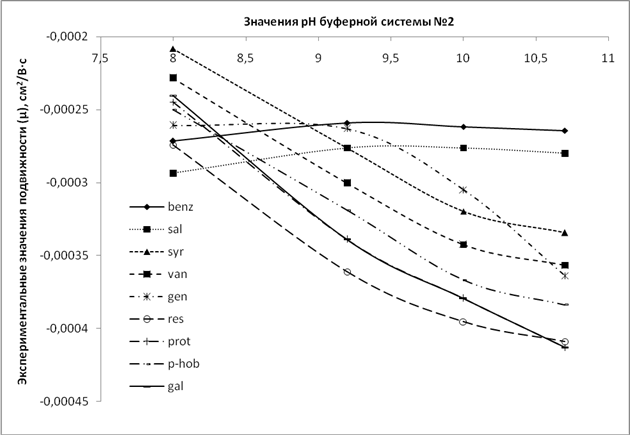
Рис.3.Графики зависимости экспериментальных (1) и расчетных (2) значений подвижности от рН буферной системы №2 для производных коричной кислоты
|
|
||
|
|
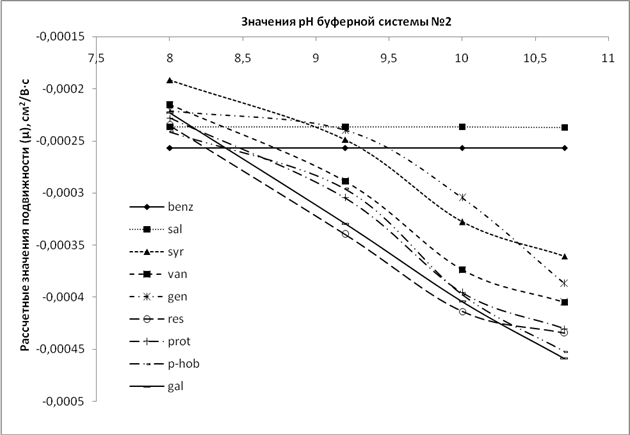
Рис.4.Графики зависимости экспериментальных (1) и расчетных (2) значений подвижности от рН буферной системы №2 для производных бензойной кислоты
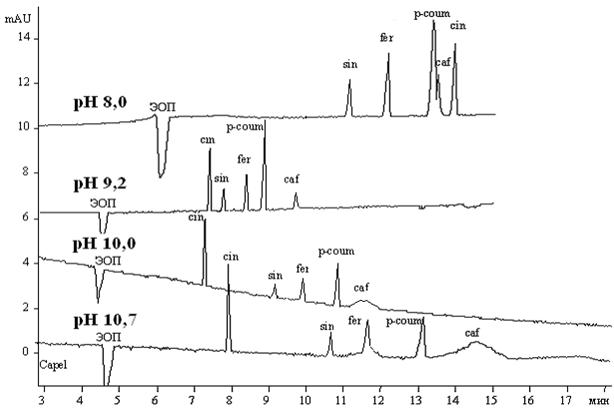
Рис.5.Электрофореграммы растворов модельной смеси производных коричной кислоты при различных рН буферной системы №2 (концентрация 25 мМ)
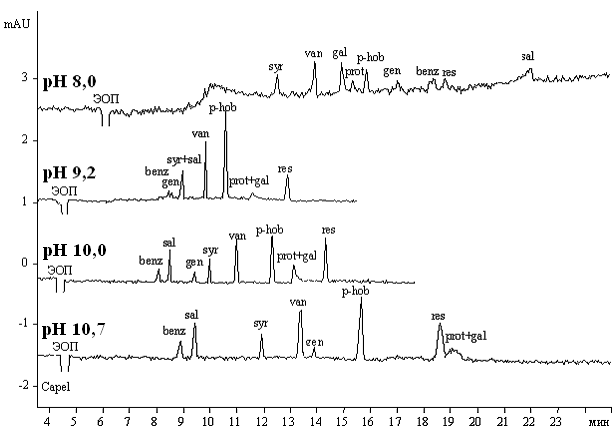
Рис.6.Электрофореграммы растворов модельной смеси производных бензойной кислоты при различных рН буферной системы №2 (концентрация 25 мМ)
Анализ графиков (рис. 3, 4) свидетельствует, что расчетные данные в целом отражают электрофоретическое поведение веществ во всем диапазоне рН буферной системы №2, что дает возможность прогнозировать значения рН и состав ведущего электролита с целью подбора оптимальных условий анализа веществ в условиях КЗЭ.
В то же время в ряде случаев наблюдается несоответствие электрофоретического поведения веществ теоретическому прогнозу. В частности не соответствует последовательность миграции бензойной и салициловой кислот на всех уровнях рН электролита, кофейной и п-кумаровой при рН электролита 10 и 10,8. Возможно, это связано с пространственными особенностями веществ,способностью образовывать водородные связи (салициловая кислота), а такжес различной степенью гидратации.Таким образом, не во всех случаях модельОффордапозволяет предсказывать истинное электрофоретическое поведение производных коричной и бензойной кислот, что предполагает ее использование только в качестве первого приближения.
На следующем этапе целесообразно было сравнить эффективность, которая достигается при использовании обеих буферных систем. Этот аспект важен в плане практического использования того или иного буферного раствора для анализа указанных соединенийв растительных объектах. Так как присутствие большого количества сопутствующих компонентов требует наличия достаточно высоких параметров эффективности и чувствительности методик. В таблицах4 и 5 приводится анализ параметров эффективностидля производных коричной и бензойной кислот, полученных с использование обеих буферных систем с концентрацией 25 мМ.
Таблица 4
Сравнительный анализ параметров эффективности производных коричных кислот для различных буферных систем с концентрацией 25 мМ
|
Кислота |
Эффективность, тыс. т.т |
|||||||
|
рН буферной системы №1 |
рН буферной системы №2 |
|||||||
|
8,0 |
9,2 |
10,0 |
10,8 |
8,0 |
9,2 |
10,0 |
10,7 |
|
|
cin |
205 |
349 |
237 |
257 |
142 |
223 |
234 |
173 |
|
p-coum |
207 |
228 |
176 |
146 |
103 |
176 |
138 |
73 |
|
caf |
49 |
193 |
200 |
175 |
155 |
111 |
44 |
2 |
|
fer |
205 |
282 |
256 |
232 |
136 |
199 |
169 |
61 |
|
sin |
193 |
480 |
287 |
279 |
143 |
210 |
189 |
136 |
Сравнительный анализ параметров эффективности производных бензойной кислот для различных буферных систем с концентрацией 25 мМ
|
Кислота |
Эффективность, тыс. т.т |
|||||||
|
рН буферной системы №1 |
рН буферной системы №2 |
|||||||
|
8,0 |
9,2 |
10,0 |
10,8 |
8,0 |
9,2 |
10,0 |
10,7 |
|
|
benz* |
85 |
76 |
192 |
105 |
58 |
76 |
56 |
34 |
|
sal |
62 |
184 |
73 |
108 |
48 |
60 |
151 |
109 |
|
p-hob |
213 |
190 |
175 |
117 |
125 |
140 |
221 |
97 |
|
prot |
89 |
75 |
73 |
90 |
121 |
50 |
44 |
26 |
|
res |
36 |
70 |
24 |
16 |
113 |
140 |
186 |
54 |
|
gen |
36 |
170 |
210 |
150 |
35 |
143 |
178 |
201 |
|
gal |
54 |
172 |
14 |
17 |
81 |
50 |
44 |
26 |
|
van |
246 |
234 |
212 |
183 |
109 |
341 |
237 |
110 |
|
syr |
239 |
304 |
229 |
108 |
92 |
60 |
265 |
122 |
Приведенные в таблице 5 результаты свидетельствуют, что для производных коричной кислоты на всех уровнях рН наилучшая эффективность достигается при использовании буферной системы №1, что предполагает использование для их анализа в сложных растительных объектах именно боратного электролита,несмотря на возможность образования соответствующих комплексов.Для производных бензойной кислоты явного преимущества по эффективности нет ни у одной из буферных систем, что позволяет использовать все указанные буферные составыв зависимости от соответствующих практических задач.
Таким образом, по результатам проведенных исследований можно сформулировать ряд методологических подходов к анализу ароматических кислот в условиях КЗЭ:
1. При разработке методик анализа ароматических кислот в условиях КЗЭ модель Оффорда применима для предварительного моделирования их электрофоретического поведениятолько при использовании карбонатного и фосфатного электролитов;
2. Целесообразным для анализа ароматических кислот является диапазон рН от 8 до 11, позволяющий достичь приемлемых параметров миграции и разделения веществ.
3. Концентрация ведущего электролита не сказывается значимо на теоретических расчетах подвижности. При этом варьирование концентрацией может быть использовано в ряде случаев только для повышения селективности анализа.
4. Для анализа производных коричной кислоты в сложных, многокомпонентных пробах целесообразно использование боратного электролита, обеспечивающего более высокие параметры эффективности.
Изучена возможность использования модели Оффорда для расчета значений электрофоретической подвижности ряда производных коричной и бензойной кислот. Показано, что данная модель применима только в условиях фосфатного и карбонатного электролитов. Установлено, что расчетные значения подвижностей,как правило, отражают истинное электрофоретическое поведениекислот.В аспекте практического использования применение боратного электролита обеспечивает наилучшие параметры эффективности при анализе производных коричной кислоты, что является важным преимуществом, по сравнению с фосфатным или карбонатным электролитом, при исследовании объектов сложных составов. С использованием полученных данных сформулирован ряд методологических подходов по анализу ароматических кислот методом КЗЭ.
Рецензенты:Лазарян Д.С., д.фарм.н., профессор, зав. кафедрой фармацевтической и токсикологической химии ПМФИ – филиала ГБОУ ВПО ВолгГМУ Минздрава России, г.Пятигорск;
Кодониди И.П., д.фарм.н., доцент кафедры органической химии ПМФИ – филиала ГБОУ ВПО ВолгГМУ Минздрава России, г.Пятигорск.
Библиографическая ссылка
Сенченко С.П., Компанцева Е.В. РАЗРАБОТКА МЕТОДОЛОГИЧЕСКИХ ПОДХОДОВК АНАЛИЗУ АРОМАТИЧЕСКИХ КИСЛОТ В УСЛОВИЯХ КАПИЛЛЯРНОГО ЗОННОГО ЭЛЕКТРОФОРЕЗА // Современные проблемы науки и образования. 2015. № 3. ;URL: https://science-education.ru/ru/article/view?id=20332 (дата обращения: 15.02.2026).