Влияние магнитного поля (МП) на организмы, особенно в условиях развития злокачественной пухоли, носит сложный характер, приводя к тонким изменениям физиологических процессов на всех уровнях его организации. В экспериментальных и клинических исследованиях установлено, что МП усиливает транспорт веществ через мембраны клеток опухоли, увеличивает поглощение тканями кислорода, способствует образованию макроэгических соединений, в результате чего происходит активация биосинтетических и окислительно-восстановительных процессов [4].
В трудах основоположников биофизики рака Н.М. Эмануэля, Р.Е. Кавецкого, Б.Н. Тарусова, Е.П. Сидорик, Я.И. Ажипы, Г.М. Франка представлены убедительные данные о сигналах электронного парамагнитного резонанса от различных видов опухолей у животных и человека, в том числе, саркомы 45, саркомы М-1, саркомы Иенса, карциномы Герена, лимфосаркомы Плисса, рака желудка и рабдомиосаркомы человека, а также других солидных и асцитных опухолей, источником которых являются парамагнитные центры и свободные радикалы. Н.М. Эмануэль показал, что некоторые парамагнитные центры, регистрируемые в перерождающихся тканях и в развивающихся опухолях, «отсутствуют» в нормальных тканях [6]. Очевидно, альтернативой опухолевым осцилляциям и ее частотному хаосу может служить ограничение частотного разброса путем навязывания жесткого линейного режима сканирования с многократной периодичностью повторения фронта возмущения от минимума к максимуму. Это воздействие может быть эффективным в отношении нарушения частотного контура опухолей, а так же получения структурно-функциональных пробоев на их клеточном уровне, то есть возможности изменения потока заряженных частиц через мембрану опухолевых клеток, высокой вариабельности мембранного потенциала[7,8], повышения проницаемости биомембран и клеточных барьеров к химиопрепаратам, а ,следовательно, увеличение их доставки в опухоль.
В связи с этим возникла необходимость выяснения возможности монотерапевтического влияния сканирующих магнитных полей (СК МП) на рост злокачественных новообразований, а затем выявления эффективности полимодального воздействия, включающего лекарственный и физический факторы в эксперименте как обоснование для дальнейшего использования в клинике.
Цель исследования
Изучить влияние сканирующих электромагнитных полей нарост опухоли и возможность повышения эффективности экспериментальной химиотерапии при их сочетанном воздействии.
Материалы и методы
Опыты проводились на 78 белых беспородных крысах-самцах с перевивной саркомой 45, соблюдая международные нормы и стандарты гуманного обращения с животными[2]. Штамм клеток С-45 предоставлен институтом канцерогенеза РОНЦ им. Н.Н. Блохина РАМН. Переменное магнитное поле в сканирующем режиме частот от 1 до 150 Гц, индукцией 20 мТл (СК МП) и постоянное магнитное поле, индукцией 20 мТл создавалось магнитотерапевтическим аппаратом «Градиент-4М». Методика экспериментальной химиотерапии осуществлялось следующим образом: под капсулу краевой зоны опухоли двукратно с интервалом 5 дней производили медленное, капельное введение раствора химиопрепарата (ХП) в количестве 0,5 мл концентрацией 0,5 мг/мл и одновременно осуществляли двустороннее воздействие на опухоль магнитным полем с помощью разнополюсных индукторов. По окончанию эксперимента животных декапитировали, определяли весовые параметры тимуса, надпочечников. Осуществляли идентификацию интегральных адаптационных реакций по показателям лейкограммы Шиллинга в мазках крови, окрашенных по Романовскому-Гимза, посчитанных на 200 клеток. Статистическую обработку полученныхрезультатовпроводили с использованием компьютерной программы Statistika 6.0. с определением достоверности различий по t-критерию Стьюдента.
Результаты
В опыте на 30 беспородных крысах-самцах с перевитой под кожу спины опухолью С-45 по достижению объема около 3,0 см3 было начато локальное воздействие СК МП экспозицией 10 минут без введения ХП. Продолжительность эксперимента составляла 3 недели — по 1 сеансу в день в течение 5 дней, двух дней перерыва с аналогичной дальнейшей последовательностью воздействий СК МП.
Как видно из табл.1, эффект сканирующего режима СК МП на рост С-45 поздних сроков развития заключался в сдерживании опухолевой прогрессии и был выражен в нелинейной динамике средних общегрупповых показателей объема.
При проведении межгруппового сопоставления показателей начального, максимального и минимального объемов С-45 были установлены количественные характеристики объективизации эффекта. Максимальная разница значений Vоп в контроле между Fmax-Fисх составила 19,14 см3, в то время как в основной группе – 11,64 см3, т.е. в 1,6 раза меньше.
Таблица 1
Показатели объема опухоли после локального воздействия СК МП
|
|
Начальный Vоп(см3) |
Максимальный Vоп(см3) |
Минимальный Vоп(см3) |
|
Основная группа, n=15 |
3,09±0,85 |
14,73±1,28* |
1,43±0,30*,** |
|
Контроль, n=15 |
2,96±0,76 |
22,1±3,43 |
16,97±2,82 |
Примечание:*-различия между показателями максимальных и минимальных значений объемов опухоли у крыс основной и контрольной групп достоверны (p<0,001); **-различия между показателями начального и минимального значения объемов опухолей у крыс основной группы достоверны(p<0,001).
Судя по показателям минимального объема С-45 можно было убедиться в том, что воздействия СК МП способствовало выраженному регрессированию опухоли, т.к. значения Vоп у крыс основной группы были меньше, чем в контроле в 12 раз. Кроме того были изучены некоторые интегральные показатели адаптивного статуса и неспецифической резистентности под влиянием СК МП, которые представлены в табл. 2.
Таблица 2
Интегральные показатели адаптивного статуса у крыс с саркомой 45 под влиянием СК МП
|
Группы животных |
Масса тимуса, мг (Мт) |
Масса надпочечников, мг (Мнд) |
Коэфф. Мт/Мнд |
Общие адаптационные реакции, % |
||
|
Тренировка |
Активация |
Стресс |
||||
|
Основная n=15 |
369,2±52,5*
|
50,4±3,8* |
7,38* |
40* |
20 |
40* |
|
Контроль n=15 |
123,7±13,2 |
68,8±2,7 |
1,78 |
20 |
20 |
60 |
Примечание: * - различия между показателями основной и контрольной группы достоверны, p<0,001.
О нормализации гомеостатических параметров под влиянием СК МП свидетельствовало увеличение в 3,0 раза показателей тимуса, снижение в 1,4 раза показателей массы надпочечников, что позволило ввести расчетный коэффициент их соотношения и определить косвенно межсистемные отношения эндокринного и иммунного статуса организма. Оказалось, что Коэффициент (Мт/Мнд) в основной группе животных превышает значения в контроле в 4,3 раза, указывая на повышение адаптивного потенциала организма. Свидетельством этому служили показатели соотношения антистрессорных реакций и стресса: доля адаптационных реакций тренировки и активации, характеризующихся физиологическим типом изменений, в группе животных-опухоленосителей с воздействием СК МП превышала таковую в контроле в 1,5 раза. Соответственно этому доля стрессорных реакций была выше на такую же величину. Таким образом, проведение испытаний противоопухолевого влияния СК МП свидетельствовало о перспективности его использования в экспериментальной химиотерапии опухолей.
В экспериментах по изучению противоопухолевого влияния СК МП в сочетании с перитуморальным введением циклофосфана in vivo были получены следующие результаты.
В первой серии опытов на 21 крысе с С-45с исходными значениями объема опухоли около 1 см3непосредственным результатом воздействия на зону опухоли у крыс (n=7) СК МП в период перитуморального введения циклофосфана (50мг/кг) явилась практически полная регрессия саркомы 45. Так, при средних значениях объема до воздействия = 0,9±0,06см3, показатели Vоп после сочетанного воздействия ЦФ+СК МП уменьшились до = 0,08±0,02см3, а затем окончательно регрессировали, в то время как в группе крыс (n=7) с монотерапией циклофосфаном наблюдалась колебательная динамика показателей объема С-45 от 1,3 до 1,8 см3, а в контроле (n=7) показатели были максимально высокими в среднем Vоп = 3,2 см3. Выявленная высокая эффективность сочетанного воздействия на рост саркомы 45 с исходными объемами около 1 см3, поддавшимися регрессии в 100% случаев, свидетельствовала о необходимости дальнейшего изучения противоопухолевого влияния СК МП в условиях экспериментальной химиотерапии опухолей больших объемов, достигших около 4 см3. Результаты представлены на рис. 1.
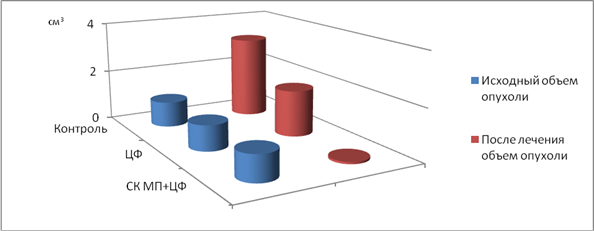
Рис.1. Динамика роста саркомы 45 у крыс с исходным объемом опухоли около 1 см3 под влиянием циклофосфана в сочетании с СК МП
В следующей серии опытов на 27 крысах с С-45 объемом более 4 см3 после 5-ти сеансов воздействия на опухоль СК МП с двумя перитуморальными введениями ЦФ (в 1 и 5-й день) можно было констатировать, что сочетание разномодальных факторов взаимно усиливает ингибирующее влияние на крупные опухоли. Как видно из табл.3 противоопухолевый эффект полимодальных воздействий в основной группе подтверждается данными об уменьшении объема С-45 в 3,8 раза по сравнению с контролем и в 2 раза – относительно монотерапии циклофосфаном в группе сравнения (табл. 3).
Таблица 3
Значения объемов опухоли и показателей адаптивного статуса крыс с саркомой 45 под влиянием перитуморального введения циклофосфана и воздействий СК МП
|
Группы животных |
Исходный объем С-45 |
Конечный объем С-45 |
Масса тимуса, мг (Мт) |
Масса надпочечников, мг (Мнд) |
Коэфф. Мт/Мнд |
Коэфф. АС/С |
|
1 гр. n=9 Введение ЦФ |
4,20±1,53 |
3,90±1,12* |
48,3±3,5 |
51,7±4,2 |
0,9 |
0,42 |
|
2 гр. n=9 ЦФ+СК МП |
3,9±1,61 |
1,9±0,53*,** |
83,8±10,3*,** |
44,6±6,1 |
1,9*,** |
1,5*,** |
|
3 гр. n=9 Контроль |
4,05±1,49 |
7,2±1,58 |
61,5±5,12 |
56,8±11,4 |
1,07 |
0,67 |
Примечание: * - различие показателей при сравнении с контролем достоверно, p<0,001
** - различие показателей при сравнении 1-ой и 2-ой опытных групп достоверно, p<0,001.
Необходимо подчеркнуть, что инволютивная динамика С-45 больших объемов при одновременном воздействии на опухоль физическим и лекарственным агентами сопровождалось более устойчивым поддержанием гомеостатических параметров. Так, показатели массы тимуса, коэффициенты соотношения тимуса и надпочечников, а также антистрессорных реакций превышали таковые в группе с монотерапией ЦФ в 1,7, 2 и 3,6 раза соответственно. Уменьшение этих показателей в контроле было менее выраженным, чем в группе с ЦФ, однако, в целом демонстрировало динамику угнетения иммунной и эндокринной систем со снижением адаптационного потенциала.
На основании полученных эффектов воздействия на опухоль и организм можно констатировать, что сочетание разномодальных факторов (ЦФ+СК МП) взаимно усиливает ингибирующее влияние на рост опухоли с одной стороны, а с другой, обеспечивает сохранение нормотипов интегральных адаптационных реакций, о чем свидетельствует коэффициент соотношения антистрессорных реакций и стресса, а так же сохраняются ключевые звенья иммунного и эндокринного статуса организма. Необходимо указать также на факт нетрадиционного применения циклофосфана, который обычно используется в эксперименте путем внутривенного введения или в брюшную полость как менее токсичные варианты лечения. Очевидно, что в результате перитуморального введения циклофосфана СК МП могло повлиять на проникновение препарата в ткани опухоли, что, по-видимому, связано с влиянием на механизмы переноса электрического заряда мембран опухолевых клеток. При этом, токсическое влияние на организм не увеличивалось, т.к. случаев диареи, снижения веса, выявления токсической зернистости в нейтрофилах не отмечалось.
Опыты с другим цитостатиком – цисплатином свидетельствовали, что СК МП усиливает проникновение препарата через мембраны опухолевых клеток. Во-первых, это подтверждалось результатами исследования, проведенными ранее на клеточной взвеси опухоли с помощью потенциалозависимых флуоресцентных зондов: наблюдалось двукратное увеличение свечения. При этом СК МП увеличивал мембранный потенциал живых опухолевых клеток на 80%, что воспроизводилось в 100% проведенных опытов[3]. Для ускорения диффузии цисплатина воздействие СК МП было усилено постоянной составляющей. Благодаря увеличению проницаемости мембраны для цитостатика, проявлялись морфологические признаки его повреждающего влияния, а именно, изменение размеров ядра, его разбухание, гиперхромность, а также усиление вакуолизации цитоплазмы. Во-вторых, данные о повышении проникновения цисплатина внутрь клеток дополнялись рутинным биохимическим определением содержания цисплатины в ткани опухоли. Определялось суммарное количество препарата в слоях опухоли на глубине до 1 см.
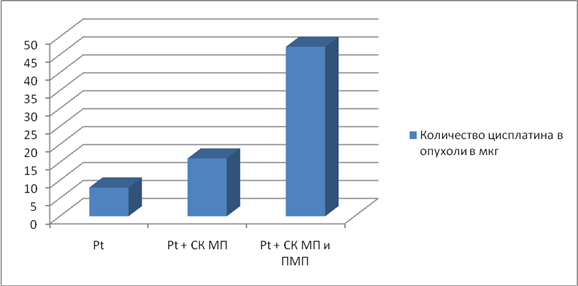
Рис.2. Накопление цисплатина в ткани опухоли под влиянием СК МП и ПМП
Из рис. 2 видно, что при введении под капсулу опухоли цисплатинаи одновременном воздействии СК МП и ПМП повышается содержание ХПв тканях почти в 6 раз (47,2 мкг), при воздействии только СКМП в 2 раза по сравнению с опухолевыми тканями не получившими воздействие электромагнитных полей, содержание цисплатина в которых составляло 8 мкг. По разработанной методике был получен патент.
Заключение
Подводя итоги результатам исследований, выполненных на клеточном и организменном уровнях с применением СК МП на этапах проведения химиотерапии, можно прийти к следующему заключению. Проведение экспериментальной химиотерапии в монорежиме введения цитостатика циклофосфана в околоопухолевое пространство С-45 в опытах in vivo сопровождалось слабо выраженным эффектом торможения роста опухоли: минимальные объемы С-45 отличались от максимальных всего в 1,3 раза. При одинаковых исходных объемах С-45 в контрольной и опытной группахс включением в схему противоопухолевой терапии СК МП различие показателей их минимальных и максимальных значений возросло в 10 раз. Это свидетельствовало о высокой эффективности бимодального воздействия на опухоль. Подтверждением этого стало биохимическое определение элементного содержания платины в ткани опухоли на примере перитуморального введения цисплатина с одновременным воздействием СК МП. При этом, содержание Pt на глубине около 1см двукратно превышало контрольные значения, а при усложнении пространственной конфигурации поля с помощью постоянной составляющей, эффект проникновения цитостатика увеличился в 6 раз.
Очевидно, реализация одного из важных механизмов формирования локального отклика живых клеточных систем связана с изменением электрической активности мембран, а именно, величины мембранного потенциала. Сама единая электромагнитная природа внешнего сканирующего воздействия и электрически заряженной мембраны живой клетки обеспечивает биофизические условия перехода в иное фунциональное состояние – гиперполяризации плазматической, митохондриальной, ядерной мембран на основе работы калиевых и натриевых каналов. Это способствует повышению проникновения цитостатиков вглубь опухолевой ткани путем мембранных механизмов трансформации сигнала опухолевых.
Кроме того, благодаря проводниковой роли СК МП, создание высокой концентрации цитостатика в перитуморальном пространстве, а затем в опухоли, не только оказало выраженное противоопухолевое влияние, но и смягчило токсическийэффект на гомеостатические системы организма, что способствовало сохранению имунно- гормональных регуляторных отношений. Показатели соотношения массы тимуса и надпочечников, а также соотношение клеточных элементов крови у крыс основной группы, включая содержание лимфоцитов, указывало на ограничение повреждающего влияния стресса и доминирование антистрессовых интегральных реакций организма.
Полученные результаты могут служить экспериментальным обоснованием для трансляции нового технологического решения химиотерапии в клинике.
Каймакчи О.Ю., д.м.н., ассистент кафедры онкологии ГОУ ВПО «Ростовский государственный медицинский университет» Минздрава России, г. Ростов-на-Дону;
Горошинская И.А., д.б.н., лаборатория изучения патогенеза злокачественных опухолей ФГБУ «Ростовский научно-исследовательский онкологический институт» Минздрава России, г. Ростов-на-Дону.
Библиографическая ссылка
Филатова Е.В., Шихлярова А.И., Шевченко А.Н., Куркина Т.А., Селезнев С.Г., Хомутенко И.А., Бабиева С.М., Швырев Д.А., Тараканов М.В. К РЕШЕНИЮ ЗАДАЧ ТРАНСЛЯЦИОННОЙ МЕДИЦИНЫ В ЭКСПЕРИМЕНТАЛЬНОЙ ПРОТИВООПУХОЛЕВОЙ ТЕРАПИИ С ПРИМЕНЕНИЕМ МАГНИТНОГО ПОЛЯ // Современные проблемы науки и образования. 2015. № 3. ;URL: https://science-education.ru/ru/article/view?id=20277 (дата обращения: 31.01.2026).



