Среди пациентов с хронической болезнью почек (ХБП), получающих заместительную терапию почечную (ЗПТ) хроническим гемодиализом (ГД), сердечно-сосудистые заболевания являются ведущей причиной заболеваемости и смертности [1]. Для оценки морфо-функционального состояния сердца [2] одним из наиболее доступных, недорогих, неинвазивных и широко распространенных методов исследования является эхокардиография. Безусловно, у пациентов, получающих ЗПТ хроническим ГД, ультразвуковая «картина» имеет особые нюансы, что требует постоянного пополнения данных о структурно-функциональных особенностях миокарда у данной категории пациентов.
Адаптационное ремоделирование у пациентов с ХБП 5 диализной стадии (ХБП 5D) происходит в ответ на повторяющуюся перегрузку объемом и давлением [3]. Гиперволемия, анемия, наличие артериовенозной фистулы – те факторы, которые способствуют развитию перегрузки объемом у диализных пациентов и являются риском формирования эксцентрической гипертрофии, для которой характерно увеличение массы миокарда при нормальных или незначительно утолщенных стенках миокарда левого желудочка (ЛЖ) [4]. Повышение артериального давления, чрезмерная симпатическая активация являются причинами увеличения постнагрузки, что способствует возникновению концентрической гипертрофии, характеризующейся увеличением массы миокарда ЛЖ и утолщением стенок ЛЖ.
Определенное значение в гемодинамической перестройке миокарда принадлежит нарушениям минерального обмена, и исследованию морфогенетических белков принадлежит важный раздел научного поиска. В нашем исследовании оценивалась роль фактора роста фибробластов FGF-23 и alpha-Klotho. FGF-23 – молекула семейства FGF, гормон, который вырабатывается остеоцитами и остеобластами, изначально расценивался как фактор наследственного гипофосфатемического рахита. Позже было выявлено, что FGF23 выполняет важную роль в минеральном обмене, взаимодействии с фосфатами, паратиреоидным гормоном и витамином D [5]. Его концентрация увеличивается с ранних стадий ХБП. Белок клото существует в двух видах: секретируемая и мембранная форма. Секретируемый белок alpha-Klotho функционирует в качестве корецептора для FGF-23. Растворимый Кlotho - это многофункциональный белок, присутствующий в биологических жидкостях, включая кровь, мочу, спинномозговую жидкость, Клинические и фундаментальные исследования показали, что белок alpha-Klotho выполняет защитную роль в процессе сосудистой кальцификации и развитии оксидативного стресса.
В различных исследованиях изучалась связь сывороточного FGF-23 и изменений миокарда ЛЖ [6], однако ассоциация данного морфогенетического белка и его кофактора с типом перестройки миокарда исследована мало. Поэтому целью нашего исследования является установление особенности адаптационного ремоделирования миокарда ЛЖ у пациентов с ХБП 5D стадии и выявление ассоциации с исследуемыми морфогенетическими белками.
Материалы и методы
В исследовании приняли участие 78 пациентов из двух гемодиализных центров, среди них 42 мужчины и 36 женщин, средний возраст обследуемых пациентов 54,0±14,1 года. Пациенты были включены независимо от пола, возраста, наличия или отсутствия сахарного диабета. Ведущими причинами хронической почечной недостаточности (ХПН) стали хронический гломерулонефрит в 29,5% случаев (23 человек), диабетическая нефропатия – 17,9% (14 пациентов), артериальная гипертензия – 12,8% (10 обследуемых) и тубулоинтерстициальные нефриты 15,4% (12), аутосомно-доминантная поликистозная болезнь почек выявлялась в 10,3% (8 пациентов). Критериями исключения являлась сопутствующая сердечно-сосудистая патология (ишемическая болезнь сердца, пороки сердца, миокардиты, кардиомиопатия, перикардиты, сердечная недостаточность и др.). Не было выявлено изменения концентрации FGF-23 или alpha-Klotho в зависимости от применения ингибиторов ангиотензинпревращающего фермента, блокаторов рецепторов ангиотензина II, бета-блокатор, блокатор кальциевых каналов. Скорость клубочковой фильтрации при пересчете на креатинин, полученный в утренние часы натощак до процедуры ГД, составил 6,7±3,7 мл/мин по формуле CKD-EPI (Chronic Kidney Desease Epidemiology Collaboration).
Эхокардиографическое обследование проведено на аппарате «PHILIPS HD 11» в В и М-режиме, а также в доплеровском режиме исследования и включало следующие измерения: конечный диастолический размер (КДР) (мм), конечный систолический размер (КСР) левого желудочка (ЛЖ) (мм), толщина межжелудочковой перегородки (МЖП) в диастолу (мм), ЛЖ-толщина задней стенки (мм), диаметр левого предсердия (мм), диаметр корня аорты и ее восходящего отдела (мм, фракция выброса (ФВ) (%), фракция укорочения (ФУ) (%)). Использовалась классификация типов ремоделирования миокарда ЛЖ Ganau (1992 г.) в модификации по оценке массы миокарда ЛЖ и толщины МЖП и задней стенки: концентрическая гипертрофия ЛЖ, эксцентрическая гипертрофия ЛЖ, концентрическое ремоделирование ЛЖ и нормальная геометрия ЛЖ.
Измерение концентрации FGF-23 и alpha-Klotho проводили методом иммуноферментного анализа, забор проводили утром натощак до начала процедуры гемодиализа в пробирки с ЭДТА, после чего материал немедленно центрифугировался и замораживался при температуре -20 °С до получения необходимого количества исследуемых образцов, с последующим измерением результатов.
С помощью компьютерной программы STATISTICA 6.0 (StatSoft Inc., США) выполнялся статистический анализ. Данные представлены в виде средних±стандартное отклонение числа и процента исследуемых. Сравнение групп по качественным признакам проводилось с помощью критерия Пирсона и теста максимального правдоподобия χ2 (ML χ2); метод анализа ANOVA использовался для сравнения исследуемых групп по количественным признакам.
Результаты и их обсуждение
Среди обследуемых 78 пациентов, получающих почечно-заместительную терапию хроническим гемодиализом длительностью 18,3±2,1 недели, самым частым типом геометрической адаптации является концентрическая гипертрофия (47,4%). Концентрическое ремоделирование встречалось у 21,8%, эксцентрический тип гипертрофии – у 6,4% и нормальная геометрия миокарда ЛЖ - у 24,4% пациентов (рис. 1).
Структурно-функциональные показатели левого желудочка в зависимости от типа ремоделирования характеризовались следующими особенностями. Так, у пациентов с нормальной геометрией ЛЖ КДР составил 46,2±2,1 мм, что значительно отличалось от величины данного размера у пациентов с концентрической и эксцентрической гипертрофией, 51,9±4,7 мм, р=0,0001 и 51,2±4,4 мм, р=0,008 соответственно. Подобные изменения выявлены и при измерении КСР: у пациентов без структурно-функционального миокарда - 29±1,4 мм, при эксцентрической гипертрофии - 34±5,0 мм, р<0,0001, концентрической – 33,8±3,8 мм, р<0,002 мм.
Относительная толщина стенок ЛЖ у пациентов без перестройки миокарда составила 0,4±0,09, тогда как данный параметр был выше у пациентов с концентрической гипертрофией (0,5±0,04, р<0,0001), тогда как при эксцентрической гипертрофии выявлена только тенденция к уменьшению данного параметра, достоверные различия не получены.
ФВ у пациентов с эксцентрическим (61,6±6,1%, р=0,02) и концентрическим (65,8±2,4%, р=0,004) типом гипертрофии по сравнению с пациентами с нормальным типом геометрии миокарда ЛЖ имели тенденцию к снижению. Аналогичная ситуация складывалась с ФУ, которая достоверно снижалась у пациентов с эксцентрической 33,2±3,9%, р=0,02 и концентрической 34,0±2,7%, р=0,003 гипертрофией в сравнении с пациентами с нормальной геометрией миокарда 36,1±2,0%. Показатели УО соответствовали 66,7±7,5 мл среди лиц с нормальной геометрией миокарда в отличие от пациентов 82,2±16,5 мл с концентрической гипертрофией миокарда левого желудочка, р<0,0001 (табл. 1).
В нашем исследовании, подобно исследованиям было установлено, что только при концентрической гипертрофии изменяются концентрации alpha-Klotho (р<0,028) и FGF23 (р<0,029) по сравнению с группой пациентов с нормальной геометрией миокарда 498,4 и 399,5 пг/мл, 63,9 и 79,7 пг/мл соответственно. Далее был подсчитан коэффициент FGF23/α-Klotho, результаты которого у пациентов без нарушения геометрии миокарда (0,3±0,26) выше, чем среди пациентов с концентрическим ремоделированием (0,17±0,08, р<0,02) и концентрической гипертрофией миокарда ЛЖ (0,18±0,09, р<0,002).
Также у пациентов с концентрической гипертрофией миокарда ЛЖ в сравнении с пациентами без структурно-функциональной перестройки миокарда отмечалась тенденция к увеличению размеров аорты на уровне синусов Вальсальвы (36,7±2,2 мм и 33,8±1,9 мм, р=0,0001 соответственно) и восходящего отдела аорты (37,3±2,3 мм и 34,6±1,9 мм, р=0,0004 соотвественно). А стенка аорты уплотнена у 85% обследуемых, среди них абсолютно все пациенты с концентрической гипертрофией миокарда и 76,5% пациентов с концентрическим ремоделированием (ML χ2 11,98, р=0,007).
Выводы
Таким образом, ремоделирование миокарда определялось в 75,6% случаев среди исследуемых пациентов с ХБП 5D стадии. А концентрическая перестройка миокарда ЛЖ встречалась среди 69,2%, в том числе концентрическое ремоделирование и концентрическая гипертрофия. Такие морфогенетические белки, как FGF23 и alpha-Klotho, являются факторами именно концентрической перестройки миокарда ЛЖ. Эксцентрическая гипертрофия встречалась в незначительном проценте случаев, но, как и концентрическое изменение геометрии миокарда, характеризует нарушения функционального состояния миокарда у пациентов с хронической почечной недостаточностью, получающих почечно-заместительную терапию хроническим гемодиализом.
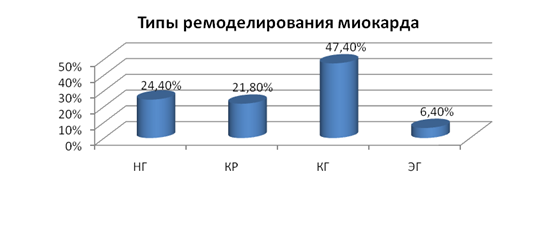
Рис. 1. Типы ремоделирования миокарда
Таблица 1
Сравнение эхокардиографических параметров в зависимости от типов ремоделирования
|
|
1 |
2 |
Р |
3 |
р |
4 |
р |
|
КДР |
46,2±2,1 |
47,2±2,2 |
0.4 |
51,9±4,7 |
0,0001 |
51,2±4,4 |
0,008 |
|
КСР |
29±1,4 |
29,5±1,6 |
0,7 |
33,8±3,8 |
<0,002 |
34±5,0 |
<0,0001 |
|
ФВ |
66,8±2,4 |
64,6±2,4 |
0,3 |
65,8±2,4 |
0,004 |
61,6±6,1 |
0,02 |
|
ФУ |
36,1±2,0 |
34,9±1,6 |
0,16 |
34,0±2,7 |
0,003 |
33,2±3,9 |
0,02 |
|
УО |
66,7±7,5 |
62,6±8,4 |
0,36 |
82,2±16,5 |
<0,0001 |
78,8±7,8 |
0,06 |
|
Ао |
33,8±1,9 |
35,2±3,5 |
0,09 |
36,7±2,2 |
0,0001 |
35,8±1,1 |
0,1 |
|
ВАо |
34,6±1,9 |
35,2±3,5 |
0,5 |
37,3±2,3 |
0,0004 |
35,8±1,5 |
0,36 |
Примечание: КДР - конечный диастолический размер, КСР - конечный систолический размер, ФВ – фракция выброса, ФУ – фракция укорочения, Ао - диаметр корня аорты, ВАо – диаметр восходящего отдела аорты.
Рецензенты:
Терентьев В.П., д.м.н., профессор, проф. кафедры внутренних болезней с основами общей физиотерапии № 2, ГБОУ ВПО «РостГМУ» Минздрава России, г. Ростов-на-Дону;
Воробьев С.В., д.м.н., профессор, проф. кафедры эндокринологии с курсом детской эндокринологии, ГБОУ ВПО «РостГМУ» Минздрава России, г. Ростов-на-Дону.
Библиографическая ссылка
Руденко Л.И., Батюшин М.М., Кастанаян А.А., Воробьев Б.И. ОСОБЕННОСТИ ТИПОВ РЕМОДЕЛИРОВАНИЯ МИОКАРДА ЛЕВОГО ЖЕЛУДОЧКА И ИХ ВЗАИМОСВЯЗЬ С МОРФОГЕНЕТИЧЕСКИМИ БЕЛКАМИ У ПАЦИЕНТОВ С ХРОНИЧЕСКОЙ ПОЧЕЧНОЙ НЕДОСТАТОЧНОСТЬЮ НА ГЕМОДИАЛИЗЕ // Современные проблемы науки и образования. 2015. № 3. ;URL: https://science-education.ru/ru/article/view?id=19715 (дата обращения: 15.02.2026).



