Рак яичников (РЯ) относится к группе социально значимых локализаций злокачественных новообразований и занимает седьмое место в структуре распределения злокачественных опухолей у женщин в Российской Федерации. В 2012 году в России впервые выявлено 12935 человек и умерло 7789 от данного заболевания [2].
До 80% пациенток выявляется в III и IV стадиях заболевания, когда имеются множественные имплантационные метастазы по париетальной и висцеральной брюшине с накоплением асцитической жидкости, канцероматоз плевры с наличием плеврита, поражение забрюшинных, паховых и медиастинальных лимфатических узлов, метастазы в паренхиматозных органах. Это ведёт к тому, что каждая четвёртая пациентка с РЯ умирает, не прожив и года после установления диагноза. Практически все больные с распространёнными формами заболевания после специального лечения и достижения ремиссии в конце концов выходят на рецидив заболевания и погибают. В данной ситуации для практикующего врача важен период времени, свободный от прогрессирования опухолевого процесса, и каждый продлённый месяц жизни пациентки.
После серьёзного прорыва в лечении больных РЯ, связанного с появлением в начале 80-х годов препаратов платины, а затем таксанов, существенных изменений до настоящего времени не произошло.
В последние годы предпринимаются попытки индивидуализации лечения больных РЯ на основании изучения молекулярно-биологических и генетических характеристик опухоли. Большое внимание в настоящее время уделяется разработке новых химио- и биотерапевтических препаратов направленного действия, позволяющих селективно воздействовать только на белки, участвующие в канцерогенезе и определяющие способность опухоли к прогрессии и метастазированию.
Одним из таких биотерапевтических препаратов является Промисан, содержащий два активных соединения - это пищевой индол-3-карбинол (I3C) и флавоноид эпигаллокатехин-3-галлат (EGCG). Он способен блокировать молекулярные механизмы, приводящие к патологической пролиферации, опухолевому неоангиогенезу, снижает инвазивный и метастатической потенциал трансформированных клеток и активирует их апоптоз. Кроме того, препарат способен усиливать действие химиотерапевтических препаратов и восстанавливать чувствительность резистентных опухолей к лекарственным средствам [1].
Препарат Промисан – это таргетный продукт, обладающий хорошей переносимостью и высоким уровнем безопасности при длительном применении. Токсические эффекты, характерные для химиотерапевтических препаратов, у него отсутствуют [3-5].
В настоящем исследовании проведена оценка эффективности комплексного лечения двух групп больных распространёнными формами рака яичников: с включением в схему терапии препарата Промисан и без него.
Цель исследования
Улучшение клинических показателей течения заболевания у больных распростра-нённым раком яичников путём включения в схему комплексного лечения препарата Промисан.
Материалы и методы
Исследование проведено на базе гинекологического отделения Челябинского областного клинического онкологического диспансера за период с 2008 по 2011 год. Выполнялось рандомизированное исследование, в котором пациентки распределялись по группам лечения случайным образом (методом конвертов) и имели одинаковую возможность получить препарат Промисан.
В исследовании участвовали 64 пациентки с распространёнными формами РЯ (III-IV стадии). Основную группу составили 30 больных, которым проведено комплексное лечение по следующему плану. На первом этапе проводилось от 2 до 6 циклов неоадъювантной полихимиотерапии (НАПХТ) с интервалом в 3 недели по схеме СР (цисплатин 100 мг/м2 + циклофосфан 750 мг/м2). На втором - выполнялось хирургическое вмешательство. На третьем этапе проводилась адъювантная полихимиотерапия (АПХТ) от 2 до 6 циклов по той же схеме. На всём протяжении лечения больные принимали препарат Промисан по 2 капсулы 2 раза в день. Контрольную группу составили 34 пациентки, которым проведено комплексное лечение по тому же плану, но без препарата Промисан. Окончательный эффект оценивался после 8 циклов ПХТ и хирургического лечения.
Для уточнения распространенности опухолевого процесса и оценки общего состояния больных до проведения планируемого лечения были выполнены: общие и биохимические анализы крови и мочи, ЭКГ, рентгенологические и ультразвуковые методы исследования, компьютерная томография, морфологическая верификация диагноза (пункция опухоли под УЗИ-контролем, цитологическое исследование пунктата заднего свода, плевральной и асцитической жидкости), исследование опухолевого маркёра СА-125. Во время проведения исследования для мониторинга общего состояния пациенток и динамики опухолевого процесса были использованы все вышеописанные методы диагностики.
Оценка непосредственных результатов лечения основывалась на изучении общего самочувствия больных в каждой группе, переносимости проводимого лечения, уменьшения размеров первичного очага и метастазов, исчезновения плеврита и асцита, снижении показателей опухолевого маркёра СА-125. После проведения хирургического этапа уточнялась распространённость опухолевого процесса и эффективность НАПХТ. При этом оценивался объём остаточной опухоли и лекарственный патоморфоз новообразования.
Отдалённые результаты лечения по группам установлены на основании длительности периода, свободного от прогрессирования опухолевого процесса, и трехлетней выживаемости.
Возраст больных варьировал от 49 до 61 года. Средний возраст пациенток в основной группе составлял 51,4±2,6 года, в группе контроля - 50,8±1,9 года. Сравниваемые группы больных по возрастному критерию репрезентативны.
В исследование были включены пациентки, которым по распространённости опухолевого процесса, по нашему мнению, начинать лечение было целесообразно с НАПХТ, а не с операции. Это больные с большими, ограниченно смещаемыми или несмещаемыми опухолевыми конгломератами, наличием асцита и/или плеврита. Распределение по стадиям согласно классификации TNM в основной группе было следующим: Т3NХМ0 - 28 (93,3%), Т3NХМ1 - 2 (6,7%). В контрольной: Т3NХМ0 - 30 (88,3%), Т3NХМ1 - 4 (11,7%) человек. Различия статистически незначимые (р>0,05). В обеих группах преобладали пациентки с III стадией заболевания. Значение М1 обусловлено положительными цитологическими находками, полученными при пункции плевральной полости при экссудативном плеврите либо обнаруженными при УЗИ, КТ/МРТ паренхиматозных метастазов в печени. Общее состояние больных в группах, несмотря на распространённый опухолевый процесс, было оценено по шкале ECOG-BОЗ в 1-2 балла.
По гистологической структуре опухоли распределение больных в основной группе было следующим: серозная цистаденокарцинома - 24 (80,0%), муцинозная цистаденокарцинома - 4 (13,3%), железисто-солидный рак - 2 (6,6%) случая. В контрольной группе: серозная цистаденокарцинома - 28 (82,3%), муцинозная цистаденокарцинома - 4 (11,7%), железисто-солидный рак - 2 (5,8%) наблюдения. В обеих группах преобладали больные с серозной цистаденокарциномой. В целом по группам различия оказались статистически незначимые (р>0,05).
Анализ по степеням дифференцировки опухоли показал следующее. В основной группе преобладали больные с умеренно дифференцированными вариантами опухоли 14 (46,6%), низкую степень дифференцировки имели 12 (40,0%) человек и высоко дифференцированный вариант оказался у 4 (13,4%) пациенток. В контрольной группе больных с низкой и умеренной степенью дифференцировки оказалось одинаковое количество - по 14 (41,2%) человек. У 6 (17,6%) пациенток опухоль имела высокую дифференцировку. Распределение больных по степеням дифференцировки опухоли показало статистически незначимые различия.
Таким образом, по основным параметрам, характеризовавшим больных и опухолевый процесс, сравниваемые группы были сопоставимы.
Результаты и обсуждение
В результате проведенного лечения, после 8 циклов ПХТ и хирургического вмешательства, у 22 (73,3%) больных основной и у 18 (52,9%) контрольной группы данных о наличии опухоли не было. Это свидетельствует об отчетливой тенденции к лучшему регрессу опухоли у пациенток с включением в схему лечения препарата Промисан. К завершению 3 года без признаков опухолевого процесса в каждой группе оставалось по 2 человека.
Оценка ответа опухоли на лечение выполнялась в соответствии с международными критериями: «Response Evaluation Criteriain Solid Tumors» (RECIST). Критерии RECIST включают в себя следующие понятия.
1. Измеримые очаги – опухолевый очаг размером более 10 мм, выявляемый при КТ или МРТ с шагом 5 мм или менее. Опухолевый очаг размером более 20 мм, измеренный с помощью КТ или МРТ с шагом 10 мм или менее. Опухолевый очаг более 20 мм, выявляемый при рентгенографии легких.
2. Неизмеримые очаги – очаги, не входящие в п. 1, а также следующие очаги: метастазы в кости, лептоменингеальное поражение, асцит, плеврит, перикардит, лимфангоит, поражение полых органов.
Оценка эффекта по RECIST для измеримых очагов.
1. Полный ответ – исчезновение всех измеримых очагов.
2. Частичный ответ – уменьшение суммарных максимальных размеров всех измеримых очагов на 30% и более.
3. Прогрессирование – увеличение суммарных минимальных размеров всех измеримых очагов на 20% и более или появление новых очагов.
4. Стабилизация – увеличение очагов менее, чем при прогрессировании, или уменьшение менее, чем при частичном ответе.
Критерии ответа на лечение для неизмеримых очагов.
1. Полный ответ – исчезновение всех неизмеримых очагов с нормализацией опухолевых маркеров.
2. Частичный ответ/стабилизация – сохранение хотя бы одного неизмеримого очага и/или повышение опухолевых маркеров.
3. Прогрессирование – явное прогрессирование неизмеримых очагов или появление новых очагов.
Общий ответ на лечение оценивался исходя из комбинации оценок измеримых и неизмеримых очагов, результаты представлены на рисунке 1.
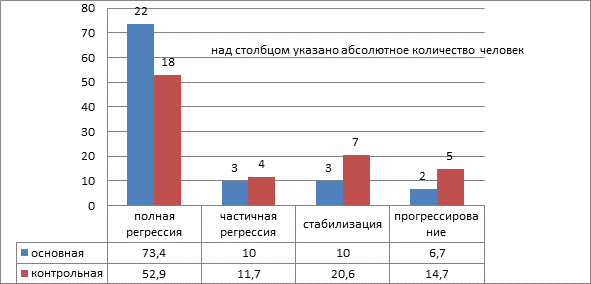
Рис. 1. Общий ответ на лечение больных с распространёнными формами рака яичников
Из представленных данных видно, что в основной группе пациенток есть тенденция к улучшению результатов лечения. У этих больных полная регрессия опухоли наблюдалась на 20,5% наблюдений чаще, чем в контрольной группе. Частичная регрессия и стабилизация опухолевого процесса, наоборот, в контрольной группе была выше на 12,3% случаев. Это объясняется тем, что, во-первых, в основной группе было больше пациенток с полной регрессией опухоли. Во-вторых, в основной группе частота прогрессирования опухолевого процесса на фоне специального лечения была на 8% ниже, чем в контрольной.
Таким образом, у больных, получавших в процессе специального лечения препарат Промисан, чаще наблюдали полную регрессию опухоли и реже прогрессирование опухолевого процесса.
У пациенток с распространёнными формами РЯ в большинстве случаев не удаётся удалить весь объём опухоли и процесс приобретает персистирующее течение. У таких больных трудно достигнуть полного излечения, но можно видеть ремиссию той или иной длительности. В такой ситуации говорить о рецидиве заболевания довольно сложно, т.к. термин «рецидив заболевания» переводится с латинского языка как возврат болезни, но, по сути, несмотря на светлый промежуток, опухоль в организме сохранялась (персистировала). Возобновление прогрессирования опухолевого процесса в каждом случае, как правило, оценивается по данным УЗИ, КТ, МРТ в сочетании с мониторингом уровня опухолевого маркёра СА-125.
Thigpen J.T. et al. (1994) предложили характеристику больных по четырём вариантам течения РЯ (рецидивирующий, резистентный, персистирующий, рефрактерный) [6].
Рецидивирующий РЯ - эта группа включает пациенток, которые достигли полной регрессии опухоли при проведении химиотерапии первой линии с включением производных платины, у которых прогрессирование наступило не ранее чем через 6 месяцев после прекращения лечения.
Резистентный РЯ - полная регрессия опухоли при проведении химиотерапии первой линии, но прогрессирование наступило ранее чем через 6 месяцев после прекращения лечения.
Персистирующий РЯ - у больных достигнута частичная регрессия при проведении химиотерапии первой линии с включением препаратов платины, но сохраняются проявления болезни.
Рефрактерный РЯ - в группу входят больные, у которых не отмечено эффекта от проведения первой линии химиотерапии с включением препаратов платины, а также пациентки, у которых отмечено прогрессирование заболевания на фоне химиотерапии первой линии.
На рисунке 2 представлено распределение больных распространёнными формами РЯ по вариантам течения заболевания с учетом времени, свободного от прогрессирования и числа пациенток.
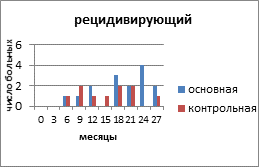
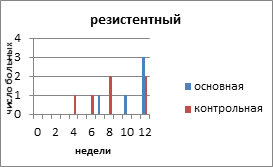
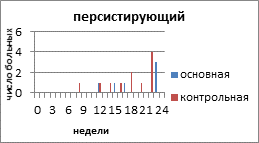
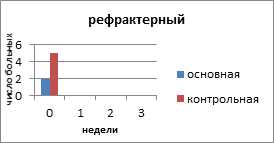
Рис. 2. Распределение больных распространёнными формами рака яичников по вариантам течения заболевания
Клиническими проявлениями прогрессирования заболевания были: местные рецидивы в малом тазу и брюшной полости, метастазы в забрюшинные лимфатические узлы, отдалённые метастазы в печень, легкие. В основной группе у 15 (50%) пациенток зарегистрирован рецидивирующий РЯ, в контрольной - у 10 (29,4%) человек. Рецидив выявлен на основании роста опухолевого маркёра СА-125, а затем был доказан клинически и инструментально. Время, свободное от прогрессирования опухолевого процесса, в контрольной группе с рецидивирующим РЯ составило 19 месяцев, а в контрольной - 15,6 месяца. Статистический анализ показал, что у пациенток с рецидивирующим РЯ, получавших препарат Промисан, видна отчетливая тенденция к увеличению продолжительности безрецидивного периода (Р=0,058).
С резистентным РЯ в основной группе было 5 (16,6%) больных, в контрольной - 6 (17,4%) пациенток. Минимальное время до индикации опухоли в основной группе было 12 недель, максимальное - 23 недели. В контрольной группе соответственно 8 и 22 недели. Время, свободное от прогрессирования, в контрольной группе с резистентным РЯ составило 10,6 недели, а в контрольной - 8,3 недели.
Персистирующий РЯ в основной группе наблюдали у 6 (20%) пациенток, в контрольной - у 11 (32,3%) больных. Время от завершения запланированного лечения с достигнутой стабилизацией опухолевого процесса до начала прогрессирования составило 12 недель в основной и 8 недель в контрольной группе. К концу 3 года умерли все больные с персистирующим РЯ, как в основной, так и в контрольной группе.
Рефрактерный РЯ отмечен у 2 (6,6%) больных основной и 5 (14,7%) пациенток контрольной группы. Все пациентки умерли в течение года от момента установления диагноза и начала специального лечения.
В целом на менее агрессивное течение РЯ (рецидивирующий) в основной группе приходилось 15 (50%) больных, в контрольной – 10 (29,4%) пациенток. На более агрессивное течение (резистентный, персистирующий, рефрактерный) соответственно - 13 (43,3%) и 22 (64,7%) больных. Более благоприятные результаты общего ответа опухоли на лечение больных РЯ и уменьшение агрессивных вариантов течения заболевания в группе с применением препарата Промисан положительно отразилось и на показателях выживаемости и смертности.
Трехлетняя выживаемость пациенток в основной группе составила 63,3±3,7% наблюдений, в контрольной - 47,05±4,2% случаев, при серьёзной тенденции к улучшению показателя в основной группе (р=0,089). Смертность больных в основной группе на первом году жизни составила 3 (10,0%) человека, в контрольной - 5 (14,7%). На втором умерло 8 (26,6%), в основной и 12 (35,3%) пациенток в контрольной группе. На третьем году жизни - 11 (36,6%) в основной и 18 (52,9%) больных в контрольной группе. Различия статистически незначимые (р>0,05), но имеется чёткая тенденция к меньшему числу смертей к третьему году наблюдений в основной группе.
Заключение
Включение в комплексную терапию больных распространёнными формами РЯ препарата Промисан позволило усилить ответ опухоли на проводимое специальное лечение, добиться более благоприятного течения заболевания и тем самым улучшить отдалённые результаты лечения. Резюмируя всё вышесказанное можно констатировать следующее.
1. У больных основной группы отмечены лучшие непосредственные результаты лечения, т.к. полная регрессия опухоли была на 20,5% больше, чем в контрольной группе, а прогрессирование опухолевого процесса на фоне специального лечения на 8% меньше.
2. В основной группе чаще наблюдали менее агрессивное течение РЯ. Так, рецидивирующий РЯ зарегистрирован у 15 (50%) пациенток, в то время как в контрольной - у 10 (29,4%) человек. Кроме того, период, свободный от прогрессирования опухолевого процесса, с рецидивирующим РЯ был длиннее и соответственно составил 19 и 15,6 месяца.
3. Одновременно отмечено и улучшение отдалённых результатов лечения. У пациенток, принимавших препарат Промисан, трёхлетняя выживаемость была 63,3% наблюдений, а у больных, его не принимавших, - 47,05% случаев.
Рецензенты:
Привалов А.В., д.м.н., профессор, заместитель главного врача по инновационным технологиям Челябинского онкологического клинического диспансера, г. Челябинск;
Яйцев С.В., д.м.н., профессор, заведующий кафедрой онкологии ГБОУ ВПО «ЮУГМУ» Минздрава России, г. Челябинск.
Библиографическая ссылка
Жаров А.В., Таратонов А.В., Губайдуллина Т.Н., Жаров А.В., Таратонов А.В., Губайдуллина Т.Н. ОСОБЕННОСТИ ТЕЧЕНИЯ ОПУХОЛЕВОГО ПРОЦЕССА У БОЛЬНЫХ РАСПРОСТРАНЕННЫМИ ФОРМАМИ РАКА ЯИЧНИКОВ В ПРОЦЕССЕ КОМПЛЕКСНОЙ ТЕРАПИИ С ВКЛЮЧЕНИЕМ В СХЕМУ ЛЕЧЕНИЯ ПРЕПАРАТА ПРОМИСАН // Современные проблемы науки и образования. 2015. № 1-1. ;URL: https://science-education.ru/ru/article/view?id=19296 (дата обращения: 16.02.2026).



