Возможности варьирования свойств биополимеров и проектирования на их основе пищевых добавок с детерменированными свойствами позволяют разрабатывать функциональные пищевые продукты для детерминированных групп населения с целью профилактики различных заболеваний [10].
В качестве компонента для коррекции состава и свойств пищевых систем перспективно использование хитозана. Это природный биополимер животного происхождения, получаемый преимущественно из панцирей ракообразных путем деацетилирования хитина. Помимо технологической функциональности обладает свойствами, способными регулировать физиологические функции организма человека [8,9].
На современном этапе хитозан востребован в биотехнологии, медицине, косметологии, сельском хозяйстве и пищевой промышленности [1,3,7].
Спрос на хитозан в мире увеличивается с каждым годом в связи с опережающей производство потребностью в нем. Несмотря на имеющиеся сырьевые ресурсы, Россия пока не входит в число крупных производителей хитозана (рис. 1).
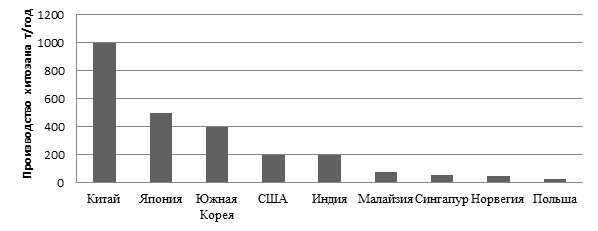
Рис. 1. Данные по объемам производства хитозана в различных странах по состоянию на 2013 год
В небольших количествах производство хитозана налажено в таких странах как Вьетнам, Таиланд, Бразилия, Куба, Аргентина и Пакистан. При текущих темпах потребления потребность в хитозане увеличится до 10000 т в год в течение пяти лет (на сегодняшний день в мире производится примерно 2800–3000 т в год).
Годовое воспроизводство хитозана составляет по приблизительным оценкам около 2,3 млрд. т, что открывает большие перспективы в увеличении объема его промышленного производства [9].
Традиционным видом сырья для получения хитина и хитозана является крупка из панциря камчатского краба, позволяющая получить хитозан с высокой степенью деацетилирования и с большим выходом готового продукта. Другими источниками являются гладиус кальмара, куколка шелкопряда, сепион каракатицы, кутикула тараканов, диатомовые водоросли, биомасса микроорганизмов, пчелиный подмор [4].
Для регионов, удаленных от традиционной сырьевой базы хитозана, перспективно использовать альтернативные источники, включающие панцири раков, креветок, отходы промышленного производства вешенки обыкновенной.
Цель работы: оценка технологической эффективности использования альтернативных видов сырья - панцирей раков пресноводных, креветок, отходов промышленной переработки вешенки обыкновенной для получения пищевого хитозана.
Материалы и методы исследования. Экспериментальные исследования проводили в условиях научно-исследовательской лаборатории кафедры технологии переработки животноводческой продукции ВГАУ, а также аккредитованной испытательной лаборатории Орехово-Зуевского филиала ФГУ «Менделеевский центр стандартизации, метрологии и сертификации».
В работе использовали панцирьсодержащее сырьё (ПСС), получаемое при промышленной переработке раков пресноводных, креветок арктических, а также хитинсодержащие промышленные отходы грибов рода вешенка.
Массовую долю гигроскопической влаги в сырье и готовых продуктах определяли путем высушивания образцов при 100-105 °С в течение 5 ч в соответствии с требованиями ГОСТ 23637 и рекомендациями [2].
Массовую долю белка в сырье и продуктах определяли методом Кьельдаля в соответствии с рекомендациями [2]. Метод определения азота основан на минерализации органических соединений с последующим определением азота по количеству образовавшегося аммиака.
Массовую долю жира в сырье определяли экстракционным методом по обезжиренному остатку в соответствии с рекомендациями [2].
Массовую долю минеральных веществ определяли после сжигания органических веществ в муфельной печи при температуре 500-700 °С в течение 5-6 ч до постоянной массы в соответствии с рекомендациями [2].
Для выделения хитина сухое измельченное сырьё смешивали с водой в соотношении 1:10, после чего в смесь порционно вносили концентрированную соляную кислоту при комнатной температуре. На стадии деминерализации контролировали изменение рН. При увеличении рН до 7 приливали следующую порцию кислоты.
Процесс деминерализации считали завершенным при рН 3-3,5, не изменяющемся в течение 30 мин. Экспериментально установлено, что суммарное количество кислоты, вносимой на стадии деминерализации, соответствует раствору соляной кислоты с массовой долей 4-4,5 %. Промежуток времени, в течение которого происходило порционное внесение кислоты, составил 60-65 мин [8]. Далее деминерализованное ПСС промывали водопроводной водой до рН 6,5-7,0.
Для удаления белковых фракций (депротеинирования) из деминерализованного ПСС использовали раствор гидроксида натрияcмассовой долей 5 % при 100 °С в течение 1,5 ч. Обработанное щелочью хитинсодержащее сырье охлаждали до температуры окружающей среды и промывали дистиллированной водой до рН 7,0 при гидромодуле 1:6. Полученный хитин промывали и сушили на воздухе в течение 24 часов.
Затем проводили деацетилирование хитина. К сухому хитину приливали раствор гидроксида натрия с массовой долей 50 % и нагревали на водяной бане в течение 2 ч. Твердый остаток отделяли от жидкой фракции центрифугированием и промывали дистиллированной водой до рН 7,0. Полученный хитозан промывали водным раствором этанола с объемной долей 20 % и ацетоном до обесцвечивания, повторно промывали дистиллированной водой до нейтральной реакции и сушили на воздухе [8].
Качество полученного хитозана устанавливали по комплексу показателей. Содержание нерастворимых веществ устанавливали по ТУ 15-16-14-93, минеральных веществ – по ГОСТ 7636.
Степень деацетилирования устанавливали методом потенциометрического титрования на универсальном ионометре ЭВ-74 с использованием стеклянного электрода.
Молекулярную массу хитозана определяли вискозиметрически по стандартной методике. Измерения проводили при 250С в капиллярном вискозиметре Уббелоде, диаметр которого равен 0,54 мм. Расчёт молекулярной массы проводили по уравнению Марка-Куна-Хаувинка [6].
Определение остаточного белка в хитозане проводили по методике ГФ XII, ч.1, ОФС 42-0053-07 «Определение белка колориметрическим методом с биуретовым реактивом» [2].
Кинетику набухания хитозана исследовали в соответствии с рекомендациями[8].
Технологические свойства хитозана определяли по стандартным методикам. Ситовой анализ проводили по ОФС 42-0136-09, ГФXII, ч.2, последовательно используя набор сит с диаметром отверстий 7,1;5,6:5,0;4,5;3,5;3,0;2,5;1,0;0,25 мм. Насыпной объем порошков определяли по методике ОФС 42-0137-09 на вибрационном уплотнителе порошков модели 545р-АК-3 ЖЗТО [6].
Результаты исследования и их обсуждение. Процессу выделения хитина и хитозана предшествовал анализ общего химического состава сырья, включающий определение массовой доли белков, жиров, углеводов, влаги и золы (таблица 1).С целью определения общего химического состава грибов рода вешенка и панциря раков пресноводных в сравнении с ПСС креветок готовили средние пробы в количестве 3 % от партии.
Таблица 1
Общий химический состав панциря рака, креветки и грибов рода вешенка
|
Объект исследования |
Массовая доля, % |
||||
|
влаги |
белка |
жира |
углеводов |
золы |
|
|
Рак (ПСС) |
64,54 |
11,43 |
0,45 |
- |
13,97 |
|
Креветка (ПСС) |
73,43 |
8,37 |
2,12 |
- |
8,98 |
|
Грибы вешенка |
89,22 |
1,67 |
0,52 |
6,78 |
0,81 |
Следующим этапом исследования было определение массовой доли хитина в сырье животного и растительного происхождения (таблица 2).Хитин относится к нерастворимым полимерам, поэтому для его выделения из плодового тела грибов, панциря крабов и креветок необходимо последовательное и полное удаление белковой и минеральной частей сырья – депротеинирование (ДП) и деминерализация (ДМ).
Таблица 2
Содержание хитина в ПСС ракообразных и плодовых телах грибов рода вешенка
|
Объект исследования |
Массовая доля хитина, % |
|
Рак (панцирь) |
9,61 |
|
Креветка (панцирь) |
7,18 |
|
Грибы вешенка |
0,52 |
Выделение хитозана из различных сырьевых источников проводили в соответствии с традиционной технологической схемой, включающей стадии измельчения исходного сырья, депротеинирования, деменирализации и деацетилирования полученного хитина [4].
Характеристику физико-химических свойств хитозанов, полученных по общей технологической схеме из различных источников, иллюстрируют данные, представленные в таблице 3.По физико-химическим свойствам полученные продукты деацетилирования хитина идентифицированы как соответствующие требованиям к пищевому хитозану (ТУ9289-067-00472124). Как следует из данных, представленных в таблице 3, хитозан из панциря креветки обладает физико-химическими свойствами, аналогичными со свойствами хитозана других ракообразных, при этом образует в растворе уксусной кислоты с массовой долей 2 % более вязкие растворы, а также при одинаковых условиях получения отличается более высокой степенью деацетилирования.
Таблица 3
Сравнительная характеристика физико-химических свойств хитозанов из различных источников
|
Показатели |
Допустимые значения для хитозана пищевого (ТУ9289-067-00472124) |
Источники хитозана |
||
|
ПСС креветок |
ПСС раков пресноводных |
Биомасса грибов рода вешенка |
||
|
Характеристическая вязкость (в 2 % р-ре уксусной кислоты), дл/г |
Не нормируется |
11,56 |
10,7
|
10,15 |
|
Молекулярная масса, кДа |
Не нормируется |
56,0 |
52,0 |
43,0 |
|
Степень деацетилирования, % |
Не менее 75% |
78±1,0 |
76±1,0 |
75±1,0 |
|
Зольность, % |
Не более 0,7 |
0,4-0,45 |
0,4-0,5 |
0,1 |
|
рН 1%-ного раствора в 2%-ной CH3COOH |
Не более 7,5 |
5,9 |
6,0 |
6,5 |
|
Остаточный белок, % |
Не более 0,1 |
0,05-0,1 |
0,01-0,05 |
0,04 |
|
Массовая доля влаги, % |
Не более 10 |
9-10 |
8-10 |
8-9 |
|
Внешний вид |
Чешуйки размером 1-3 мм |
Чешуйки размером 1-2 мм |
Чешуйки размером 1-2 мм |
Порошок с размером частиц 0,1-0,2 мм |
|
Насыпная масса, г/см3 |
Не нормируется |
0,25-0,40 |
0,15-0,40 |
0,6-0,7 |
С целью определения условий использования полученного хитозана в пищевых системах в качестве гидроколлоида исследовали набухаемость полученных хитозанов в воде (рис. 2).
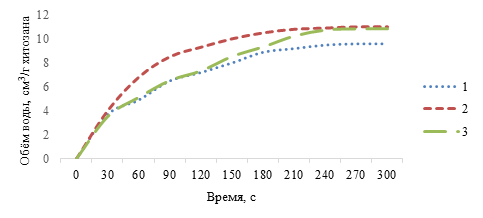
Рис. 2. Динамика набухания хитозана из различных источников: 1 – грибы рода вешенка; 2 – ПСС креветок; 3 – ПСС раков пресноводных
Данные функциональные свойства хитозана из ПСС креветок позволяют рассматривать его как перспективный функционально-корректирующий компонент пищевых продуктов. Внесение хитозана в воду, которая химически не взаимодействует с ним, обеспечивает быстрое набухание полимера, причем каждая частичка хитозана набухает отдельно от других и полученная масса (золь) является однородной (не содержит комочков). Установлено, что хитозан из панциря креветки обладает быстрой набухаемостью: поглощение воды составило 10,9 см3/г в течение 4-5 мин. Факт, что хитозан из ПСС креветок является гидроколлоидом, определяет его потенциальную функциональность при переработке на пищевые цели продукции животноводства в отраслях мясной, рыбной и молочной промышленности. Высокие показатели набухаемости позволяют исключить в технологическом процессе предварительную гидратацию хитозана [3].
Технологическую эффективность использования ПСС раков, креветок, отходов промышленной переработки грибов рода вешенка для получения пищевого хитозана оценивали по следующим показателям: количество стадий при получении хитозана, общая продолжительность процесса получения хитозана и выход готового продукта (таблица 4).
Таблица 4
Оценка технологической эффективности различных видов сырья для получения хитозана
|
Технологические параметры |
Вид используемого сырья |
||
|
Креветки |
Раки |
Грибы |
|
|
Количество стадий при получении хитозана |
3 |
4 |
5 |
|
Общая продолжительность процесса получения хитозана, ч |
5 |
6,5 |
7 |
|
Выход хитозана, % к массе сырья |
5,03 |
4,91 |
0,45 |
Результаты свидетельствуют, что для получения пищевого хитозана наиболее технологично использовать ПСС креветок по сравнению с другими источниками. Это является актуальным для регионов, территориально удаленных от традиционных и новых бассейнов вылова камчатского краба.
Заключение
Установленная идентичность физико-химических свойств хитозана, полученного в аналогичных условиях из ПСС креветки и рака пресноводного, свидетельствует об их схожей химической природе и молекулярной структуре. Хитозан, полученный из грибов рода вешенки, отличается по следующим показателям: характеристическая вязкость (в 2 % р-ре уксусной кислоты), молекулярная масса, степень деацетилирования, в первую очередь, за счет образования с хитином хитин-глюкановых комплексов (ХГК).
Технологические показатели характеризуют хитозан из ПСС креветки как полиморфную систему с доминирующей фракцией частиц 1-2 мм, влажностью не более 10 %, с плохой сыпучестью и очень малой насыпной массой.
Показатели вязкости раствора хитозана в растворе уксусной кислоты с массовой долей 2 % и способность к набуханию в водной среде позволяют рассматривать его как перспективный функциональный компонент пищевых продуктов, в том числе для профилактики алиментарнозависимых заболеваний.
Таким образом, ПСС креветок можно перерабатывать в условиях, совместимых с условиями пищевых, в том числе рыбоперерабатывающих предприятий с получением пищевого хитозана в виде дополнительной товарной продукции.
Рецензенты:
Панов С.Ю., д.т.н., декан факультета экологии и химической технологии, зав. кафедрой «Машины и аппараты химических производств» ФГБОУ ВПО Воронежский государственный университет инженерных технологий, г. Воронеж;
Глазков С.С., д.т.н., доцент, профессор кафедры химии ФГБОУ ВПО Воронежский государственный архитектурно-строительный университет, г. Воронеж.
Библиографическая ссылка
Балабаев В.С., Глотова И.А., Измайлов В.Н. ТЕХНОЛОГИЧНОСТЬ АЛЬТЕРНАТИВНЫХ СЫРЬЕВЫХ ИСТОЧНИКОВ ДЛЯ ПОЛУЧЕНИЯ ПИЩЕВОГО ХИТОЗАНА // Современные проблемы науки и образования. 2015. № 1-1. ;URL: https://science-education.ru/ru/article/view?id=18600 (дата обращения: 13.02.2026).



