Лечение рецидивных и метастатических злокачественных опухолей (ЗНО) остается одной из нерешенных задач в современной онкологии [5]. Особенно это относится к группам опухолей, обладающих умеренной чувствительностью к цитостатикам [2]. К таким опухолям относятся наиболее распространенные виды ЗНО: рак легкого, рак молочной железы, колоректальный рак, рак желудка, саркомы мягких тканей, меланомы и другие ЗНО. При технической невозможности хирургического удаления этих опухолей, как правило, пациенту назначается химиотерапевтическое лечение. Считается, что в этом случае неблагоприятный прогноз для жизни пациента предопределен и цель химиотерапии продлить жизнь пациента, замедлив скорость роста опухолей. По нашему мнению, здесь можно выделить две основные проблемы. Главной по значимости проблемой в лечении ЗНО этого вида является неопределенность ответа опухоли на назначенное химиотерапевтическое лечение. В клинической практике встречаются случаи, как полной регрессии опухоли под воздействием цитостатиков, так и случаи, когда опухоль обладает абсолютной резистентностью к лекарственному лечению. Вторая по значимости проблема, по нашему мнению, это неопределенность сроков дожития пациентов с распространенными ЗНО. Сроки жизни различных пациентов с рецидивными и метастатическими опухолями могут варьировать в широких пределах. В последние годы для разных видов опухолей выделено и исследовано большое количество прогностических и предсказывающих факторов. Однако, по нашему мнению, основной фактор, влияющий на продолжительность жизни всех больных с распространенными ЗНО, – это скорость роста опухолевых очагов.
По своей структуре опухоль состоит из паренхимы и стромы. Строма опухоли формируется и растет из окружающей паренхиму соединительной ткани. Рост паренхимы обусловлен увеличением числа опухолевых клеток в процессе митоза. Одновременно с увеличением числа клеток в паренхиме идет процесс убыли опухолевых клеток вследствие процессов их некроза, апоптоза, миграции опухолевых клеток в кровеносное и лимфатическое русло [4]. Совокупность всех этих процессов определяется, как фактор клеточных потерь (ФКП) [1]. Таким образом, скорость роста опухоли определяется соотношением показателей митотической активности опухоли (МАО) и фактора клеточных потерь [3].
В нашей работе мы определили две основные цели:
- Исследовать факторы, определяющие скорость роста опухоли.
- Исследовать влияние кинетических параметров роста опухоли на эффективность химиотерапевтического лечения.
Для достижения указанных целей были поставлены следующие задачи:
- Исследовать структуру рецидивных и метастатических опухолей.
- Разработать математическую модель опухолевого роста, в которой бы учитывалось влияние структурных параметров на кинетику роста опухоли.
- На основе указанной модели разработать компьютерную программу, позволяющую рассчитывать кинетические параметры роста для конкретных клинических случаев.
- На основе полученных вычислений установить взаимосвязь между структурными и кинетическими факторами роста.
- Сравнить структурные и кинетические параметры двух групп пациентов: получавших и не получавших химиотерапевтическое лечение.
Всего на базе Нижегородского областного онкологического диспансера а период с 2009 по 2012 гг. нами было обследовано 130 пациентов с рецидивными и метастатическими опухолями пяти различных локализаций: сарком мягких тканей (СМТ), колоректального рака (КРР), меланом кожи, рака молочной железы (РМЖ) и плоскоклеточного рака головы и шеи (ПРГШ). Информация о количественном соотношении больных в разных группах приведена в таблице 1. Каждому из исследуемых пациентов удалялись рецидивные или метастатические очаги (при технической невозможности или нецелесообразности их удаления бралась биопсия из нескольких участков очагов (преимущественно из их периферических отделов)).
Таблица 1
Распределение клинических наблюдений по локализациям первичных очагов и типу вторичных поражений
|
Не получавшие химиотерапевтического лечения |
Получавшие химиотерапию |
|
|
Саркомы мягких тканей |
30 |
5 |
|
Колоректальный рак |
21 |
15 |
|
Меланомы |
17 |
2 |
|
Рак молочной железы |
7 |
21 |
|
Плоскоклеточный рак головы и шеи |
12 |
0 |
|
Всего |
87 |
43 |
Проводилось морфометрическое исследование полученных гистологических препаратов. Определялись следующие структурные параметры опухолей: доля клеток паренхимы в состоянии митоза, доля клеток в интерфазе, доля клеток в состоянии пролиферативного покоя. Также определялись те доли объема, которые занимают в опухоли строма и некрозы. Данные морфометрии для всех пяти видов исследуемых опухолей приведены в таблице 2.
Таблица 2
Соотношения структурных компонентов рецидивных и метастатических опухолей
|
Митотическая активность опухоли |
СМТ |
КРР |
Меланомы |
РМЖ |
ПРГШ |
|
3,56%±0,46% |
7,32%±0,93% |
9,42%±1,23% |
5,90%±0,62% |
5,88%±0,88% |
|
|
Доля клеток паренхимы в интерфазе |
8,55%±1,31% |
14,28%±1,50% |
19,49%±2,95% |
11,14%±1,40% |
11,24%±1,32% |
|
Доля клеток паренхимы в состоянии пролиферативного покоя |
20,34%±1,81% |
39,42%±2,23% |
54,68%±4,20% |
36,14%±2,31% |
39,92%±3,55% |
|
Доля стромы в опухоли |
52,63%±2,12% |
20,56%±1,19% |
7,37%±0,58% |
28,32%±1,91% |
35,42%±3,19% |
|
Доля некрозов в опухоли. |
15,00%±2,68% |
18,72%±1,68% |
8,95%±1,24% |
19,93%±1,00% |
7,33%±1,14% |
- Средние показатели МАО, доли клеток в состоянии интерфазы и доли клеток в состоянии пролиферативного покоя для исследованных нами локализаций ЗНО соотносятся друг к другу приблизительно как 1:2:6.
- Значения средних показателей МАО, доли клеток в состоянии интерфазы и доли клеток в состоянии пролиферативного покоя, в нашем исследовании, максимальны для меланом и минимальны для СМТ. Указанные показатели для КРР, РМЖ и ПРГШ занимают промежуточные позиции.
- При исследовании содержания стромы в опухолях указанных локализаций выявлено обратное соотношение. Среднее арифметическое доли стромы максимальны для СМТ и минимальны для меланом.
Нами совместно с сотрудниками кафедры математики Нижегородского университета имени Н.И. Лобачевского разработана математическая модель опухолевого роста. Согласно данной модели опухолевый рост рассматривается, как интегральный показатель баланса между увеличением числа опухолевых клеток в процессе их митотического деления и клеточными потерями. На базе разработанной модели с использованием языка программирования С++ создана компьютерная программа, позволяющая на основании данных морфометрии, а также таких клинических данных, как размер опухолевого очага и давность его роста рассчитать время удвоения опухоли (ВУО) и ФКП для каждого клинического случая. Нами произведена математическая обработка морфометрических данных для всех обследованных 130 пациентов. Результаты расчетов приведены в таблице 3.
Таблица 3
Кинетические параметры роста рецидивных и метастатических опухолей различных локализаций
|
СМТ |
КРР |
Меланомы |
РМЖ |
ПРГШ |
|
|
ФКП |
90,35%±2,40% |
94,38%±2,63% |
89,99%±4,20% |
96,21%±0,92% |
93,64%±1,88% |
|
ВУО (сутки) |
12,88±2,02 |
33,04±5,48 |
18,42±7,38 |
29,37±6,66 |
15,71±4,85 |
Несмотря на низкую митотическую активность, рецидивные и метастатические саркомы мягких тканей обладают наибольшей средней скоростью роста. Причина этого, по нашему мнению, – низкие показатели клеточных потерь (Средний ФКП 90,35%±2,40%). Рак молочной железы и колоректальный рак отличаются наиболее низкими показателями средней скорости роста. Эти два вида опухолей отличает сочетание умеренной митотической активности (7,32%±0,93% и 5,90%±0,62%) и высоких клеточных потерь (94,38%±2,63% и 96,21%±0,92%). Для меланом кожи характерно сочетание высокой митотической активности (9,42%±1,23%) и низких клеточных потерь (89,99%±4,20%).
Мы сопоставили кинетические параметры роста рецидивных и метастатических опухолей пациентов, получавших и не получавших химиотерапевтическое лечение. Данные о влиянии лечения цитостатиками на кинетические параметры опухолевых очагов приведены в таблице 4.
Таблица 4
Кинетические параметры роста опухолей в зависимости от проведенного лечения.
|
ВУО (сут) |
ФКП |
Доля клеток в митозе |
|
|
Не получавшие химиотерапию |
19,41±2,59 |
91,52%±1,70% |
5,85%±0,44% |
|
Получавшие химиотерапию |
30,52±5,46 |
95,92%±0,85% |
6,84%±0,84% |
Лечение цитостатиками в значительной степени замедляет скорость опухолевого роста (среднее ВУО 30,52±5,46 суток), по сравнению с теми случаями, когда химиотерапия не проводилась (среднее ВУО 19,41±2,59 суток). Это обусловлено ростом ФКП у пациентов, получавших химиотерапию (95,92%±0,85%) по сравнению с ФКП у пациентов, не получавших химиотерапевтическое лечение (91,52%±1,70%). Для оценки эффективности лечения цитостатиками в нашем исследовании мы использовали коэффициент эффективности химиотерапии (КЭХТ), который определялся как отношение среднего ВУО у пациентов, получавших химиотерапевтическое лечение, к среднему ВУО пациентов, не получавших химиотерапию. КЭХТ для пяти исследованных нами групп опухолей составил 1,57.
При проведении корреляционного анализа между структурными и кинетическими параметрами выявлена достаточно сильная статистическая взаимосвязь между параметрами ВУО и ФКП. Было выявлено также, что показатель МАО статистически не влияет на скорость роста опухоли. Поэтому среди опухолей с различной скоростью роста встречаются опухоли, как с высокой, так и низкой МАО. Эффективность химиотерапевтического лечения (КЭХТ) будет существенно меняться при различных сочетаниях МАО и ВУО. График распределения КЭХТ в зависимости от ВУО и ФКП изображен на рисунке 1. По оси абсцисс обозначена МАО, по оси ординат – ВУО. Различные степени эффективности химиотерапевтического лечения изображены в виде цветных полей. Темно-зеленым и зеленым цветом обозначены поля, в зоне параметров которых лечение цитостатиками неэффективно. Желтый, красный и коричневый цвета – градации эффективности химиотерапии. На данном графике заметно, что наибольшей эффективности можно добиться при лечении быстрорастущих опухолей с высокой митотической активностью. Химиотерапия не эффективна при лечении опухолей с умеренной скоростью роста и умеренной митотической активностью (на графике участок маркирован темно-зеленым цветом в центре поля. По мере замедления скорости роста опухолей, по нашим данным, вновь отмечена тенденция к росту КЭХТ.
Таким образом, в настоящей работе доказана взаимосвязь между структурными и кинетическими параметрами рецидивных и метастатических опухолей. Параметр, максимально влияющий на время удвоения опухоли, – это фактор клеточных потерь. Определено влияние кинетики роста опухолей на эффективность лечения цитостатиками.
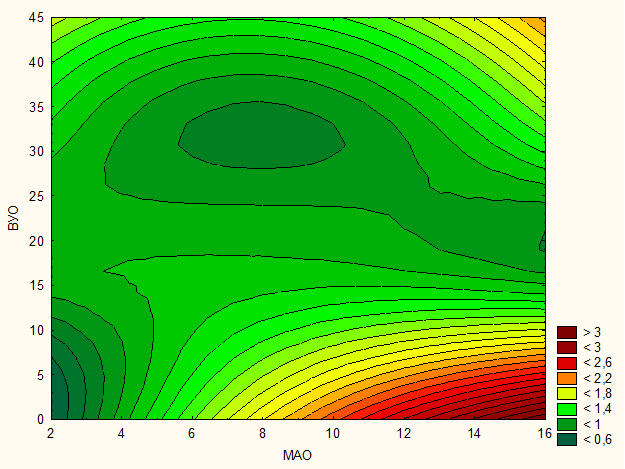
Рис. 1.Чувствительность к химиотерапии опухолей с различной скоростью роста и разной митотической активностью.
Рецензенты:
Базаев А.В., д.м.н., профессор, заведующий кафедрой Общей хирургии, Нижегородская государственная медицинская академия, г. Нижний Новгород;
Меньков А.В., д.м.н., профессор кафедры Общей хирургии, Нижегородская государственная медицинская академия, г. Нижний Новгород.
Библиографическая ссылка
Терентьев И.Г., Кунецов С.С., Базанов К.В. ИССЛЕДОВАНИЕ ИЗМЕНЕНИЯ КИНЕТИКИ РОСТА РЕЦИДИВНЫХ И МЕТАСТАТИЧЕСКИХ ОПУХОЛЕЙ ПОД ВЛИЯНИЕМ ХИМИОТЕРАПЕВТИЧЕСКОГО ЛЕЧЕНИЯ // Современные проблемы науки и образования. 2015. № 1-1. ;URL: https://science-education.ru/ru/article/view?id=18564 (дата обращения: 02.01.2026).



