К группе дубильных веществ (ДВ) относятся вещества растительного происхождения, которые представляют собой сложные органические соединения, являющиеся производными многоатомных фенолов с разнообразной химической структурой, начиная от простейших производных полифенолов и заканчивая более сложными высокомолекулярными производными, так называемыми флобафенами и флобатанинами. ДВ обладают вяжущим, противовоспалительным и кровоостанавливающим действием, поэтому поиск новых растительных источников ДВ, а также разработка и модификация методик их количественного определения в лекарственном растительном сырье (ЛРС) весьма актуальны [5,8].
В литературе имеется много сведений об определении ДВ в ЛРС методом перманганатометрии [4,5,7,10]. Метод Левенталя показал сравнительно хорошую воспроизводимость. Однако он характеризуется некоторой завышенностью результатов, что обусловлено субъективностью определения конца титрования по появлению золотисто-желтой окраски; сильной зависимостью результатов от интенсивности перемешивания титруемого раствора и освещения; зависимостью расхода перманганата калия от скорости титрования; неприемлемостью применения единого пересчетного коэффициента для растительного сырья, содержащего танино-катехиновую смесь [9]. Физико-химические методы сейчас чаще всего включают в современную нормативную документацию (НД) на ЛРС. Метод спектрофотометрии основан на образовании окрашенных комплексов ДВ с железо-тартратным реактивом [1,5]. Метод потенциометрического титрования позволяет не только оценить количественное содержание суммы дубильных веществ в ЛРС, но и дифференцировать конденсированные и гидролизуемые группы танинов [7]. Применение спектрофотометрического и потенциометрического методов выявило наибольшую сходимость результатов определения ДВ, причем с наименьшей погрешностью. Среди хроматографических методов высокоэффективная жидкостная хроматография (ВЭЖХ) позволяет установить качественный и количественный состав отдельных компонентов [5]. Метод перманганатометрического титрования, включенный в Государственную Фармакопею (ГФ) X и XI изданий – метод Левенталя, измененный А.Л. Курсановым, основан на способности ДВ быстро окисляться в сильно разбавленном кислом растворе в присутствии индикатора индигосульфокислоты [3]. Однако, согласно данным литературы, наряду с ДВ происходит окисление и других групп биологически активных веществ (БАВ) – флавоноидов, витаминов, органических кислот, сахаров и др., что сильно завышает результаты определения. Метод Левенталя многие исследователи считают приблизительным, его можно использовать для полуколичественного определения, а также для предварительного знакомства с ЛРС. Кроме того, существующая НД на ЛРС скумпии кожевенной заметно устарела [2]. Таким образом, необходимо учитывать возможности физико-хиических методов анализа при разработке дополнений и изменений существующих НД на ЛРС, содержащее ДВ.
Цель настоящей работы – разработка методики количественного определения дубильных веществ методом спектрофотометрии в листьях скумпии кожевенной, а также сравнительный анализ перманганатометрического определения по сравнению со спектрофотометрическим.
Материал и методы
Объектом исследования служили высушенные образцы сырья листьев скумпии кожевенной, заготовленные в 2014 году в фазу цветения растения на юго-восточном склоне горы Машук в городе Пятигорске Ставропольского края. Масса аналитической пробы для анализа была отобрана в соответствии с ОФС 42-0013-03 «Правила приемки лекарственного растительного сырья и методы отбора проб». Для извлечения суммы ДВ из ЛРС, согласно данным литературы, в качестве экстрагента чаще всего используют воду. Экспериментально установлены оптимальное соотношение ЛРС и экстрагента для извлечения ДВ – 2:250, а также наилучшее время экстракции, за которое будет извлекаться максимальное количество БАВ данной группы, – 30 мин (табл.1).
Таблица 1
Влияние соотношения «сырье-экстрагент» и времени экстракции на извлечение ДВ из листьев скумпии кожевенной
|
Соотношение «сырье –экстрагент», г/мл |
Время экстракции, мин |
Содержание ДВ*, % |
|
2:200 |
20 |
23,23/25,47 |
|
2:250 |
25 |
29,41/27,70 |
|
2:300 |
30 |
21,47/29,16 |
|
2:400 |
35 |
16,47/28,01 |
|
2:500 |
40 |
14,62/26,74 |
*Примечание – через знак «/» приведены значения содержания дубильных веществ в зависимости от соотношения «сырье-экстрагент» и времени экстракции.
В стандартной методике ГФ XI указано, что извлечение фильтруют после охлаждения. Однако, согласно правилам изготовления извлечений из ЛРС, содержащего ДВ, фильтрование проводят в горячем виде. ДВ хорошо растворимы в горячей воде и плохо в холодной, что может привести к выпадению их в осадок при охлаждении извлечения. Поэтому было проведено сравнение содержания ДВ в извлечении при фильтровании в горячем виде и после полного охлаждения (табл. 2). Данные показывают, что фильтрование извлечения необходимо проводить в горячем виде.
Таблица 2
Содержание ДВ в зависимости от способа фильтрования*
|
Условия фильтрования |
Содержание ДВ, % |
|
Горячее извлечение |
27,58 |
|
Охлажденное извлечение |
23,02 |
*Примечание: в таблице представлено среднее значение 3-х определений.
Получение извлечения. Точную навеску сырья (около 2 г), измельченного и просеянного сквозь сито с диаметром отверстий 3 мм, помещали в коническую колбу вместимостью 500 мл, заливали 250 мл кипящей воды очищенной и кипятили с обратным холодильником на электрической плите с закрытой спиралью в течение 30 минут при периодическом перемешивании. Полученное извлечение процеживали через вату, не дожидаясь охлаждения, так, чтобы частицы сырья не попали в мерную колбу вместимостью 250 мл. Объем раствора в колбе доводили до метки водой очищенной (раствор А).
Определение методом перманганатометрии. Аликвоту (раствор А) в количестве 25 мл переносили в коническую колбу вместимостью 750 мл, прибавляли 500 мл воды очищенной, 25 мл раствора индигосульфокислоты и титровали при постоянном перемешивании 0,02М раствором калия перманганата до золотисто-желтого окрашивания.
Параллельно проводили контрольный опыт.
Содержание дубильных веществ (Х,%) в пересчете на абсолютно сухое сырье вычисляли по формуле:
Х% = ![]() ;
;
где ![]() – объемы титрованного раствора калия перманганата 0,02М, израсходованные на титрование в основном и контрольном опытах соответственно, мл;
– объемы титрованного раствора калия перманганата 0,02М, израсходованные на титрование в основном и контрольном опытах соответственно, мл;
![]() – поправочный коэффициент титрованного раствора;
– поправочный коэффициент титрованного раствора;
![]() – титр 0,02М раствора калия перманганата по танину, г/мл;
– титр 0,02М раствора калия перманганата по танину, г/мл;
![]() – общий объем извлечения, полученный из взятой на анализ массы сырья, мл;
– общий объем извлечения, полученный из взятой на анализ массы сырья, мл;
![]() – масса навески сырья, взятая на анализ, г;
– масса навески сырья, взятая на анализ, г;
![]() – аликвота извлечения, взятая для титрования, мл;
– аликвота извлечения, взятая для титрования, мл;
B – влажность сырья, %.
Согласно современным представлениям, истинное содержание ДВ можно определить методом спектрофотометрии, в основе которого лежит измерение оптической плотности водного извлечения из ЛРС, после взаимодействия с 2 % водным раствором аммония молибдата при длине волны 420±2 нм. Аналогичный максимум отмечен для раствора стандартного образца (СО) танина в воде (рис. 1). Это дало возможность использовать длину волны 420±2 нм в качестве аналитической для разработки методики количественного определения ДВ в сырье методом спектрофотометрии.
Методика определения дубильных веществ методом спектрофотометрии. Около 15 мл извлечения (раствор А) центрифугировали в течение 5 минут при 3000 об/мин. 5 мл центрифугата переносили в мерную колбу вместимостью 100 мл, добавляли 10 мл 2 % водного раствора аммония молибдата и содержимое колбы доводили до метки водой очищенной. Через 15 минут измеряли оптическую плотность полученного раствора при длине волны 420 нм в кювете с толщиной слоя 10 мм. В качестве раствора сравнения использовали раствор, состоящий из 5 мл центрифугата, доведенных водой очищенной до метки в мерной колбе вместимостью 100 мл.
На рисунке 1 приведены спектры поглощения растворов комплексов СО танина и извлечения из листьев скумпии кожевенной после реакции с аммония молибдатом.
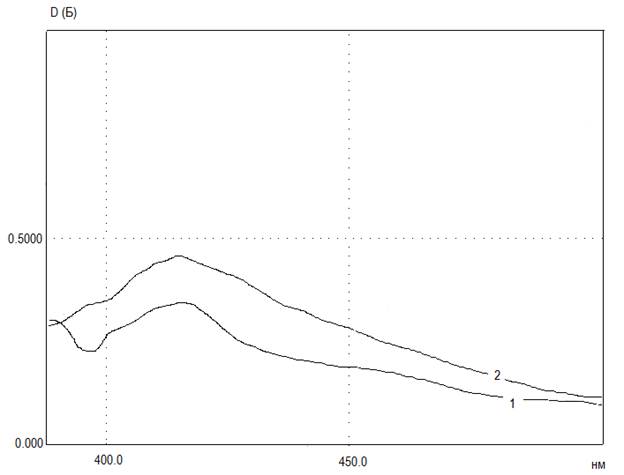
Рис.1. Спектры поглощения растворов комплексов СО танина (1) и извлечения из листьев скумпии кожевенной (2) после реакции с аммония молибдатом
Содержание дубильных веществ (Х,%) в пересчете на танин и абсолютно сухое сырье рассчитывали по формуле:
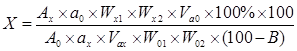 ,
,
где ![]() и
и ![]() – значения оптических плотностей растворов СО танина и анализируемого образца соответственно;
– значения оптических плотностей растворов СО танина и анализируемого образца соответственно;
![]() и
и ![]() – массы навесок СО танина и листьев скумпии кожевенной соответственно, г;
– массы навесок СО танина и листьев скумпии кожевенной соответственно, г;
W0 и Wx – мерные колбы, использованные для разведения навесок СО танина и анализируемого образца соответственно, мл;
Va0 и Vax – аликвоты растворов СО и анализируемого образца соответственно, мл.
В – влажность сырья.
Приготовление СО танина: 0,1 г СО танина (точная навеска) помещали в мерную колбу вместимостью 100 мл и растворяли в воде очищенной, после чего содержимое колбы доводили до метки тем же растворителем (раствор Б). Аликвоту в количестве 6 мл переносили в мерную колбу вместимостью 100 мл, прибавляли 10 мл 2 % водного раствора аммония молибдата и содержимое колбы доводили до метки водой очищенной. Через 15 минут измеряли светопоглощение полученного раствора при длине волны 420 нм в кювете с толщиной слоя 10 мм. В качестве раствора сравнения использовали раствор, состоящий из
6 мл раствора Б СО танина, доведенного водой очищенной до метки в мерной колбе вместимостью 100 мл.
Результаты исследований и их обсуждение
Результаты определения ДВ в листьях скумпии кожевенной с использованием различных методик представлены в таблице 3, статистическая обработка экспериментальных данных – в таблице 4.
Таблица 3
Содержание ДВ в листьях скумпии кожевенной, определенное различными методами
|
Метод |
Содержание суммы ДВ*, % |
|
Перманганатометрия |
28,28±0,81 |
|
Спектрофотометрия |
19,77±0,35 |
*Среднее значение 6 определений.
Таблица 4
Метрологическая характеристика методик определения дубильных веществ (p=95 %, n=6)
|
Xср |
Sxср |
Δx |
Xср±Δx |
ε, % |
|
Перманганатометрия |
||||
|
28,275 |
0,3153 |
0,8104 |
28,28±0,81 |
2,86 |
|
Спектрофотометрия |
||||
|
19,77 |
0,1360 |
0,3495 |
19,77±0,35 |
1,77 |
Обе методики валидированы по показателям «линейность» и «правильность», а также была проведена внутрилабораторная воспроизводимость. Анализируя химизм реакций и химический состав листьев скумпии кожевенной, мы пришли к выводу, что метод спектрофотометрии более избирателен по сравнению с титриметрическим методом и отличается большей достоверностью. Таким образом, для изучаемого ЛРС – листья скумпии кожевенной, целесообразно включить в проект НД метод спектрофотометрии для определения суммы ДВ в пересчете на танин.
Выводы
1. Проведено количественное определение ДВ по методике ГФ XI для анализа листьев скумпии кожевенной. Установлены оптимальные параметры получения извлечения (соотношение сырья и экстрагента, время экстракции и фильтрация извлечения без охлаждения).
2. Разработана методика количественного определения дубильных веществ в листьях скумпии кожевенной методом спектрофотометрии в пересчете на танин.
3. Проведена сравнительная оценка определения ДВ в листьях скумпии кожевенной двумя методами: перманганатометрии и спектрофотометрии. По результатам исследования метод спектрофотометрии наиболее объективно отражает содержание ДВ в исследуемом сырье и рекомендован для включения в современную НД на данный вид сырья.
Рецензенты:
Коновалов Д.А., д.фарм.н., профессор кафедры фармакогнозии, зам. директора по НИР, Пятигорский медико-фармацевтический институт – филиал ГБОУ ВПО ВолгГМУ Минздрава России, г. Пятигорск;
Кодониди И.П., д.фарм.н., доцент кафедры органической химии, Пятигорский медико-фармацевтический институт – филиал ГБОУ ВПО ВолгГМУ Минздрава России, г. Пятигорск.
Библиографическая ссылка
Гриценко А.И., Губанова Л.Б., Попова О.И. ПРИМЕНЕНИЕ РАЗЛИЧНЫХ МЕТОДОВ ПРИ ОПРЕДЕЛЕНИИ ДУБИЛЬНЫХ ВЕЩЕСТВ В ЛИСТЬЯХ СКУМПИИ КОЖЕВЕННОЙ (COTINUS COGGYGRIA SCOP. ) // Современные проблемы науки и образования. 2015. № 1-1. ;URL: https://science-education.ru/ru/article/view?id=18495 (дата обращения: 20.01.2026).



