Разработка эффективных методов диагностики, лечения и профилактики инфекционных осложнений и дисбиотических расстройств является одной из актуальных проблем в онкологии. Изучается диагностическая эффективность тестов, которые могли бы быть использованы для оценки состояния микрофлоры – основного компонента колонизационной резистентности организма.
Результаты ранее проведенных исследований позволили рекомендовать полость рта в качестве биотопа для оценки микроэкологических нарушений в организме человека, что повышает доступность и корректность забора исследуемого материала для проведения бактериологического анализа [1]. Однако для более точного и достоверного установления состояния дисбиоза недостаточно диагностировать «синдром избыточного роста» микроорганизмов, необходимы исследования функциональных и биологических свойств выделенных штаммов бактерий, нарушения которых могут также приводить к патофизиологическим проявлениям в организме больных. Согласно литературным данным, Escherichia coli является частой причиной инфекционных осложнений у онкологических пациентов [4].
Целью исследования явилась оценка функциональных и биологических свойств кишечной палочки, выделенной из полости рта онкологических больных.
Материал и методы
Исследование проводилось на базе кафедры микробиологии и вирусологии Сибирского государственного медицинского университета и отделения химиотерапии ФГБУ «НИИ онкологии СО РАМН». Обследовали пациентов с морфологически подтвержденными диагнозами рак молочной железы (20), рак легкого (19) и колоректальный рак (18) 2-4 стадии. Группу сравнения составили мужчины и женщины без онкологической патологии (20).
Материалом для исследования явились мазки со слизистой оболочки полости рта. Выделение культур бактерий и определение их биохимических свойств производили с помощью бактериологического метода, в соответствии с Приказом МЗ № 535 «Об унификации микробиологических методов исследования, применяемых в клинико-диагностических лабораториях лечебно-профилактических учреждений» (2006). Идентификацию выделенных культур проводили по морфологическим, тинкториальным, культуральным и ферментативным свойствам согласно руководству по систематике микроорганизмов Берджи.
Для оценки подвижности кишечной палочки использовали темнопольную микроскопию. Исследовали хемотаксисную активность [5] и адгезивные свойства кишечной палочки [2]. Антилизоцимная активность бактерий оценивалась чашечным методом [3]. Антагонизм выделенных культур кишечной палочки исследовали к 3 тест-штаммам: Staphylococcus aureusATCC 25923, Proteus mirabilis ГКПМ 160140 46 и Candida albicans 254611 NCPF 3255 ATCC 2091. Определение чувствительности кишечной палочки к дезинфицирующим веществам осуществляли методом разведений с высевом на питательную среду.
Результаты и обсуждение
Высеваемость E.сoli из ротовой полости онкологических больных была выше, нежели в группе пациентов без онкологической патологии. Так, в группе больных раком толстого кишечника она в 2 раза превышала содержание эшерихий в полости рта пациентов группы сравнения (табл. 1).
При изучении функциональных свойств кишечной палочки были выявлены следующие изменения фенотипических признаков бактерий: неспособность ферментировать глюкозу с образованием газа (41-44%), вызывать гидролиз лактозы с образованием кислоты (45-75%), осуществлять протеолиз с выделением индола (34-56%), потеря подвижности (48-65%).
Таблица 1
Показатели функциональной и биохимической активности кишечной палочки, выделенной от онкологических больных
|
Группы пациентов |
Группа сравнения, n=20 |
Больные РМЖ, n=20
|
Больные РЛ, n=19 |
Больные КРР, n=18 |
|
Высеваемость из ротовой полости, lgКОЕ/г(M±m) |
1,1±0,10 |
1,8±0,11 p<0,05 |
2,1±0,12 p<0,05 |
2,2±0,12 p<0,05 |
|
Глюкоза – образование газа (%) |
98 |
43 |
44 |
41 |
|
Лактоза – образование кислоты (%) |
92 |
75 |
57 |
45 |
|
Образование индола (%) |
98 |
56 |
50 |
34 |
|
Подвижность (%) |
81 |
65 |
48 |
56 |
Примечание. Здесь и в следующих таблицах: РМЖ – рак молочной железы; РЛ – рак легкого; КРР – колоректальный рак; р - уровень достоверности результатов между группой сравнения и группой больных.
Важной отличительной особенностью живых систем является их способность реагировать на изменения окружающей среды, которая проявляется в форме таксиса – направленного движения особей по отношению к внешнему воздействию. Таксис является одним из условий возникновения бактериальных популяционных волн и, кроме того, оказывает влияние на формирование клеточных агрегаций наряду с такими факторами, как процессы метаболизма и внешние воздействия [5].
Результаты наблюдений за ростом популяции E. сoli показали, что через 3 ч выраженного распространения микроорганизмов (хемотаксических волн) не наблюдалось. Через 5 ч вокруг места инокуляции культуры кишечной палочки появлялся мутный ореол с четко очерченными границами – хемотаксическая волна (рис. 1). Причем у колоний бактерий, выделенных из группы сравнения, диаметр ореола составил 3,8 см, а у культур, высеянных из ротовой полости больных РМЖ, РЛ и КРР, – 1,2-1,4-1,2 см соответственно.
Кроме этого, нами было выявлено, что культуре бактерий, выделенной от онкологических больных, требуется большее время для адаптации на питательной среде и начала движения, чем кишечной палочке из группы пациентов без онкологической патологии (табл. 2).
а) 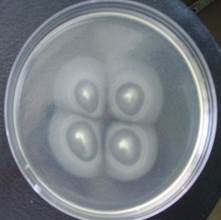 б)
б) 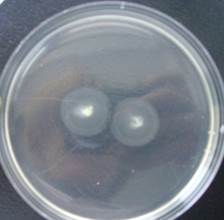
Рис. 1. Формирование хемотаксисной волны в культуре E. сoli, выделенной от: а) пациентов группы сравнения; б) больных раком легкого
Таблица 2
Изменение хемотаксисной активности E. coli, выделенной от онкологических больных
|
Группы пациентов |
Диаметр хемотаксической волны колоний E.coli, см |
|||||
|
1 ч |
2 ч |
3 ч |
4 ч |
5 ч |
7 ч |
|
|
Группа сравнения n=20 |
0,2± 0,01 |
0,2±0,02 |
0,3±0,01 |
2,5±0,04 |
3,8±0,03 |
4,2±0,03 |
|
Больные РМЖ n=18 |
0,2±0,02 p>0,05 |
0,2±0,02 p>0,05 |
0,2±0,02 p<0,05 |
0,5±0,01 p<0,05 |
1,2±0,01 p<0,05 |
2,2±0,01 p<0,05 |
|
Больные РЛ n=19 |
0,2±0,02 p>0,05 |
0,2±0,01 p>0,05 |
0,2±0,02 p<0,05 |
0,7±0,02 p<0,05 |
1,4±0,01 p<0,05 |
1,6±0,04 p<0,05 |
|
Больные КРР n=20 |
0,2±0,02 p>0,05 |
0,2±0,02 p>0,05 |
0,2±0,01 p<0,05 |
0,6±0,01 p<0,05 |
1,2±0,01 p<0,05 |
1,2±0,01 p<0,05 |
Антагонизм индигенных бактерий является одним из основных факторов колонизационной резистентности организма. Оценка антагонистической активности культур кишечной палочки к тест-штаммам стафилококка, протея и грибка Кандида выявила более низкую степень антагонизма у E. соli, выделенной из полости рта онкобольных. Так, у больных раком легкого она составляла 1,9-3,6-1,6 мм, в группе сравнения соответственно 5,3-7,9-5,4 мм (рис. 2).
Биопленкообразование у патогенных и условно-патогенных микроорганизмов играет важную роль в генезе внутрибольничных инфекций. Ведущим механизмом формирования в организме биопленки на слизистых оболочках является адгезия. Анализ результатов по определению адгезивного потенциала кишечной палочки показал, что индекс адгезии микроорганизмов (ИАМ) E. coli, выделенной от онкологических больных, в 2 раза превышает таковые значения в группе сравнения (2,58±0,73). Эти различия в значительной степени зависят от среднего показателя адгезии (СПА) – количества бактериальных клеток, адгезированных на одном эритроците (4,9±0,7 – у больных раком молочной железы; 1,9±0,5 – в группе сравнения). Менее значима была разница в коэффициентах участия эритроцитов (КУА) (табл. 3).
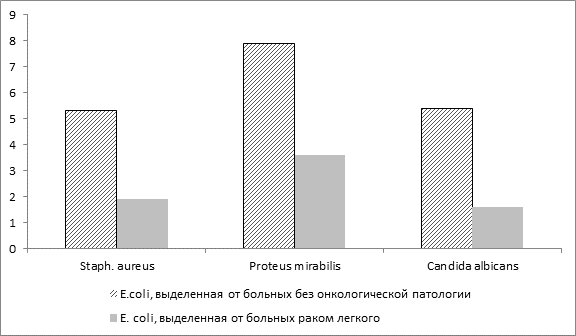
Рис. 2. Антагонистические свойства E. сoli, выделенной от больных раком легкого (на оси ординат отображена зона подавления роста тест-культур в мм)
Таблица 3
Биологические свойства E. coli, выделенной из полости рта онкологических больных
|
|
Адгезивная активность |
Антилизоцимная активность (мм) |
Устойчивость к хлоргексидину (МПК) |
||
|
СПА |
КУА |
ИАМ |
|||
|
Группа сравнения n=20 |
1,9±0,5 |
76±3,1 |
2,58±0,73 |
2±0,65 |
0,13±0,05 |
|
Больные РМЖ n=18 |
4,9±0,7 p<0,05 |
88±3,4 p<0,05 |
5,56±0,67 p<0,05 |
6±0,54 p<0,05 |
0,28±0,04 p<0,05 |
|
Больные РЛ n=19 |
4,9±1,2 p<0,05 |
89±3,6 p<0,05 |
5,48±0,54 p>0,05 |
5±0,65 p<0,05 |
0,36±0,12 p<0,05 |
|
Больные КРР n=20 |
4,4±1,1 p<0,05 |
88±3,6 p<0,05 |
5,45±0,43 p<0,05 |
6±0,56 p<0,05 |
0,44±0,13 p<0,05 |
Примечание: СПА - количество бактериальных клеток, адгезированных на одном эритроците; КУА – коэффициент участия эритроцитов; ИАМ – индекс адгезии микроорганизмов; МПК – минимально подавляющая концентрация.
Противостояние бактерий защитным факторам макроорганизма способствует их персистенции. Одним из важных факторов такого противодействия является синтез ингибитора лизоцима. Средний уровень антилизоцимной активности (АЛА) у штаммов E. сoli, выделенных от больных РМЖ, РЛ, РК, составлял соответственно 6±0,54 - 5±0,65 - 6±0,56, в то время как культуры, изолированные от неонкологических больных, обладали АЛА в 2-3 раза ниже (2±0,7).
Резистентность к дезинфицирующим веществам и антисептикам является одной из характеристик госпитальных микроорганизмов, поэтому оценка их устойчивости позволяет прогнозировать распространение условно-патогенной флоры в стационаре. Нами исследована чувствительность кишечной палочки к хлоргексидину, широко применяемому в хирургии препарату с целью асептики и антисептики. При сравнении МПК (минимально подавляющей концентрации) антисептика для разных штаммов кишечной палочки можно сделать вывод, что популяция E. coli, выделенная у онкологических больных, более устойчива к действию препарата, нежели эшерихии, высеянные у больных группы сравнения.
Таким образом, нами выявлено повышение высеваемости E.coli из ротовой полости онкологических больных с различной локализацией опухолевого процесса (рак молочной железы, рак легкого, рак толстого кишечника). Данные явления сопровождаются снижением функциональных свойств эшерихий (биохимической активности, подвижности, способности к хемотаксису, антагонистических признаков), что указывает на нарушение симбиотических и синергических взаимоотношений бактерий с макроорганизмом. Наряду с этим наблюдается усиление биологических свойств кишечной палочки (способности к адгезии, антилизоцимной активности, резистентности к дезинфектантам), обусловливающих патогенность и персистенцию бактерий. Указанные изменения более выражены у больных колоректальным раком. Можно утверждать, что для правильной интерпретации результатов бактериологического исследования, вскрытия патогенетических механизмов развития микроэкологических нарушений и их коррекции необходимы комплексные исследования состояния резидентной микрофлоры организма пациента с учетом ее функциональных и биологических свойств.
Рецензенты:
Миллер С.В., д.м.н., ведущий научный сотрудник торако-абдоминального отделения ФГБНУ «Томский НИИ онкологии», г. Томск;
Захарова Ф.А., д.м.н., профессор кафедры нормальной и патологической физиологии Медицинского института СВФУ им. М.К. Аммосова, г. Якутск.
Библиографическая ссылка
Бочкарева О.П., Красноженов Е.П., Гольдберг В.Е., Ахременко Я.А. ФУНКЦИОНАЛЬНЫЕ И БИОЛОГИЧЕСКИЕ СВОЙСТВА ESCHERICHIA COLI, ВЫДЕЛЕННОЙ ОТ ОНКОЛОГИЧЕСКИХ БОЛЬНЫХ // Современные проблемы науки и образования. 2015. № 2-1. ;URL: https://science-education.ru/ru/article/view?id=18492 (дата обращения: 10.02.2026).



