Эта система позволяет оценить все стадии производственного процесса с точки зрения возникновения риска, выявить зоны с недопустимым риском, определить соотношение выявленных опасных факторов, а также предложить предупреждающие мероприятия по предотвращению возникновения рисков.
По данным ГОСТ Р 51705.1-2001 [1] риск представляет собой «сочетание вероятности реализации опасного фактора и степени тяжести его последствий» [1]. Риск можно определить как произведение вероятности опасности на серьезность ее последствий [3].
В качестве опасных факторов (рисков) при производстве назального спрея можно выделить 3 группы: 1) микробиологические риски (микробная контаминация), 2) химические риски (остатки моющих средств, машинного масла), 3) физические риски (попадание металлической стружки, частей пластмассы и других предметов) [2,4]. Возникновение этих опасностей может привести к возникновению экономического риска, который приведет к потере готовой продукции и денежных средств.
Риски могут возникнуть на любой стадии технологического процесса в той или иной степени, поэтому важным моментом является их оценка.
Материалы и методы исследования. Исследования проводилось на базе ООО «Завод Медсинтез» в г. Новоуральске. Выявлением опасных факторов, которые могут повлиять на качество назального спрея, на всем этапе технологического процесса занималась экспертная группа ХАССП ООО «Завод Медсинтез» совместно с авторами исследования.
Результаты исследования и их обсуждение
Исследование проводилось согласно алгоритму, который включал в себя 5 последовательных этапов (рис.1).
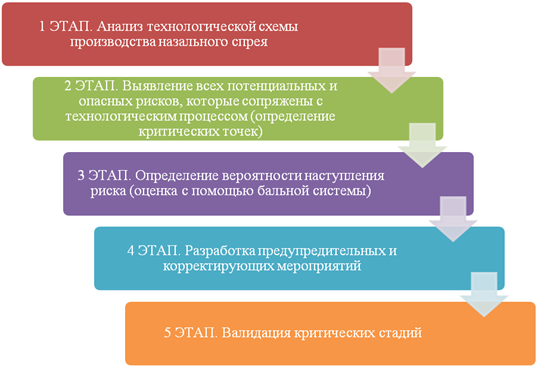
Рис. 1. Алгоритм проведения исследования
Первый этап исследования касался анализа технологической схемы производства назального спрея «Триазавирин спрей» (рис.2).
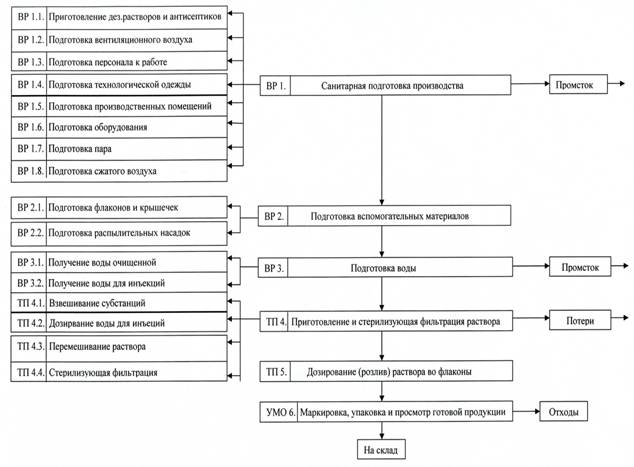
Рис. 2. Технологическая схема производства назального спрея «Триазавирин спрей»
Анализ технологической схемы производства назального спрея «Триазавирин спрей» показал, что в ней можно выделить общие стадии, которые присуши любому технологическому процессу, а именно: санитарная подготовка производства, включающая в себя приготовление дезинфицирующих растворов и антисептиков, подготовка вентиляционного воздуха, подготовка персонала к работе, подготовка технологической одежды, подготовка производственных помещений, подготовка оборудования, пара, сжатого воздуха; маркировка, упаковка и просмотр готовой продукции. Имеются и специфические стадии, присущие только производству назальных спреев: подготовка вспомогательных материалов, включающая в себя подготовку флаконов, крышечек и распылительных насадок; подготовка воды, включающая в себя получение воды очищенной и воды для инъекций; приготовление и стерилизующая фильтрация раствора, включающая в себя взвешивание субстанций, дозирование воды для инъекций, перемешивание раствора и стерилизующую фильтрацию; дозирование (розлив) раствора во флаконы.
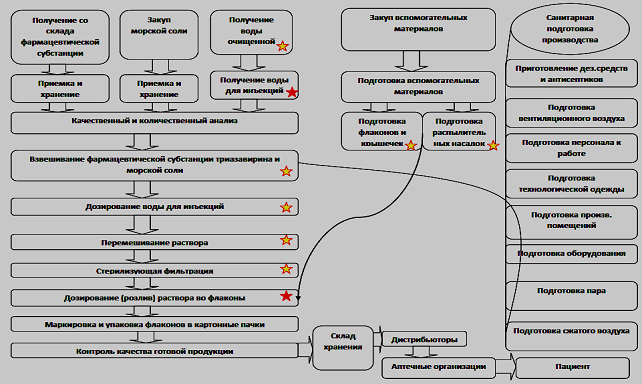
На основании технологической схемы производства назальной лекарственной формы «Триазавирин спрей» экспертами ХАССП совместно с авторами исследования была разработана производственная блок-схема (рис.3).
-
![]() критическая переходная точка
критическая переходная точка
-
![]() критическая контрольная точка
критическая контрольная точка
Рис. 3. Производственная блок-схема назальной лекарственной формы «Триазавирин спрей»
На производственной блок-схеме назальной лекарственной формы «Триазавирин спрей» экспертами ХАССП были выделены критические переходные и контрольные точки. Из блок-схемы видно, большой риск может наблюдаться на стадиях: получение воды для инъекций, дозирование (розлив) раствора во флаконы. Также риск может возникнуть на этапах: получение воды очищенной, взвешивание фармацевтической субстанции триазавирина и морской соли, дозирование воды для инъекций, перемешивание раствора, стерилизующая фильтрация, подготовка флаконов и крышечек, подготовка распылительных насадок.
Следующий этап предполагал оценку степени риска. Оценка степени риска проводилась с использованием бальной системы от 0 до 10, где 0 – риск отсутствует, 1-4 – возможен незначительный риск, 4-6 – средняя степень риска, 7-9 – высокая степень риска, 10 – очень высокая степень риска (рис.4).
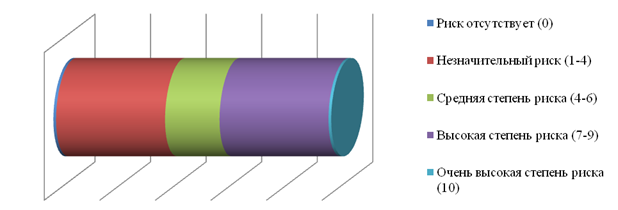
Рис. 4. Бальная шкала оценки степени риска
В таблице 1 приведены опасные факторы и предупреждающие действия при производстве назальной лекарственной формы «Триазавирин спрей»
Таблица 1
Опасные факторы и предупреждающие действия при производстве назальной лекарственной формы «Триазавирин спрей»
|
Наименование операции |
Фактор (категория) риска |
Описание риска |
Предупреждающие и корректирующие мероприятия |
Степень риска |
|
Получение воды очищенной |
Микробиологический, химический |
Возможность попадания микроорганизмов, недостаточная очистка оборудования |
Промывание оборудования и емкостей для сбора. |
|
|
Получение воды для инъекций |
Микробиологический, химический |
Возможность попадания микроорганизмов, недостаточная очистка оборудования |
Промывание оборудования и емкостей для сбора. |
|
|
Взвешивание фармацевтической субстанции триазавирина и морской соли |
Микробиологический, физический, химический |
Возможность попадания микроорганизмов, частичек других субстанций, недостаточная очистка оборудования, неточность весов |
Очистка оборудования, поверка весов |
|
|
Дозирование воды для инъекций |
Микробиологический, химический |
Недостаточная очистка трубопроводов от микроорганизмов и моющих средств |
Очистка трубопроводов от микроорганизмов и моющих средств |
|
|
Перемешивание раствора |
Микробиологический |
Возможность попадания микроорганизмов, неоднородность, осадок |
Герметизация, дополнительное перемешивание |
|
|
Стерилизующая фильтрация |
Микробиологический, химический |
Загрязнение фильтров микроорганизмами и веществами |
Замена фильтрующих материалов |
|
|
Подготовка флаконов и крышечек |
Микробиологический, химический |
Микробная контаминация, остатки моющих средств |
Ополаскивание |
|
|
Подготовка распылительных насадок |
Микробиологический |
Микробная контаминация, остатки моющих средств |
Ополаскивание |
|
|
Дозирование (розлив) раствора во флаконы |
Микробиологический |
Микробная контаминация |
|
|
Таким образом, были выявлены две наиболее критические стадии: «Получение воды для инъекций» и «Дозирование (розлив) раствора во флаконы».
На следующем этапе представляло интерес проведение валидации критических стадий. Эти данные необходимы для формирования досье на препарат для представления на госрегистрацию. Рассмотрим валидацию критической стадии «Дозирование (розлив) раствора во флаконы».
ТП 4. Приготовление и стерилизующая фильтрация раствора. В данной стадии можно выделить следующие операции:
ТП 4.1. Взвешивание и растворение фармацевтической субстанции триазавирина и морской соли. На весах взвешивают 0,100 кг морской соли (КтТП4.1.) и 0,100 кг субстанции триазавирина (КтТП4.2.), последовательно добавляют в реактор, в котором содержится 5,18 литров воды для инъекций.
ТП 4.2. Дозирование воды для инъекций. В реактор дозируют 5,18 литров воды для инъекций (КтТП4.3.).
ТП 4.3. Перемешивание раствора. Отбор воды для инъекций осуществляется из горячей точки отбора V1-2 при температуре 72-95°C (КтТП4.4.), дозирование осуществляется через мерник с учетом температуры воды в количестве 5,18 л (КтТП4.3). Затем охлаждают до температуры 35 ±5°C (КтТП4.5.) и добавляют расчетное количество соли морской. Процесс растворения контролируется визуально (КтТП4.6), затем вносят необходимое количество триазавирина и перемешивают до полного растворения (КтТП4.7), при необходимости подачей в рубашку или змеевик горячей воды поднимают температуру до 45°C (КтТП4.8). Продолжительность процесса не превышает 1-1.5 часа (КтТП4.9.). Раствор охлаждают до комнатной температуры 18-25°C (КтТП4.10) и отбирают пробу на анализ (КтТП4.11). При получении положительного анализа на содержание ингредиентов в растворе его передают через фильтр с размером пор 1 мкм в промежуточную емкость (КтТП4.12).
После фильтрации полученный раствор помещают в промежуточную герметичную емкость, емкость перемещается на стадию розлива во флаконы, осуществляемую под ламинаром (Класс В), полуавтоматом для розлива во флаконы. Раствор на полуавтоматический дозатор подают через стерилизующий ультрафильтр из промежуточной емкости путем создания стерильным сжатым воздухом избыточного давления 0,01-0,02 МПа. Эта стадия процесса производства признана наиболее критичной и подлежащей обязательной валидации.
Перед началом работы помещение и оборудование участка розлива подготовлено, согласно требованиям GMP к помещениям с зонами В. Персонал подготовлен к работе в данном помещении.
Розлив раствора Триазавирина производят при температуре 18-25°C (КтТП5.1) в стерильные полиэтиленовые флаконы вместимостью 20 мл, по 20 мл во флакон. Раствор подают из передвижного сборника, в котором контролируется качество раствора (КтТП5.2.-содержание ингредиентов; КтТП5.3.-рН раствора; КтТП5.4-наличие посторонних примесей и осадка) через фильтр стерилизующей фильтрации с размером пор 0,2 мкм на дозирующий блок полуавтомата фасовки (КтТП5.5-целостность фильтра). После фильтра отбирается проба на анализ мехпримесей (КтТП5.6.) и стерильность (КтТП5.7.) Дозировку производят поршневым дозатором. Регулировка дозы происходит за счёт установки электронного регулятора. Затем проводят укупорку флаконов насадками-распылителями.
Во время дозирования на промежуточном сборнике открыта подача сжатого воздуха через установленный на линии подачи капсульный фильтр с размером пор 0,2 мкм.
В процессе розлива периодически, через 30 мин (КТ ТП.5-8), проверяют номинальный объем раствора во флаконах объёмным методом (с помощью калиброванного цилиндра вместимостью 25 мл). Номинальный объем должен быть от 19,0 до 21,0 мл (КТ ТП.5-9).
После розлива дозирующий блок промывают водой для инъекций, затем заполняют этиловым спиртом с объёмной долей 76 % и оставляют его до следующей операции розлива.
Во время розлива дозировщик систематически, не реже, чем через 2 ч работы, обрабатывает руки в перчатках анатомических этиловым спиртом с объёмной долей 76 % или готовым дезраствором для рук.
Укупоренные флаконы с раствором собирают в кассеты и передают на стадию маркировки и упаковки.
Для формирования валидационного плана и его реализации было необходимо определить перечень важнейших контрольных точек производства стадии розлива во флаконы. В таблице 2 сведены все необходимые точки контроля процесса.
Таблица 2
Перечень важнейших контрольных точек производства стадии ТП 5 Дозирование (розлив) раствора во флаконы
|
Операция производства. Оборудование |
Контрольная точка |
Контролиру-емый параметр |
Регламенти-руемый норматив |
Методы и средства контроля |
Частота контролируемого параметра |
|
ТП.5. Дозирование (розлив) раствора во флаконы. Промежуточный сборник раствора |
КтТП5.1. |
Температура раствора, °C |
18-25 |
Термометр |
Периодически |
|
КтТП5.2. |
Содержание ингредиентов, мг/мл Триазавирин, Ионы натрия |
|
Триазавирин УФ-спектро-фотометрия Na- ААС |
Каждую серию |
|
|
КтТП5.3. |
рН раствора |
|
ГФ Х11, ОФС |
Каждую серию |
|
|
КтТП5.4 |
Наличие мехпримесей |
Отсутствие |
ГФ Х11, ОФС |
Каждую серию |
|
|
КтТП5.5 |
Целостность фильтра |
Отсутствие дефектов |
Дифф. манометр |
Постоянно |
|
|
КтТП5.6 |
Наличие мехпримесей |
Отсутствие |
ГФ Х11, ОФС |
Периодически |
|
|
КтТП5.7. |
Стерильность |
Стерильно |
ГФ Х11, ОФС |
Периодически |
|
|
ТП.5. Дозирование (розлив) раствора во флаконы. Фасовочный полуавтомат |
КтТП5.8 |
Объем дозы |
19,0-21,0 |
Мерный цилиндр |
Периодически |
|
КтТП5.9 |
Объем дозы во флаконе |
19,0-21,0 |
Мерный цилиндр |
Периодически |
|
|
КтТП5.10 |
Содержание ингредиентов, мг/мл Триазавирин Ионы натрия |
|
Триазавирин УФ-спектро-фотометрия Na- ААС |
Каждую серию |
|
|
КтТП5.11 |
рН раствора |
|
ГФ Х11, ОФС |
Каждую серию |
|
|
КтТП5.12 |
Наличие мехпримесей |
Отсутствие |
ГФ Х11, ОФС |
Каждую серию |
|
|
КтТП5.13 |
Осмоляльность |
|
|
|
|
|
КтТП5.14 |
Стерильность |
|
|
|
При разработке валидационного плана операции ультрафильтрации необходимым этапом является выбор проверяемых параметров и критериев приемлемости. Контроль процесса стерилизующей фильтрации проводился на питательной среде мясопептонного бульона ГРМ.
Выбор контролируемых параметров и требования к ним при валидации процесса стерилизующей фильтрации (таблица 3) устанавливались по ГОСТ Р 52249-2004 «Правила производства и контроля качества лекарственных средств» и ГОСТ Р ИСО 13408-1-2000 «Асептическое производство медицинской продукции».
Таблица 3
Контролируемые параметры и требования к ним при валидации процесса стерилизующей фильтрации
|
№ п/п |
Контролируемый параметр
|
Критерии приемлемости |
|
1. |
Стерильность питательной среды, прошедшей стерилизующую фильтрацию |
Питательная среда должна быть стерильной (отсутствие роста микроорганизмов) |
|
2. |
Сохранение ростовых свойств питательной среды, прошедшей стерилизующую фильтрацию |
Видимый рост тест – микроорганизмов, с концентрацией 10 КОЕ /мл во всех засеянных пробирках |
Аналогично проводили превалидацию асептической фасовки во флаконы, с тем лишь отличием, что проверка стерильности и ростовых свойств питательной среды проводилась из фасованных упаковок.
В работе использовали фильтры Milliporе: для стерилизующей фильтрации 0,22 мкм, тип CVGL72TP3; предфильтр для стерилизующей фильтрации 0,45 мкм, тип CVHL72TP3; Все фильтры прошли тесты на целостность как после стерилизации, так и после стерилизующей фильтрации.
Проведение очистки и стерилизации оборудования производили по режимам определенным СОП. Питательная среда в количестве 1 л, приготовленная в ОКК, загружалась в промежуточную емкость. Затем проводили стерилизующую фильтрацию питательной среды с отбором проб в колбу под давлением 0,05 МПа и проводили анализ на стерильность и ростовые свойства фильтрата, часть питательной среды передавали на фасовку во флаконы и проводили аналогичные анализы. Для контроля пробы отбирались и из исходной емкости.
Результаты контроля питательной среды, прошедшей стерилизующую фильтрацию и фасовку во флаконы отражены в таблице 4.
Таблица 4
Контроль стерильности питательной среды, прошедшей стерилизующую фильтрацию
|
№ цикла розлива |
Дата проведения контроля |
Наименование питательной среды, № серии, статус |
Результат: Дата |
|
I цикл фильтрации |
09.14 |
Мясопептонный бульон ГРМ, серия 99, после стерилизующей фильтрации и фасовки во флакон |
Стерильно |
|
I цикл фасовки |
|||
|
II цикл фильтрации |
10.14 |
Мясопептонный бульон ГРМ, серия 103, после стерилизующей фильтрации |
Стерильно |
|
II цикл фасовки |
|||
|
III цикл фильтрации |
11.14. |
Мясопептонный бульон ГМФ, серия 040048, после стерилизующей фильтрации |
Стерильно |
|
III цикл фасовки |
Контроль питательной среды на ростовые свойства проводился согласно ВФС 42-3455- 99 «Определение ростовых свойств питательных сред, используемых для испытания на стерильность и микробиологическую чистоту» и СОП 03-01-47 М «Определение ростовых свойств питательных сред, применяемых для испытания на стерильность и микробиологическую чистоту».
В качестве тест культур для проверки ростовых свойств питательных сред использовались штаммы микроорганизмов:
- S aureus АТСС 6538-Р, в разведении 10 микробных тел в 1 мл;
- E coli NCDC 25922, в разведении 10 микробных тел в 1 мл;
- Ps aeruginosa ГИСК 453, в разведении 10 микробных тел в 1 мл;
- В cereus ГКПМ 8035, в разведении 10 микробных тел в 1 мл.
Результаты, полученные при проведении превалидации процесса стерилизующей фильтрации и фасовки с использованием питательных сред, позволяют сделать следующие выводы:
1.Подготовка установки стерилизующей фильтрации фирмы Milliporе с использованием фильтров 0,22 мкм, тип CVGL72TP3, и фасовки на фасовочном полуавтомате выполняется надлежащим образом, согласно требованиям стерильного производства, не предусматривающего финишную стерилизацию, и обеспечивает получение стерильных растворов.
2.Процесс стерилизующей фильтрации на опытном участке производства стерильных препаратов является эффективным, стабильно повторяемым, обеспечивает требуемый уровень качества «имитатора» лекарственного средства (питательной среды) по показателю «стерильность», не изменяет свойств фильтруемого продукта (ростовые свойства питательной среды сохранены) и удовлетворяет всем установленным критериям приемлемости.
Полученные результаты анализа качества продукта по заложенным параметрам сведены в таблице 5 (контроль качества фасованного продукта) по пяти опытно-промышленным сериям спрея.
Результаты посерийного контроля опытно-промышленных серий сведены в таблице 5.
Полученные результаты показали высокую стабильность предлагаемого процесса, а выбранные технологические параметры работы оборудования позволяют получать стабильные результаты, отвечающие требованиям получения качественного продукта.
Заключение
Таким образом, анализ технологической схемы производства назального спрея «Триазавирин спрей» позволил выделить общие и специфические стадии. На основании технологической схемы была разработана производственная блок-схема, на которой были выделены критические переходные и контрольные точки. Проведена оценка каждой точки с использованием бальной шкалы, разработаны предупредительные и корректирующие мероприятия. Были определены две наиболее критические стадии: «Получение воды для инъекций» и «Дозирование (розлив) раствора во флаконы». Проведена валидация стадии «Дозирование (розлив) раствора во флаконы», показавшая высокую стабильность технологического процесса и выбранных технологических параметров работы оборудования.
Таблица 5
Результаты посерийного контроля опытно-промышленных серий
|
Показатель Образец Серия |
Описание |
Подлинность |
Прозрачность |
Цветность
|
Сухой остаток,% (метод высушивания) |
Осмоляльность, моль/кг воды (криоскопический метод) |
рН |
Количественное содержание
|
Микробная чистота |
|||||
|
Триазавирина* |
Морской соли** |
Триазавирина***, мг/мл |
Морской соли, мг/мл ****
|
|||||||||||
|
Na |
Mg |
Ca |
K |
|||||||||||
|
ОП-1 |
прозрачный раствор желто-зеленого цвета |
+ |
+ |
прозрачный
|
не превышает окраску эталона Y2 или GY2 |
2,12 |
327 |
7,12 |
9,5 |
3,4 |
0,37 |
0,05 |
0,11 |
в пределах нормы |
|
ОП-2 |
прозрачный раствор желто-зеленого цвета |
+ |
+ |
прозрачный |
не превышает окраску эталона Y2 или GY2 |
2,05 |
320 |
7,14 |
9,7 |
3,5 |
0,37 |
0,04 |
0,11 |
в пределах нормы |
|
ОП-3 |
прозрачный раствор желто-зеленого цвета |
+ |
+ |
прозрачный |
не превышает окраску эталона Y2 или GY2 |
2,11 |
325 |
7,13 |
9,9 |
3,1 |
0,36 |
0,05 |
0,12 |
в пределах нормы |
|
ОП-4 |
прозрачный раствор желто-зеленого цвета |
+ |
+ |
прозрачный |
не превышает окраску эталона Y2 или GY2 |
2,06 |
330 |
7,20 |
9,9 |
3,8 |
0,37 |
0,05 |
0,11 |
в пределах нормы |
|
ОП-5 |
прозрачный раствор желто-зеленого цвета |
+ |
+ |
прозрачный |
не превышает окраску эталона Y2 или GY2 |
2,14 |
329 |
7,23 |
10,1 |
3,4 |
0,37 |
0,04 |
0,12 |
в пределах нормы |
*УФ-спектр, ВЭЖХ **Реакции на натрий, калий, кальций, магний, хлориды, сульфаты ***Спектрофотометрический метод ****Метод ААС
Русинов В.Л., д.х.н., профессор, директор химико-технологического института Уральского федерального университета им. Первого Президента России Б.Н.Ельцина, г. Екатеринбург; Сысуев Б.Б., д.фарм.н., доцент, заведующий кафедрой технологии и биотехнологии ВолГМУ Минздрава России, г. Волгоград.
Библиографическая ссылка
Кинев М.Ю., Петров А.Ю. ОЦЕНКА РИСКОВ В ТЕХНОЛОГИИ ПРОИЗВОДСТВА НАЗАЛЬНОГО СПРЕЯ «ТРИАЗАВИРИН СПРЕЙ» И ВАЛИДАЦИЯ КРИТИЧЕСКИХ СТАДИЙ // Современные проблемы науки и образования. 2015. № 1-1. ;URL: https://science-education.ru/ru/article/view?id=18331 (дата обращения: 07.02.2026).



