Ангиосомная теория, разработанная Taylor в 1987 г. и впоследствии дополненная Palmer, представляет собой концепцию, разделяющую тело человека на отдельные трехмерные участки тканей от кожи с подлежащими клетчаткой, мышцами вглубь до кости, имеющие свои границы и кровоснабжаемые одной питающей артерией. Таких участков, названных ангиосомами, было выделено 40 [1, 2, 3]. Их изучение проводилось путем введения в артерии оксида свинца с разноцветными красителями и последующей микропрепаровкой [4]. В норме каждый из ангиосом соединен с двумя соседними посредством незначительного количества истинных анастомозов и куда чаще встречающихся «choke vessels», или неполноценных анастомозов [5, 6]. Они, как показали проведенные исследования, располагаются внутри одноименных тканей с наибольшей плотностью в мышечной.
Эта теория была разработана для нужд пластической реконструктивной хирургии. Благодаря изучению ангиосом ткани тела человека, в том числе и кожа, были разделены на отдельные участки с довольно точно определенными границами [7]. С ее учетом забранные лоскуты кожи кровоснабжаются полноценно на всей площади, что в свою очередь приводит к лучшему приживлению на месте пересадки [8, 9].
Однако за более чем 25 лет своего существования ангиосомная теория так и не вырвалась из рамок морфологического подхода к изучению, что ограничивает области ее применения в реконструктивной хирургии лишь для определения границ лоскута [1].
Цель исследования: изучить количественные показатели кровоснабжения кожи с учетом ангиосомной теории.
Материал и методы
Нами была изучена микроциркуляция кожи всего человека с учетом ангиосомного подхода на аппарате Easy-LDI фирмы Aimago, Швейцария. Для решения этой задачи были отобраны 46 человек без патологии сердечно-сосудистой системы, средний возраст которых составил 32 года. У 17 из них оценивали кожный кровоток на голове, шее, туловище и верхних конечностях, у 29 — перфузию кожи ангиосом нижних конечностей.
Микроциркуляция изучалась новым способом — лазерной допплеровской визуализацией, позволяющей бесконтактно (фокусное расстояние от излучателя-приемника до исследуемой ткани, в нашем случае кожного покрова, составляет 20 см) оценить перфузию тканей на площади в 100 см2 с толщиной зондируемого слоя до 2 мм в режиме реального времени. Механизм действия схож с методом лазерной допплеровской флоуметрии и базируется на физическом законе эффекта Допплера.
Числовые показатели кожной перфузии отображались в виде относительных перфузионных единиц, соответствующих количеству эритроцитов, их линейной скорости и направленности вектора движения в объеме пространства.
Все измерения проводились в заранее разработанных стандартных точках с учетом известных на сегодняшний день границ ангиосом и топографоанатомическим обоснованием, в стандартных условиях. В небольших и средних по площади ангиосомах кожная перфузия была изучена в одной точке (100 см2). В зависимости от размеров каждого конкретного ангиосома замеры проводились в 1–2–3 точках. Во время исследования было выделено 18 точек на нижних конечностях и 24 — на остальных участках тела человека.
Производилась непрерывная запись кожной микроциркуляции в течение 5–7 с. Мы не ставили перед собой задачу оценить активные и пассивные факторы, влияющие на перфузию. В поле зрения наших интересов был только общий уровень микроциркуляции в коже за определенный промежуток времени.
При обработке полученного материала числовые показатели перфузии в каждой конкретной точке у одного пациента соответствовали распределению Гаусса и были представлены нами в виде минимума, максимума, среднего и стандартного отклонений. Обобщенные данные были представлены по отношению к закону нормального распределения: либо по вышеупомянутым показателям, либо в виде медианы, верхнего и нижнего квартилей. Достоверность различий определяли путем использования дисперсионного анализа (не- или параметрического), t-теста. Весь числовой материал, представленный на рисунках, отображен в виде 95%-ных доверительных интервалов для среднего.
Результаты
На голове измерили уровень кожной микроциркуляции ангиосом надблоковой и надглазничной артерий, отходящих от глазной артерии, являющейся в свою очередь ветвью внутренней сонной артерии, а также ангиосом лицевой, подбородочной артерий, отходящих от наружной сонной (рис. 1).
На шее ангиосомы передней и задней областей кровоснабжаемые в основном за счет ветвей щито-шейного ствола.
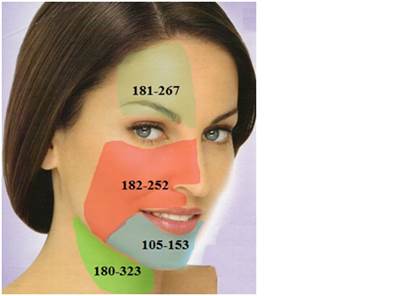
Рис.1. Микроциркуляция кожи ангиосом лица и шеи
На теле изучили перфузию ангиосома межреберных артерий, поясничных, надчревных (верхней, нижней и поверхностной), латеральной грудной, грудоспиной и ангиосома лопаточного анастомотического круга (рис. 2).

Рис.2. Микроциркуляция кожи ангиосом туловища и контрольной точки

Рис. 3. Микроциркуляция кожи ангиосом верней конечности
На верхней конечности микроциркуляцию кожи с помощью LDI определяли в ангиосомах: передней и задней, огибающих плечевую кость; плечевой; глубокой артерии плеча; локтевой ямки; лучевой; локтевой; тыл кисти; донная поверхность с поверхностной и глубокой ладонными дугами и артериями первого пальца кисти (рис. 3).
На нижней конечности изучили кожную перфузию ангиосома ягодичных артерий; передней и задней областей бедра в верхней, средней и нижних третях соответственно; запирательной артерии в двух точках; передней большеберцовой артерии в верхней, средней и нижних третях; ангиосома задней большеберцовой и малоберцовой артерий в средней трети голени и в области лодыжек. На стопе область первого межпальцевого промежутка с питающей ее артерией тыла стопы и на средине подошвенной части стопы с дугой латеральной подошвенной артерии (рис. 4).
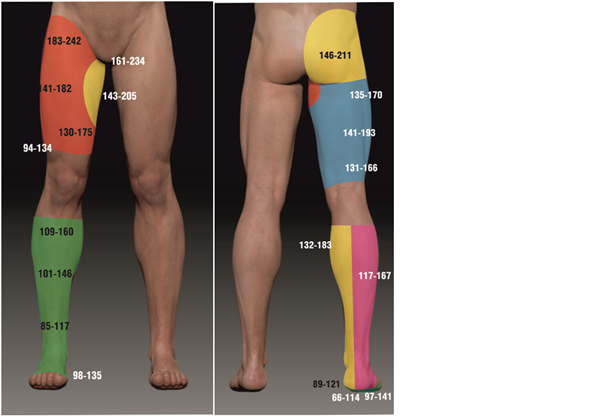
Рис. 4. Микроциркуляция кожи ангиосом нижних конечностей
Заключение
Нами впервые была изучена микроциркуляция кожи всего человека с учетом ангиосомного подхода. Различия в перфузии кожи зависят от множества факторов, таких как строение кожного кровотока, калибр магистральной артерии и степень ее ветвления и др. Как известно, микроциркуляция кожи является очень вариабельным показателем со значительными колебаниями у одного и того же человека при исследовании в разные временные промежутки. В работе мы постарались решить эту проблему следующим образом. Эмпирически на начальном этапе решено было выбрать перфузию в локтевой ямке как контрольную точку, на основании расположения плечевой артерии сразу под собственной фасцией, в том месте, где слой подкожной жировой клетчатки невелик, наличие множества коллатералей и редкого встречаемого поражения магистрального артериального русла верхних конечностей. В процессе статистической обработки результатов наш эмпирический выбор подтвердился. На основании этого предлагаем оперировать не абсолютными значениями микроциркуляции кожи, а отношением значения перфузии в искомом ангиосоме к таковому в локтевой ямке. Это позволит нивелировать многие из внешних (температура, физическая нагрузка) и внутренних (гормональный фон, перераспределение ОЦК) факторов, влияющих на естественную вариабельность кожного кровотока. В результате проведенной работы были разработаны нормы микроциркуляции кожи человека с учетом ангиосомного подхода.
Теперь, спустя 25 лет, в ангиосомной теории, помимо морфологического, появился и функциональный подход. Это позволит пластическим хирургам, до сегодняшнего дня знавшим границы ангиосом, производить забор кожных лоскутов на микрососудистой ножке не только с учетом последних, но и выбирать наиболее богато кровоснабжаемые ангиосомы, что еще в большей степени повысит приживляемость кожных лоскутов.
Рецензенты:
Филимонов В.И., д.м.н., профессор, профессор кафедры оперативной хирургии и топографической анатомии ГБОУ ВПО ЯГМУ Минздрава РФ, г. Ярославль;
Румянцева Т.А., д.м.н., профессор, заведующий кафедрой анатомии человека ГБОУ ВПО ЯГМУ Минздрава РФ, г. Ярославль.
Библиографическая ссылка
Новиков Ю.В., Фомин А.А., Першаков Д.Р. НОВЫЙ ВЗГЛЯД НА АНГИОСОМНУЮ ТЕОРИЮ С ТОЧКИ ЗРЕНИЯ МИКРОЦИРКУЛЯЦИИ // Современные проблемы науки и образования. 2015. № 1-1. ;URL: https://science-education.ru/ru/article/view?id=18160 (дата обращения: 20.01.2026).



