При электроосаждении металлов и сплавов достаточно широко используются различные поверхностно-активные органические вещества (ПАОВ) [7], которые обеспечивают получение мелкокристаллических ровных блестящих и полублестящих гальванических покрытий.
На основании исследований, выполненных в [1, 2, 4, 5, 7, 8], роль ПАОВ может быть сведена к трем эффектам:
1) адсорбция на поверхности электрода [8];
2) образование комплексных соединений с ионами тяжелых металлов в электролите [7];
3) образование коллоидных частиц с ионами металлов [2, 5].
Данные эффекты приводят к смещению катодной поляризационной кривой в область более отрицательных значений потенциала, что и обеспечивает получение качественных покрытий металлами и сплавами.
Цель работы: исследование влияния ПАОВ на кинетические особенности процессов осаждения покрытий свинцом, индием, оловом и сплавами индий-кадмий и кадмий-олово температурно-кинетическим методом.
Методика эксперимента. Исследования проводили в термостатируемых условиях. Растворы готовили на дистиллированной воде с использованием реактивов марки «х.ч.». Для получения поляризационных кривых применяли потенциостаты Р-8 («Elins») и IPC-Pro, подключенные к персональному компьютеру для управления, регистрации и обработки данных. Потенциалы рабочего электрода измеряли по отношению к хлоридсеребряному электроду сравнения ЭВЛ-1М и пересчитывали по водородной шкале.
Теоретическая часть
Образование на поверхности катода адсорбционной пленки приводит к возникновению дополнительного энергетического барьера, связанного с затруднением проникновения реагирующих частиц через плотный адсорбционный слой, т.е. к замедлению транспорта электроактивных частиц к поверхности катода.
На поляризационных кривых процесса разряда ионов металлов наблюдается площадка адсорбционного предельного тока (![]() ), величина которого меньше по сравнению с предельным током диффузии в растворе в отсутствии ПАОВ. Это явление известно как “эффект Лошкарева”. В этом случае величина
), величина которого меньше по сравнению с предельным током диффузии в растворе в отсутствии ПАОВ. Это явление известно как “эффект Лошкарева”. В этом случае величина ![]() не зависит ни от потенциала (перенапряжения), ни от перемешивания, в отличие от предельных диффузионных токов. Лошкарёвым М.А. было показано, что такие предельные токи определяются уравнением [8]:
не зависит ни от потенциала (перенапряжения), ни от перемешивания, в отличие от предельных диффузионных токов. Лошкарёвым М.А. было показано, что такие предельные токи определяются уравнением [8]:
![]() (1)
(1)
где ![]() -степень заполнения поверхности катода адсорбированным веществом
-степень заполнения поверхности катода адсорбированным веществом ![]() ,
, ![]() ,
, ![]() и a – постоянные, со – концентрация электроактивного вещества в растворе.
и a – постоянные, со – концентрация электроактивного вещества в растворе.
В работах Дамаскина Б.Б. и Афанасьева Б.Н. [1, 4] показано, что при степени заполнения поверхности электрода (θ) не участвующими в катодном процессе ПАОВ менее 0,8 (θ < 0,8) и, если электродная реакция выделения металла лимитируется стадией присоединения электрона, то плотность тока осаждения металла (![]() ) в зависимости от степени заполнения поверхности катода ПАОВ записывается уравнением следующего вида:
) в зависимости от степени заполнения поверхности катода ПАОВ записывается уравнением следующего вида:
![]() (2)
(2)
Использование данного уравнения возможно вследствие непрерывного обновления поверхности катода при осаждении металла, и включения некоторого количества ПАОВ в осадок. Последнее и обеспечивает заполнения поверхности электрода ПАОВ менее 0,8.
Зависимость предельной плотности катодного тока (iпр) от концентрации иона металла в растворе (с) с учетом уравнения (1) запишется следующим уравнением [9]:
![]() (3)
(3)
Образование комплексных соединений между металлом и ПАОВ может создать дополнительное сопротивление переносу электронов при разряде образовавшейся электроактивной частицы [7].
Изучая катодную поляризацию при осаждении цинка [5] и кадмия [8] из сульфатных растворов с добавками фенолов, дифениламина и желатины авторы, установили, что разряд данных ионов металлов из растворов, содержащих коллоиды, сопровождается очень высокой химической поляризацией. По мнению авторов данных работ это обусловлено образованием в электродной пленке адсорбционных ионно-коллоидных комплексов, затрудняющих проникновение ионов через адсорбционный слой.
Если лимитирующей стадией процесса электроосаждения металла на катоде является диффузия электроактивных частиц к поверхности катода (без учета явления миграции ионов к электроду, т.е. в достаточно концентрированных электролитах), то катодный предельный ток на вращающемся дисковом электроде запишется следующим уравнением [9]:
![]() (4)
(4)
Коэффициент диффузии определяется уравнением [5, 9]:
![]() (5)
(5)
Wдиф – энергия активации процесса диффузии.
Кинематическая вязкость жидкостей уменьшается с повышением температуры, а для ньютоновских жидкостей эта зависимость от температуры описывается уравнением [10]:
![]() (6)
(6)
где νо – коэффициент, зависящий от вида жидкости, Wв – энергия активации течения.
Совместное решение трех последних уравнений с учетом уравнения (1) приводит к следующей зависимости предельной плотности катодного тока:
![]() (7)
(7)
Одним из методов определения лимитирующей стадии процесса является температурно-кинетический метод, предложенный Темкиным М.И. для процесса электрохимического выделения водорода и развитый в дальнейшем применительно к процессу осаждения металлов С.В. Горбачевым [3]. В данном методе вывод о лимитирующей стадии процесса делается на основании значения энергии активации процесса.
При использовании температурно-кинетического метода в исследовании кинетики электрохимических процессов наиболее достоверные результаты получаются, если на поляризационных кривых имеется площадка предельного тока. В этом случае удается избежать влияния потенциала катода или перенапряжения на величину энергии активации процесса, что достаточно убедительно показано Афанасьевым Б.Н. с соавторами на примере исследования процесса разряда ионов цинка, кадмия, хрома (III) и меди в присутствии трет-бутилового спирта, а также авторами работы [6] для кадмия и свинца в присутствии в электролите ПАОВ, как на ртутном, так и на твердом электродах.
После несложных преобразований уравнения (3), учитывая, что W не зависит от потенциала и α=0, получим уравнение, которое можно использовать для определения кажущейся или эффективной энергии активации (![]() ) процесса электроосаждения металла на катоде при двух температурах Т1 и Т2:
) процесса электроосаждения металла на катоде при двух температурах Т1 и Т2:
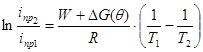 (8)
(8)
При постоянной концентрации иона металла, неизменности гидродинамических условий электролиза и двух температурах Т1 и Т2 преобразуя уравнение (7), получим выражение для определения некоторой общей суммарной энергии активации процесса диффузии и вязкого течения (4Wдиф+Wв +6∆G(θ)):
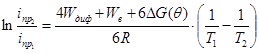 (9)
(9)
Таким образом, определение природы предельного тока (лимитирующей стадии процесса) при электроосаждении металлов представляет несомненный теоретический и практический интерес, т.к. позволяет интенсифицировать процесс осаждения металла и обеспечивает получение качественных покрытий.
Результаты и их обсуждение
Изучение роли ПАВ на величину предельного тока электроосаждения металлов проводили из электролитов, состав которых представлен в табл. 1.
Таблица 1
Составы электролитов, приводимых в данном исследовании
|
Электролит № |
Осаждаемое покрытие металлом или сплавом |
Состав |
|
1. |
Pb |
Ацетат свинца (на металл) – 10 г/л, ацетат натрия – 20 г/л, уксусная кислота – 100 г/л, ПАОВ «Капля VOX супер активный кислород» (ТУ 2383-063-14551353-05) (мл/л) – 8 мл/л, pH 5 |
|
2. |
In |
Нитрат индия (на металл) – 10 г/л, ацетат натрия – 20 г/л, уксусная кислота – 100 г/л, ПАОВ «Капля VOX супер активный кислород» (ТУ 2383-063-14551353-05) (мл/л) – 8 мл/л, pH 5 |
|
3. |
In |
Хлорид индия (на металл) – 10 г/л, винная кислота 65 г/л, хлорид аммония – 70 г/л, Лимеда БК-10А – 2 мл/л, pH 2,5 |
|
4. |
In-Cd |
Хлорид индия (на металл) – 10 г/л, сульфат кадмия (на металл) – 2 г/л, винная кислота 65 г/л, хлорид аммония – 70 г/л, Лимеда БК-10А – 2 мл/л, pH 2,5 |
|
5. |
Cd-Sn |
Сульфат кадмия (на металл) – 38 г/л, cульфат олова (II) (на металл) – 21 г/л, серная кислота (конц.) – 182 г/л, ОП-10 – 1 |
|
6. |
Sn |
Хлорид олова (IV) (на металл) – 15 г/л, молочная кислота – 150 - мл/л, рН 1 |
На всех потенциодинамических поляризационных кривых восстановления вышеперечисленных металлов и сплавов имеются площадки предельных токов. Причем, повышение температуры раствора приводит к значительному увеличению предельной плотности тока (![]() ), что может быть обусловлено как увеличением коэффициента диффузии электроактивных частиц, принимающих участие в катодной реакции, так и уменьшением степени заполнения поверхности катода ПАВ. Вклад последнего фактора, по нашему мнению, незначителен, т.к. повышение температуры не приводит к ухудшению качества покрытий, что должно быть обусловлено осаждением металла на незанятой ПАОВ части поверхности катода.
), что может быть обусловлено как увеличением коэффициента диффузии электроактивных частиц, принимающих участие в катодной реакции, так и уменьшением степени заполнения поверхности катода ПАВ. Вклад последнего фактора, по нашему мнению, незначителен, т.к. повышение температуры не приводит к ухудшению качества покрытий, что должно быть обусловлено осаждением металла на незанятой ПАОВ части поверхности катода.
Построение зависимостей в координатах ![]() позволило определить значения эффективной энергии активации, приведенные в таблице 2.
позволило определить значения эффективной энергии активации, приведенные в таблице 2.
Таблица 2
Значения эффективной энергии активации для процессов осаждения металлов и сплавов из электролитов, состав которых приведен в таблице 1
|
Эффективная энергия активации, W (кДж/моль) процесса осаждения |
|||||
|
Свинца из электролита 1 |
Индия из электролита 2 |
Индия из электролита 3 |
Сплава индий-кадмий из электролита 4 |
Сплава кадмий-олово из электролита 5 |
Олова из электролита 6 |
|
36,8 |
59,2 |
20,2 |
15,9 |
22,9 |
17,0 |
Анализ значений эффективной энергии активации позволяет сделать предположение о природе поляризации электрода. Так, в электролитах №№ 3, 4, 5 и 6 наибольшее влияние на скорость процесса оказывает стадия доставки электроактивных частиц к поверхности электрода. В электролитах №№ 1 и 2 имеет место смешанная кинетика [3], т.е. лимитирующими являются, как минимум, две стадии. Установить, какие именно стадии процесса являются замедленными, используя только температурно-кинетический метод, невозможно. Для этого необходимо проведение дополнительных исследований с использованием других независимых методов.
Следует обратить внимание на тот факт, что значения эффективной энергии активации в исследованных процессах достаточно низки (менее 50 кДж/моль). Это позволяет сделать вывод о том, что в данных случаях стадия химического взаимодействия металла и ПАОВ не является лимитирующей.
По мнению авторов данной работы для исследованных процессов наиболее вероятны два варианта комбинации замедленных стадий:
1) стадия транспортировки + стадия разряда;
2) стадия транспортировки электроактивной частицы к поверхности электрода, покрытой слоем ПАОВ + стадия диффузии данной частицы через слой ПАОВ.
Выводы
Наиболее целесообразно использование температурно-кинетического метода для исследования кинетики электрохимических реакций для случаев, когда на поляризационных кривых имеются площадки предельного тока. В данном случае величина эффективной энергии активации не зависит от потенциала в широком диапазоне значений.
В случае смешанной кинетики, когда скорость сложного последовательного процесса в равной (или почти в равной степени) определяется скоростью нескольких стадий, выявление лимитирующих стадий весьма затруднено и возможно только на основании комплекса независимых методов.
Рецензенты:
Кошев А.Н., д.х.н., профессор кафедры информационно-вычислительных систем ФГБОУ ВПО «Пензенский государственный университет архитектуры и строительства», г. Пенза;
Розен А.Е., д.т.н., профессор, зав. кафедрой сварочного, литейного производства и материаловедения ФГБОУ ВПО «Пензенский государственный университет», г. Пенза.
Библиографическая ссылка
Перелыгин Ю.П., Киреев С.Ю., Киреева С.Н., Кирилина Ю.Н. ИССЛЕДОВАНИЕ МЕХАНИЗМОВ ПРОЦЕССОВ ФОРМИРОВАНИЯ ПОКРЫТИЙ СВИНЦОМ, ИНДИЕМ, ОЛОВОМ И СПЛАВАМИ ИНДИЙ-КАДМИЙ И КАДМИЙ-ОЛОВО // Современные проблемы науки и образования. 2015. № 1-1. ;URL: https://science-education.ru/ru/article/view?id=17970 (дата обращения: 12.03.2026).



