Хроническая обструктивная болезнь легких (ХОБЛ) и диффузные заболевания паренхимы легких (ДЗЛ) связаны с высокой вероятностью развития легочной гипертензии (ЛГ) [1], которая уменьшает переносимость физической нагрузки, увеличивает выраженность одышки, частоту госпитализаций [2, 3] и снижает выживаемость больных [4–6]. Основной причиной развития ЛГ является артериальная гипоксемия, в последние годы обсуждается дисфункция эндотелия легочных сосудов, в том числе связанная с воспалением [7]. Рядом исследований продемонстрировано увеличение содержания системных воспалительных маркеров (С-реактивного белка (СРБ) и фактор некроза опухоли альфа (ФНО-альфа)) у больных ХОБЛ с ЛГ [8] по сравнению с пациентами с ХОБЛ без ЛГ. Несмотря на проведенные исследования, потенциальная роль системного воспаления в процессе ремоделирования легочных сосудов у больных ХОБЛ до конца не установлена [9].
Цель настоящей работы: изучить особенности течения хронической обструктивной болезни легких в зависимости от наличия и тяжести легочной гипертензии, определить содержание биомаркеров воспаления (СРБ, фибриногена) и их диагностическую значимость для прогнозирования ЛГ при ХОБЛ.
Материалы и методы. В исследование было включено 288 пациента с ХОБЛ (II, III, IV степени тяжести, GOLD 2013 [10], мужчин 276, женщин 12, средний возраст 59,49 ±0,63 лет, индекс курения 23,09±0,93, ИМТ 27,22±9,06). В зависимости от наличия и степени повышения систолического давления в легочной артерии (СДЛА) пациенты были разделены на три группы: 1-я - без легочной гипертензии (СДЛА <40 мм. рт. ст., n168 ), 2-я – с нетяжелой легочной гипертензией (СДЛА 40- 55 мм. рт. ст, n101 ), 3-я группа - с тяжелой легочной гипертензией (СДЛА > 55 мм. рт. ст, n19). Критерием легочной гипертензии с учетом параметров доплер-эхокардиографии было увеличение СДЛА > 40мм.рт.ст. в покое [1]. Критериями исключения из исследования были: хроническая сердечная недостаточность (с ФВ левого желудочка < 50%), портальная гипертензия, ТЭЛА, заболевания соединительной ткани, ВИЧ-инфекция, прием анорексигенных препаратов.
Спирометрию по показателям: форсированная жизненная емкость легких (ФЖЕЛ), объем форсированного выдоха за 1-ю секунду (ОФВ1), модифицированный индекс Тиффно (ОФВ1/ФЖЕЛ) проводили на оборудовании Master Screen Body (Erich Jaeger, Германия). Полученные данные сопоставляли с должными величинами (ЕРО, 1993г). Эхокардиографическое исследование сердца проводилось на аппарате Fillips Inviser CHD, изучались стандартные параметры гемодинамики, СДЛА определяли с помощью непрерывно-волновой доплерографии. Статистическую обработку данных производили в пакете прикладных программ STATISTICA V.7.0 ("StatsoftInc", США). Сравнительный анализ групп проводился с помощью непараметрических методов, использовался ранговый анализ вариаций по Краскеллу-Уоллису. В случае если нулевая гипотеза об отсутствии различий отклонялась, проводили парное сравнение групп с использованием непараметрического теста Манна-Уитни. Количественные данные представлены в виде М ± m, где М – выборочное среднее, m – стандартная ошибка средней. Для анализа чувствительности диагностического теста использовали ROC-анализ при помощи пакета прикладных программ SPSS for Windows, Release 22. Различия считали статистически значимыми при p < 0,05.
Результаты. Группы пациентов не различались по возрасту, половой принадлежности, длительности заболевания. Однако ИК и частота обострений заболевания в течение года были значительно выше у пациентов с тяжелой легочной гипертензией по сравнению с пациентами без ЛГ (p< 0,05) и нетяжелой ЛГ (p< 0,05) (табл. 1).
Таблица 1
Клиническая характеристика больных ХОБЛ
|
Показатель |
СДЛА <40мм.рт.ст. n 168 |
СДЛА 40-55 мм.рт.ст n 101 |
СДЛА >55 мм.рт.ст n19 |
p |
||
|
1-2 |
1-3 |
2-3 |
||||
|
Возраст, годы |
61,1±0,83 |
59,5±1,15 |
61,8±1,27 |
0,14 |
0,79 |
0,45 |
|
Пол, м/ж |
160/8 |
98/3 |
18/1 |
|
|
|
|
ДлитХОБЛ, лет |
13,7±0,63 |
12,8±0,86 |
12,02±0,78 |
0,28 |
0,11 |
0,56 |
|
Частота обострений/год |
1,5±0,07 |
1,7±0,08 |
3,05±0,14 |
0,03 |
0,001 |
0,001 |
|
ИК, пачек/лет |
26,6±0,89 |
30,1±1,45 |
37,7±3,42 |
0,02 |
0,002 |
0,03 |
|
ИМТ,кг/м2 |
23,8±0,46 |
32,5±4,52 |
29,3±1,23 |
0,04 |
0,001 |
0,12 |
|
ФЖЕЛ, % |
66,5±1,93 |
61,6±2,31 |
49,7±2,44 |
0,07 |
<0,001 |
<0,001 |
|
ОФВ1, % |
38,7±1,58 |
32,9±2,11 |
27,2±2,16 |
0,02 |
0,002 |
0,05 |
|
ОФВ1/ФЖЕЛ |
44,3±1,1 |
42,6±1,75 |
46,2±2,55 |
0,16 |
0,87 |
0,23 |
|
mMRC, баллы |
3,1±0,03 |
3,32±0,06 |
3,9±0,45 |
0,06 |
0,001 |
0,001 |
|
СAT, баллы |
27,1±0,56 |
29,5±0,79 |
33,3±0,59 |
0,01 |
0,001 |
0,001 |
|
6МШП, м |
238,8±3,56 |
227,32±5,03 |
174,2±5,81 |
0,04 |
0,001 |
0,001 |
|
Borg, баллы |
5,36±0,07 |
5,62±0,12 |
6,7±0,09 |
0,07 |
0,001 |
0,001 |
|
SaO2, %
|
94,03±0,34 |
89,2±0,84 |
85,4±0,96 |
0,005 |
0,001 |
0,001 |
Примечание: статистически значимые различия при p<0,05.
Повышение систолического давления в легочной артерии (СДЛА) отмечалось у 120 (41,7%) человек: нетяжелая ЛГ (СДЛА 40 – 55 мм.рт.ст.) регистрировалась у 101 (35,1%), тяжелая ЛГ (СДЛА > 55 мм.рт.ст) – у 19 (6,6%) человек. В зависимости от спирометрического класса ХОБЛ (GOLD 2013г) уровень СДЛА у исследуемых больных распределился следующим образом: у пациентов со II степенью тяжести средние цифры СДЛА составляли 33,5 ±10,37 мм. рт. ст., с III степенью тяжести – 35,8 ± 10,23 мм. рт. ст., с IV степенью тяжести – 45,7± 9,48 мм. рт. ст. При этом нетяжелая ЛГ и тяжелая ЛГ наблюдались у 5 (4,9%) и 2 (10,5%) пациентов со II степенью тяжести ХОБЛ (GOLD 2013), у 46 (45,5%) и 3 (15,8%) пациентов с III степенью тяжести, у 50 (49,5%) и 14 (73,7%) пациентов с IV степенью тяжести соответственно. Средние спирометрические показатели согласно классификации (GOLD 2013г) в группах больных без ЛГ и нетяжелой ЛГ соответствовали III (тяжелой) степени тяжести: форсированная жизненная ёмкость лёгких (ФЖЕЛ) составила 66,5±1,93% и 61,6±2,31% от должных величин; объём форсированного выдоха за первую секунду (ОФВ1) – 38,7±1,58% и 32,9±2,11% от должных величин, модифицированный индекс Тиффно составил 44,3±1,09 % и 42,6±1,75% соответственно. Бронхиальная обструкция в группе больных с нетяжелой ЛГ была сильнее по сравнению с группой больных без ЛГ (p1-2). В то же время у пациентов с тяжелой ЛГ отмечались более значимые нарушения функции внешнего дыхания по сравнению с пациентами без ЛГ и нетяжелой ЛГ. Так, значительно ниже был показатель ФЖЕЛ, в среднем он составлял 49,7±2,44% от должных величин (p2-3 <0,001, p1-3 <0,001), ОФВ1 соответствовал IV степени тяжести, в среднем составлял 27,2±2,16% от должных величин (p2-3 <0,05, p1-3 <0,001), отношение ОФВ1/ФЖЕЛ - 44,2±2,54 (p2-3 0,23, p1-3 <0,87).
Выраженность одышки по результатам mMRS и оценочного теста CAT у больных без ЛГ составила 3,1±0,03 баллов и 27,1±0,56 баллов, у больных с нетяжелой ЛГ – 3,3±0,06 баллов и 29,5±0,79 баллов, у больных с тяжелой ЛГ – 3,9±0,45 баллов и 33,3±0,59 баллов соответственно. Отмечалось статистически значимое усиление выраженности одышки по мере появления и усиления ЛГ (p<0,05). Выявлены корреляционные взаимосвязи уровня СДЛА с выраженностью одышки по mMRC (r=061, p<0,05), CAT (r=045, p<0,05) и частотой обострений (r=-0,41, p<0,05). Уменьшение дистанции в тесте с 6-минутной ходьбой до 227,32±5,03 м и 174,2±5,81м; увеличение одышки по Боргу 5,6±0,12 баллов и 6,7±0,09 баллов; снижение сатурации крови кислородом после физической нагрузки на 10,2% % и 12,9 % отмечено в группе больных с нетяжелой и тяжелой ЛГ соответственно. В группе больных ХОБЛ без ЛГ пройденное расстояние за 6 минут составило 238,8±3,56 м, одышка по Боргу – 5,36±0,07 баллов, снижение сатурации крови кислородом после физической нагрузки составило 3,8% (табл. 1).
В периферической крови у пациентов исследуемых групп был выявлен умеренный нейтрофильный лейкоцитоз. В группе больных с ЛГ уровень лейкоцитов составлял 11,1±0,52 109/л и статистически значимо превышал таковые больных без ЛГ – 9,2±0,33 х 109/л и больных с нетяжелой ЛГ - 9,9±0,36 х 109/л (p1-2 0,21, p2-3 0,13, p1-3 <0,04). В группе пациентов с тяжелой ЛГ также отмечалось статистически значимое увеличение количества тромбоцитов (p1-2 0,2, p2-3 0,05, p1-3 <0,04) по сравнению с больными без ЛГ и нетяжелой ЛГ (табл. 2). Определение уровня биомаркеров воспаления показало увеличение уровня сывороточного СРБ и фибриногена у пациентов всех групп. При межгрупповом сравнении этих показателей были выявлены статистически значимые различия (p1-2 <0,001, p2-3 <0,001, p1-3 0,001 по СРБ и p1-2 0,05, p2-3 0,001, p1-3 0,006 по фибриногену).
Таблица 2
Биомаркеры воспаления у больных ХОБЛ в зависимости и наличия и степени легочной гипертензии
|
Показатель |
СДЛА <40 мм.рт.ст. n 168 |
СДЛА 40-55 мм.рт.ст. n 101 |
СДЛА >55 мм.рт.ст. n 19 |
p |
||
|
1-2 |
1-3 |
2-3 |
||||
|
Лейкоциты крови, х 109/л |
9,6±4,08 |
9,9±0,36 |
11,1±0,52 |
0,21 |
0,04 |
0,13 |
|
Тромбоциты, х 109/л |
252,9±3,65 |
251,5±5,19 |
273,5±6,3 |
0,20 |
0,44 |
0,04 |
|
СРБ, мг/л |
19,1±0,38 |
24,4±0,56 |
32,3±0,34 |
<0,001 |
0,001 |
<0,001 |
|
фибриноген, г/л |
4,3±0,20 |
4,8±0,23 |
5,5±0,23 |
0,05 |
0,006 |
0,001 |
Примечание: статистически значимые различия при p<0,05
Так, уровень сывороточного СРБ и фибриногена в группе больных без ЛГ составили 19,1±0,38 мг/л и 4,3±0,20 г/л, у больных с нетяжелой ЛГ – 24,4±0,56 мг/л и 4,8±0,23 г/л, и у больных с тяжелой ЛГ – 32,3±0,34 /л и 5,5±0,23 г/л. Изучение корреляционных взаимоотношений выявило тесную прямую взаимосвязь между СДЛА и уровнем СРБ (r = 0,74, p<0,05), СДЛА и уровнем фибриногена (r = 0, 84, p<0,05); уровнем СРБ и фибриногена (r = 0,73, p<0,05) (рис. 1 а, б).
Анализ ROC-кривых для прогнозирования ЛГ показал, что уровень СРБ и фибриногена оказались достоверными признаками нетяжелой и тяжелой ЛГ при ХОБЛ. Площадь под кривой ROC при ХОБЛ с нетяжелой ЛГ для СРБ была равна 0, 884 (p<0,05;95% ДИ 0,839 - 0,930), для фибриногена – 0, 870 (p<0,05;95% ДИ 0,814 - 0,925). При ХОБЛ с тяжелой ЛГ площадь под кривой ROC для СРБ была равна 0, 991 (p<0,05;95% ДИ 0,976- 1,0), для фибриногена 0, 998 (p<0,05;95% ДИ 0,998-1,00) (рис. 2 а, б).
а) 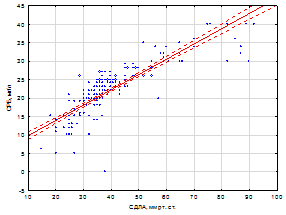 б)
б)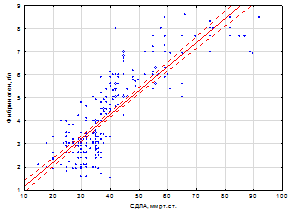
Рис. 1 (а, б). Взаимосвязь между СДЛА и уровнем СРБ, СДЛА и уровнем фибриногена, СРБ и фибриногена
Чувствительность определения СРБ и фибриногена для прогнозирования нетяжелой ЛГ составляла 88% и 80%, а специфичность 80% и 92% соответственно; для прогнозирования тяжелой ЛГ чувствительность определения СРБ и фибриногена составляла по 98%, а специфичность 89% и 98% соответственно.
а) 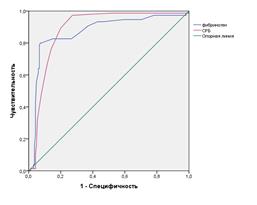 б)
б) 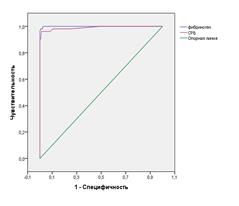
Рис. 2. ROC –кривые определения диагностической ценности определения уровня СРБ и фибриногена у больных ХОБЛ с нетяжелой ЛГ (а) и тяжелой ЛГ (б)
Т.е. диагностическая значимость положительных результатов означала, что в 88 % и 80% случаев уровень СРБ и фибриногена у больных с нетяжелой ЛГ превышал 21,5 мг/л и 4,05 г/л соответственно и в 98 % случаев уровень СРБ и фибриногена у больных с тяжелой ЛГ превышал 23,5 мг/л и 5,2 г/мл.
Обсуждение. По данным литературы частота выявления легочной гипертензии у пациентов с умеренной и тяжелой ХОБЛ колеблется от 25% до 50% [1], при находится в прямой зависимости от степени тяжести ХОБЛ и используемых методов диагностики повышения давления в легочной артерии [1]. Настоящее исследования продемонстрировало повышение СДЛА у 120 (41,7%) пациентов. У большинства больных регистрировалась нетяжелая ЛГ, тяжелая ЛГ встречалась у 6,6% пациентов, полученные результаты согласуются с данными ранее проведенных исследований [1]. Ремоделирование ЛА, сопровождающее развитие ЛГ, встречается не только при поздних стадиях ХОБЛ, но и у больных на ранних этапах заболевания [3]. Так, несмотря на то что тяжелая ЛГ в настоящем исследовании регистрировалась в основном у пациентов с IV спирометрическим классом, в 10,5% случаях она наблюдалась у пациентов со II спирометрическим классом и 15,8% пациентов с III спирометрическим классом ХОБЛ. Нетяжелая ЛГ наблюдалась в половине случаев у пациентов как с III, так и с IV спирометрическим классом ХОБЛ, у пациентов со II спирометрическим классом нетяжелая ЛГ наблюдалась в 4,9% случаев. Наличие ЛГ при ХОБЛ ухудшает газообмен, усиливает одышку, ведет к развитию дисфункции правого желудочка (ПЖ) и периферических отеков [4]. В настоящем исследовании клинические симптомы и признаки, указывающие на наличие легочной гипертензии, выраженность одышки по результатам mMRS, оценочного теста CAT, шкалы Борга, снижение толерантности к физической нагрузке (по результатам функциональных нагрузочных проб), снижение сатурации крови кислородом после физической нагрузки (более 10%) усиливались по мере появления и нарастания тяжести ЛГ. Системное воспаление при ХОБЛ, вероятно, является ключевым фактором, определяющим для развития легочной и системной эндотелиальной дисфункции, хотя точные патофизиологические механизмы неизвестны. Маркерами системного воспаления, которые обычно используются для мониторинга заболевания у пациентов ХОБЛ, являются С-реактивный белок (СРБ), фибриноген, лейкоциты и тромбоциты [2]. В исследованиях показано, что увеличение СрДЛА у пациентов с ХОБЛ, связано с более высоким уровнем сывороточных СРБ и ФНО – α, что увеличивает возможность патогенетической роли системного воспаления в патогенезе легочной гипертензии при ХОБЛ [8].
В настоящем исследовании у пациентов исследуемых групп был выявлен умеренный нейтрофильный лейкоцитоз. У больных с тяжелой ЛГ уровень лейкоцитов статистически значимо превышал таковые у больных без ЛГ и больных с нетяжелой ЛГ. У пациентов с тяжелой ЛГ также отмечалось статистически значимое увеличение количества тромбоцитов по сравнению с больными без ЛГ и нетяжелой ЛГ. Определение биомаркеров воспаления показало увеличение уровня сывороточного СРБ и фибриногена у пациентов всех групп. Наибольший уровень сывороточного СРБ и фибриногена отмечался у больных ХОБЛ с ЛГ, выявлена тесная прямая взаимосвязь СДЛА с содержанием СРБ и фибриногена. Анализ ROC-кривых показал высокую диагностическую ценность определения содержания СБР и фибриногена для прогнозирования нетяжелой и тяжелой ЛГ.
Таким образом, легочная гипертензия у больных ХОБЛ способствует увеличению частоты обострений в течение года, усиливает выраженность одышки, снижает толерантность к физической нагрузке. Определение СРБ и фибриногена обладает высокой чувствительностью и специфичностью при прогнозировании как тяжелой, так и нетяжелой ЛГ у больных ХОБЛ.
Рецензенты:
Фаизова Л.П., д.м.н., профессор кафедры терапии и общей практики с курсом гериатрии ИПО ГБОУ ВПО «Башкирский государственный медицинский университет», г. Уфа;
Фархутдинова Л.М., д.м.н., профессор кафедры терапии и общей практики с курсом гериатрии ИПО ГБОУ ВПО «Башкирский государственный медицинский университет», г. Уфа.
Библиографическая ссылка
Гайнитдинова В.В., Авдеев С.Н., Шарафутдинова Л.А., Аллабердина Д.У. ХРОНИЧЕСКАЯ ОБСТРУКТИВНАЯ БОЛЕЗНЬ ЛЕГКИХ С ЛЕГОЧНОЙ ГИПЕРТЕНЗИЕЙ: ОСОБЕННОСТИ ТЕЧЕНИЯ, СВЯЗЬ С СИСТЕМНЫМ ВОСПАЛЕНИЕМ // Современные проблемы науки и образования. 2015. № 2-1. ;URL: https://science-education.ru/ru/article/view?id=17920 (дата обращения: 10.02.2026).



