Транскраниальная электростимуляция (ТЭС-терапия) представляет собой воздействие электрическим током на мозг через покровы черепа, приводящее к селективной активации структур, относящихся к антиноцицептивной системе ствола мозга [7].
Огромное значение представляют данные, показывающие нейропротекторный, противовоспалительный, антиоксидантный, нейротрофический, антигипоксический эффекты активации δ-опиоидных рецепторов [3].
Учитывая вышесказанное предполагается позитивный эффект воздействия ТЭС-терапии на течение экспериментальной модели ишемического инсульта (ИИ).
Целью нашего исследования является изучение влияния ТЭС-терапии на морфологию очага инфаркта мозга в динамике экспериментального ишемического инсульта.
Материалы и методы. Исследования проведены в лаборатории кафедры общей и клинической патофизиологии. Иммуноферментные исследования (ИФА) проводили на базе ЦНИЛ отдела клинической экспериментальной иммунологии и молекулярной биологии ГБОУ ВПО КубГМУ Минздрава России. Эксперименты проведены на 100 белых нелинейных крысах самцах, средней массой – 200±25 гр. Содержание животных и постановка экспериментов проводилась в соответствии с международными правилами «Guide for the Care and Use of Laboratory Animals». Крысы были разделены на 4 группы: 1 группа – из 20 крыс, контрольная, интактные животные; 2 группа – из 40 крыс, у которых проводилось моделирование экспериментального ишемического инсульта без проведения ТЭС-терапии; 3 группа – из 40 крыс, у которых после моделирования экспериментального ишемического инсульта проводилось 7 сеансов ТЭС-терапии. Все потенциально болезненные вмешательства в проводимых экспериментах, а также эвтаназия осуществлялись под комбинированным инъекционным наркозом: золетил 0,3 мг в/м («Virbac» Франция), ксиланит 0,8 мг в/м (ЗАО «НИТА-ФАРМ», Россия, г. Саратов), атропина сульфат 0,1% раствор – 0.01 мл п/к из расчета на 100 гр. массы тела животного [5,7,8].
Моделирование ИИ осуществляли путем создания у крыс острой локальной церебральной ишемии путем коагуляции правой средней мозговой артерии (ПСМА) [5]. ТЭС-терапию экспериментальным животным из групп №3 осуществляли модифицированным двухпрограммным электростимулятором «ТРАНСАИР-03» (ООО «Центр транскраниальной электростимуляции», г. Санкт-Петербург) в анальгетическом режиме [3]. Эвтаназию крыс выполняли с соблюдением правил проведения работ при использовании экспериментальных животных, путем декапитации под стандартным наркозом [2,4]. Для забора тканей головного мозга крысы из 2 и 3 групп на 1, 3, 7 и 14 выводились из эксперимента по 10 животных. Далее проводили изъятие ГМ. В дальнейшем забранный от половины особей в 1 группе, а в группах 2 и 3 (после эвтаназии на 1 и 3 сутки) ГМ подвергался двухкратной промывке в охлажденном растворе 0,9% хлорида натрия, с последующей его заморозкой и хранением при температуре – 350С. Размер очага церебральной ишемии определяли тетразолиевым методом на макросрезах [6]. Показатель «удельный объем инфаркта мозга» определяли как соотношение объема очага инфаркта мозга к объему всего мозга [1].
Оставшиеся образцы ГМ подвергались фиксации в 10% нейтральном формалине, затем следовало изготовление гистологических микропрепаратов по классической технологии через заливку в парафин и их окрашивание гематоксилином – эозином, по Нисслю, а также гистохимическое исследование по Чиаччио [4].
Статистическую обработку полученных данных осуществляли методами непараметрической статистики с использованием программного обеспечения «Statistika 6.0 for Windows» фирмы «Stat Soft Inc.».
Полученные результаты исследуемых групп после статистической обработки выражали в виде средних значений (M) и ошибки среднего (m). Сравнение выборок проводилось по непараметрическому критерию Манна-Уитни, с установлением уровня значимости *p≤0,05. Величины средних значений в таблицах указаны в границах M±m.
Результаты исследования и их обсуждение. Результаты проведенных морфологических исследований ткани ГМ показали, что как на микропрепаратах, так и на макросрезах полученных от крыс из 1 группы (контрольная), видно строение интактной ткани ГМ.
При изучении срезов ткани мозга крыс 2 группы, сделанных на 1 сутки после моделирования ИИ обнаружено формирование выраженной зоны инфаркта мозга, локализованной преимущественно в неокортексе с захватом небольшого участка каудопутамена, расположенного в зоне кровоснабжения ПСМА. В очаге ишемии наблюдалась гипохромия ядер клеток, что отражало процессы деполимеризации ДНК в некротизированных клетках. Выявлялись признаки перицеллюлярного отека ткани мозга. В центре области ишемии капилляры запустевали и становились незаметными на общем фоне. На периферии очага некроза мозговой ткани развивался клеточный ответ.
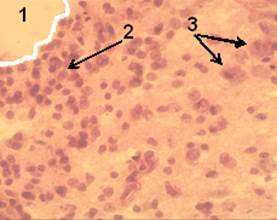
Рисунок 1. Срез ткани мозга крысы группы 2. Ув. об. 40. Окраска гематоксилин-эозин.
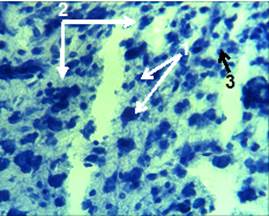
Рисунок 2. Срез ткани мозга крысы группы 2. Ув. об. 40. Окраска по Нисслю.
Все эти признаки свидетельствовали о появлении некроза нейронов, нарушениях кровоснабжения в зоне образующегося инфаркта. Кроме того, имелись признаки развития местной воспалительной реакции.
На 3 сутки после моделирования ИИ четко контурировалась зона инфаркта мозга (рис. 1.1). Значительно увеличилось количество погибших нейронов (рис. 1.3). Усилился перицеллюлярный отек. Появилась выраженная воспалительная клеточная инфильтрация (рис. 1.2).
При окраске по Нисслю на 3 сутки были видны дистрофически измененные нейроны (рис. 1.1), отмечаются признаки нейронофагии (рис. 1.2) и выраженная воспалительная клеточная инфильтрация (рис. 1.3).
На 7 сутки в зоне деструкции ткани мозга и по ее границам отмечалось скопление зернистых шаров. Нейроны в зоне деструкции не обнаруживались. В области самого инфаркта мозга отмечалась выраженная клеточная реакция и разреженность нейропиля. Наблюдалось значительное количество воспалительного клеточного инфильтрата. Хорошо выделялся формирующийся незрелый глиомезодермальный рубец.
На 14 сутки в очаге инфаркта и по его границам отмечалось значительное скопление клеток глии, составляющих основу глиомезодермального рубца. К этому времени еще проходил процесс организации зоны деструкции.
У животных 3 группы на фоне проведения сеансов ТЭС-терапии область формирующегося инфаркта мозга также начинала выявляться через 1 сутки, как и во 2 группе. Однако клеточный ответ и признаки перицеллюлярного отека ткани мозга были менее выражены. В зоне инфаркта мозга наблюдались единичные клетки-тени.
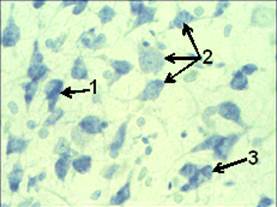
Рисунок 3. Срез ткани мозга крысы группы 3. Ув. об. 40. Окраска по Нисслю.
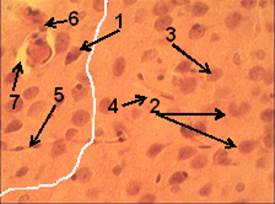
Рисунок 4. Срез ткани мозга крысы группы 3. Ув. об. 40. Окраска гематоксилин-эозин
Отмечалось преобладание гиперхромных дистрофически измененных нейронов (рис. 3.1, рис. 4.1) преимущественно с признаками частичного тигролиза (рис. 3.2), над содержанием клеток-теней (рис. 4.3, рис. 4.2) (по сравнению с животными 2 группы).
Капилляры в центре области ишемии также запустевали (рис. 4.4). По периферии очага ишемии капилляры хорошо прокрашивались (рис. 4.5). Наблюдалось значительно меньше нейтрофилов (рис. 4.3), что связано с менее значительным повреждением нейронов и меньшей выраженностью воспаления.
К 3 суткам, после моделирования ИИ, область инфаркта мозга четко выявлялась. Однако зона деструкции была выражена менее значительно. Количество погибших нейронов было значительно меньше, чем у крыс 2 группы. Нейронов с признаками только частичного тигролиза у некоторых из них было больше. Гиперхромных дистрофически измененных нейронов выявлялось мало. Воспалительная клеточная инфильтрация зоны инфаркта ткани мозга была выражена менее значительно, чем у крыс 2 группы.
На 7 сутки, после моделирования ИИ, нейронов в зоне деструкции ткани мозга не обнаружено. Обращает внимание наличие по периферии области инфаркта мозга значительного количества новообразованных капилляров, прорастающих вглубь зоны деструкции, в отличие от животных 2 группы.
Глиомезодермальный рубец выглядел более сформированным по сравнению с животными 2 группы, при этом не блокировал ход нервных волокон.
На 14 сутки, после моделирования ИИ активно продолжался процесс организации зоны деструкции. По ее периферии формировался глиомезодермальный рубец. Он выглядел более зрелым и гораздо менее плотным по сравнению с животными 2 группы.
Согласно данным литературы завершение процессов формирования очага инфаркта мозга происходит к концу 3 суток [9].
В 1 сутки после моделирования ИИ у крыс 2 группы удельный объем очага инфаркта мозга был достоверно (р≤0,05) больше на 4,2%, чем у животных 3 группы, которым проводили ТЭС-терапию после моделирования ИИ.
На 1 сутки после моделирования ИИ у крыс 3 группы объем очага инфаркта мозга достоверно (р≥0,05) не отличался. Следовательно, проведение сеансов ТЭС-терапии после формирования очага церебральной ишемии, даже в таких жестких условиях как перманентное нарушение мозгового кровотока приводит к достоверному сокращению размеров очага инфаркта мозга, по сравнению с животными, которым ТЭС-терапия не проводилась. Удельный объем очага инфаркта мозга на 3 сутки после моделирования ИИ у крыс 2 группы был достоверно (р≤0,05) больше на 21,6%, чем удельный объема очага инфаркта мозга у крыс 3 группы.
Таким образом, ТЭС-терапия способна оказывать положительное влияние на клеточный состав и процессы организации очага инфаркта мозга, что способно объяснить ее нейропротективный эффект при экспериментальном ишемическом инсульте.
Рецензенты:
Могильная Г.М., д.м.н., профессор, заведующая кафедрой гистологии ГБОУ ВПО «Кубанский государственный медицинский университет Минздрава России», г. Краснодар;
Абушкевич В.Г., д.м.н., профессор кафедры нормальной физиологии ГБОУ ВПО «Кубанский государственный медицинский университет Минздрава России», г. Краснодар.
Библиографическая ссылка
Занин С.А., Каде А.Х., Трофименко А.И., Малышева А.В. ГИСТОЛОГИЧЕСКОЕ ОБОСНОВАНИЕ ЭФФЕКТИВНОСТИ ТЭС-ТЕРАПИИ ПРИ ЭКСПЕРИМЕНТАЛЬНОМ ИШЕМИЧЕСКОМ ИНСУЛЬТЕ // Современные проблемы науки и образования. 2015. № 1-1. ;URL: https://science-education.ru/ru/article/view?id=17839 (дата обращения: 13.12.2025).



