Более подробно этапы формирования и развития андроцея и гинецея рассмотрены у четырех видов – S. vulgaris L., S. josikaea J. Jacq. ex Rchb., S. villosa Vahl подрода Syringa, секции Villosae C.K. Schneid и S. reticulate H. Hara subsp. amurensis (Rupr.) P.S. Green & M.C. Chang из подрода Ligustrina (Rupr.) K. Koch в условиях Иркутска в 1960-е гг. [2-4; 8].
За последние годы исследования по данной тематике единичны: представлено развитие женской генеративной сферы, а также влияние высоких температур на формирование семязачатков сорта‘Mme Florent Stepman’ S. vulgaris L. в условиях Польши [9; 10].
Изучение женской генеративной сферы на всех этапах ее формирования позволяет оценить особенности строения и развития семязачатков и возможные аномалии, которые могут повлиять на формирование полноценных семян.
Цель исследований – изучить эмбриологические особенности строения и развития семязачатков и зародышевых мешков некоторых видов и гибридов Syringa в связи с низкими показателями семенной продуктивности.
Материалы и методы
Объектами исследований являются виды и гибриды Syringa L., подрода Syringa, секции Villosae C.K. Schneid.: S. josikaea J. Jacq. ex Rchb. (сирень венгерская), S. emodi Wall. ex Royle (сирень гималайская), S. wolfii C.K. Schneid. (сирень Вольфа), S. sweginzowii Koehne & Lingelsh. (сирень Звягинцева), S. villosa Vahl (сирень волосистая), S. × prestoniae McKelvey (S. komarowii subsp. reflexa × S. villosa (гибрид Престон)), S. × henryi C.K. Schneid. (S. josikaea × S. villosa (гибрид Генри)) из коллекции сирингария учебного ботанического сада имени профессора А.Г. Генкеля Пермского государственного национального исследовательского университета.
Возраст коллекции сирени составляет в среднем 15 лет. Все растения характеризуются хорошим ростом, развитием и цветением. Под наблюдением находились один-два куста каждого вида и гибрида, имеющие от 21 до 225 соцветий.
Исследования проводились в период с мая по август в 2012–2014 гг. Для цитоэмбриологических исследований фиксировали бутоны на разных стадиях развития (от 1 до 5 мм) и завязи цветков разных стадий раскрывания: раскрывшийся бутон (бутон с щелевидным отверстием), полуоткрытый цветок (цветок с наполовину распустившимися лепестками), открытый цветок (цветок с полностью распустившимися лепестками). Фиксацию проводили в фиксаторе Кларка (спирт 96%, 3 части; ледяная уксусная кислота, 1 часть). Изготовление постоянных препаратов проводилось в лаборатории цитогенетики и генетических ресурсов растений Пермского государственного национального исследовательского университета. Парафинирование материала проводилось с использованием автоматической системы для гистологической обработки тканей Leica TP 1020 карусельного типа. Для изготовления срезов толщиной 8–10 мкм использовался ротационный микротом Leica RM. Окрашивание срезов проводилось гематоксилином по Гейденгайну и методом тройного окрашивания с использованием реактива Шиффа, алцианового синего и гематоксилина Эрлиха [7]. Использовали универсальный мультистейнер LEICA ST 2020. После окрашивания срезы заключали в синтетическую монтирующую среду «БиоМаунт». Всего было изготовлено и проанализировано более 1500 постоянных препаратов. Фотографии с препаратов сделаны с помощью светового микроскопа Olympus B×51 с системой визуализации изображения Olympus DP71 c использованием программы Cell B. Описание и измерения проводились при увеличении 100–1500.
Результаты исследования и их обсуждение
Исследуемые виды и гибриды сирени характеризуются сходным развитием женской генеративной сферы. Тип гинецея – синкарпный. Завязь верхняя, двугнездная, образуется в результате срастания двух плодолистиков. В одной завязи закладывается до четырех семязачатков, но чаще два. Семязачатки анатропные, тенуинуцеллятные. Нуцеллус зрелого семязачатка представлен одним эпидермальным слоем из рано разрушающихся клеток. Семязачаток унитегмальный. Единственный интегумент состоит из 9-12 слоев клеток. Интегументальный тапетум представлен слоем клеток вытянутой таблитчатой формы, дифференцируется в период мегаспорогенеза, окружает весь зародышевый мешок.
В таблице 1 представлены стадии развития семязачатков и зародышевых мешков исследуемых видов и гибридов.
Таблица 1
Стадии развития семязачатков и зародышевых мешков видов и гибридов Syringa
|
Состояние семязачатка |
Развитие зародышевого мешка |
S. josikaea |
S. emodi |
S. wolfii |
S. sweginzowii |
S. villosa
|
S. × prestoniae |
S. × henryi |
|
|
Премейотический период |
|||||||||
|
Прямое положение. Дифференциация интегумента, нуцеллуса |
|
Бутон 4 мм чшл:лп (2:1)* |
Бутон 3 мм чшл:лп (3:1) |
Бутон 3 мм чшл:лп (2:1) |
Бутон 2 мм чшл:лп (3:1) |
Бутон 3 мм чшл:лп (2:1) |
Бутон 4 мм чшл:лп (1:1) |
Бутон 4 мм чшл:лп (1:1) |
|
|
Мейотический период |
|||||||||
|
Анатропное положение. Дифференциация проводящего пучка, интегументального тапетума |
Тетрада мегаспор |
Бутон 4 мм чшл:лп (2:1) |
Бутон 4 мм чшл:лп (2:1) |
Бутон 3 мм чшл:лп (2:1) |
Бутон 3 мм чшл:лп (2:1) |
Бутон 4 мм чшл:лп (1:2) |
Бутон 5 мм чшл:лп (1:2) |
Бутон 4 мм чшл:лп (1:1) |
|
|
Постмейотический период |
|||||||||
|
Дегенерация нуцеллуса
|
|
Бутон 5 мм чшл:лп (1:1) |
Бутон 5 мм чшл:лп (2:1) |
Бутон 4 мм чшл:лп (1:1) |
Бутон 3 мм чшл:лп (2:1) |
Бутон 4 мм чшл:лп (1:2) |
Бутон 5 мм чшл:лп (1:2) |
Бутон 4 мм чшл:лп (1:1) |
|
|
Зародышевый мешок зрелый семиклеточный, восьмиядерный (яйцевой аппарат из 3 клеток, центральная клетка с двумя полярными ядрами, антиподальный комплекс из 3 клеток) |
Бутон 13–14 мм |
Бутон 14–16 мм |
Бутон 11–12 мм |
Бутон 8–9 мм |
Бутон 10–11 мм |
Бутон 14–15 мм |
Бутон 15–16 мм |
||
|
Двойное оплодотворение (разрушенные синергиды) |
Бутон 13–14 мм |
Бутон 14–16 мм |
Открытый цветок
|
Открытый цветок
|
Открытый цветок
|
Открытый цветок
|
Открытый цветок
|
||
*чшл:лп – соотношение длины чашелистиков и лепестков.
Археспориальная клетка одна, закладывается у всех исследуемых видов и гибридов в третьей декаде мая, за исключением S. villosa, у которой этот процесс происходит во второй декаде мая (рис. 1.2). Без отделения париетальных клеток археспориальная клетка увеличивается в размерах и преобразуется в мегаспороцит (рис. 1.3).
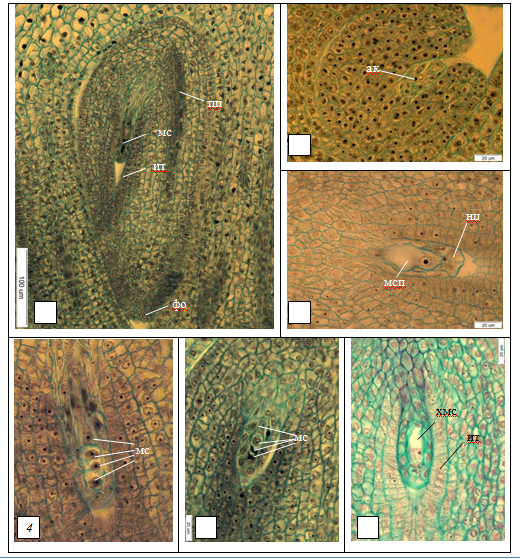
Рис. 1. Строение и развитие семязачатков некоторых видов и гибридов Syringa:
1 – семязачаток S. wolfii, бутон 3 мм (×10); 2 – семязачаток S. villosa, бутон, 3 мм (×1500); 3 – мегаспороцит в семязачатке S. × prestoniae, бутон 5 мм (×1500); 4 – тетрада мегаспор в семязачатке S. emodi, бутон 4 мм (×1500); 5 – тетрада мегаспор в семязачатке S. wolfii , бутон 3 мм (×1500); халазальная мегаспора в семязачатке
S. × henryi, бутон 5 мм (×1500);
пп – проводящий пучок, мс – мегаспора, ит – интегументальный тапетум, ак – археспориальная клетка, мс – мегаспора, хмс – халазальная мегаспора, фо – фуникулярный обтуратор, мсп – мегаспороцит, нц – нуцеллус.
Мегаспороцит претерпевает два последующих деления мейоза, сопровождающихся цитокинезом, в результате чего образуется линейная тетрада мегаспор, не различающихся размерами (рис. 1.4). К этому времени в интегументе из клеток внутренней эпидермы дифференцируется интегументальный тапетум, представленный слоем клеток таблитчатой формы, что присуще всем видам и гибридам, за исключением S. emodi, характеризующегося формированием изодиаметрических клеток.
Начало развития зародышевому мешку даёт халазальная мегаспора (рис. 2. 4, 5, 6). Основная цитоплазма в ней сосредоточена вокруг ядра. Микропилярные мегаспоры дегенерируют и отмирают (рис. 2.5). Халазальная мегаспора увеличивается, вакуолизируется, формируя одноядерный зародышевый мешок (рис. 2. 1, 2). Проводящий пучок состоит из 3–4 слоев удлиненных густоплазменных клеток; у S. emodi и S. × prestoniae дифференцируется по направлению к халазе, у S. wolfii, S. sweginzowii, S. josikaea, S. villosa и S. × henryi проходит через халазу.

Рис. 2. Зародышевые мешки некоторых видов и гибрида Syringa на разных стадиях развития:
1 – одноядерный зародышевый мешок S. villosa, бутон, 5 мм (×1500); 2 – одноядерный зародышевый мешок S. × henryi, бутон 5 мм (×1500); 3 – двуядерный зародышевый мешок S. emodi, бутон 5 мм (×1500); 4 – двуядерный зародышевый мешок S. × henryi, бутон 5 мм (×1500); 5 – четырехъядерный зародышевый мешок S. wolfii , бутон 4 мм (×1500); 6 – четырехъядерный зародышевый мешок S. × prestoniae, бутон 5 мм (×1500);
зм – зародышевый мешок, ит – интегументальный тапетум, нц – нуцеллус.
После первого митотического деления образуется двуядерный зародышевый мешок с полярным расположением ядер (рис. 2. 3, 4). Деление ядер сопровождается образованием центральной вакуоли. У S. josikaea, S. emodi, S. wolfii, S. sweginzowii и S. villosa происходит дегенерация клеток нуцеллуса, преимущественно в микропилярной части. У S. villosa клетки интегументального тапетума деформируются, не имеют четко выраженной формы и сдавливаются в микропилярной части. Зародышевый мешок разрастается в сторону микропиле, при этом длина его превышает ширину в 2–3 раза. После второго митотического деления образуется четырехъядерный зародышевый мешок (рис. 2.5). У S. × prestoniae длина его превышает длину двуядерного зародышевого мешка в два раза; клетки тапетума при этом сдавливаются в микропилярной части (рис. 2.6). Деления ядер происходят синхронно. Цитоплазма в центральной клетке зародышевого мешка находится вокруг полярных ядер, незначительная часть образует постенный слой. Таким образом, центральная часть клетки занята вакуолью. Остатки клеток нуцеллуса встречаются только в халазальной части.
Дальнейшее
развитие зародышевого мешка у исследуемых видов и гибридов сопровождается
интенсивным ростом в длину. У S. josikaea и S. × prestoniae центральная часть более узкая, а халазальная
и микропилярная части расширены (рис. 3. 1,
6). Интегумент
один, включает 9–10 слоев клеток у S. wolfii
и S. villosa; 10–11 слоев клеток – у S. sweginzowii, S. × prestoniae и
S. × henryi; 11–12 слоев клеток у S.
josikaea и S. emodi.
Интегументальный тапетум дифференцируется по всей длине зародышевого мешка. В
центральной и халазальной части клетки тапетума имеют вытянутую таблитчатую
форму, в микропилярной части клетки сужаются. У S. villosa в большинстве случаев клетки интегументального тапетума
деформированы, сдавлены. Микропиле у всех изученных видов и гибридов прямое,
узкое, расположено на одной оси с халазой. В основании фуникулуса имеются
радиально вытянутые эпидермальные клетки, образующие ![]() фуникулярный обтуратор (рис. 3. 1, 5). Клетки обтуратора имеют утолщенные
наружные стенки и плотную цитоплазму.
фуникулярный обтуратор (рис. 3. 1, 5). Клетки обтуратора имеют утолщенные
наружные стенки и плотную цитоплазму.

Рис. 3. Зрелые зародышевые мешки S. josikaea и S. × prestoniae:
S. josikaea: 1 – зародышевый мешок, открытый цветок (×400); 2 – яйцеклетка и синергиды (×1500);
3 – полярные ядра (×1500); 4 – антиподы (×1500); 5 – фуникулярный обтуратор (×1500).
S. × prestoniae: 6 – зародышевый мешок, открытый цветок (×400); 7 – 10 – антиподы (×1500) ;
зм – зародышевый мешок, пя – полярные ядра, с – синергиды, яц – яйцеклетка,
ант – антиподы, м – микропиле, фо – фуникулярный обтуратор.
Восьмиядерный зародышевый мешок наблюдается за два-три дня до распускания цветков; у S. villosa – в третьей декаде мая, у остальных видов и гибридов – в первой декаде июня. Его биполярная структура представлена тремя функционально объединёнными клеточными группами: яйцевой аппарат в микропилярной части, центральная клетка с двумя полярными ядрами, три антиподы в халазальной части.Яйцевой аппарат состоит из яйцеклетки и двух синергид (рис. 3.2). Форма яйцеклетки грушевидная, ядро расположено в апикальной части, а вакуоль – в базальной части. Синергиды расположены рядом с яйцеклеткой, имеют вытянутую форму, суженные к микропиле и расширяющиеся к основанию. Ядра расположены в базальной части, а вакуоли – в апикальной.
Полярных ядер два (рис. 3.3). Они крупные, одинаковой величины, располагаются в средней части зародышевого мешка. Слияние полярных ядер зафиксировано до момента оплодотворения, на стадии бутона (S. wolfii, S. emodi, S. sweginzowii), полуоткрытого цветка (S. josikaea) и открытого цветка (S. villosa, S. × prestoniae, S. × henryi).
Три клетки антипод почти у всех видов и гибридов имеют вытянутую форму, расположены Т-образно (рис. 3.4). Дегенерируют антиподы до оплодотворения: в бутоне (S. josikaea, S. villosa, S. sweginzowii) и даже в открытом цветке (S. wolfii, S. emodi, S. × prestoniae, S. × henryi). Отмечена различная форма и расположение антипод относительно друг друга у S. × prestoniae. (рис. 3. 7–10).
Таким образом, зародышевый мешок у изученных видов и гибридов моноспорический, развивается по Polygonum-типу. Возможным нарушением в развитии зародышевого мешка является деформация интегументального тапетума у S. villosa.
Оплодотворение Syringa двойное, порогамное. Один спермий сливается с яйцеклеткой, формируя зиготу, второй – с центральной клеткой или с вторичным ядром или двумя полярными ядрами, образуя первичную клетку эндосперма. Свидетельством двойного оплодотворения у всех изученных видов и гибридов являются зафиксированные разрушенные синергиды на стадии бутонов и открытых цветков (рис. 4. 1–3). Развитие зародыша наблюдали в зеленых семенах (рис. 4.4).
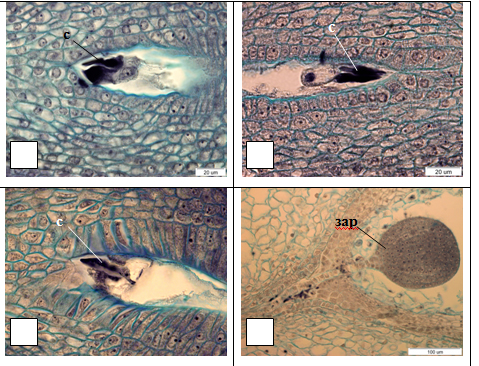
Рис. 4. Разрушенные синергиды в зародышевых мешках и зародыш у некоторых видов и гибридов Syringa:
1 – разрушенные синергиды S. × prestoniae, открытый цветок (×1500); 2 – разрушенные синергиды
S. josikaea, бутон (×1500); 3 – разрушенные синергиды S. sweginzowii, открытый цветок (×1500);
4 – зародыш S. wolfii, зеленые семена (×400);
с – синергида, зар – зародыш.
Исследуемые виды и гибриды Syringa характеризуются достаточно высокими потенциальными возможностями плодообразования [1]. Однако степень реализации репродуктивного потенциала невысока. Изучение плодоцветения Syringa в 2012–2014 гг. показало, что большая часть растений имеет невысокую завязываемость плодов, которая варьирует по годам (от 1 до 48%). Более низкой завязываемостью плодов характеризуются S. sweginzowii и S. wolfii, показатель плодоцветения у которых за все годы наблюдений не превышает 12 и 18% соответственно. Сравнительно большим процентом плодоцветения характеризуется S. emodi – от 28 до 48%. При изоляции соцветий в период цветения 2013–2014 гг. завязались лишь единичные плоды.
Одной из причин неполной реализации репродуктивного потенциала у Syringa может быть эпизодичная посещаемость растений насекомыми в городе.
Выводы1. Для видов и гибридов Syringa характерен синкарпный гинецей. Завязь верхняя, двугнездная, образуется в результате срастания двух плодолистиков. В одной завязи закладываются 1–4 семязачатка, чаще два.
2. Семязачатки анатропные, тенуинуцеллятные и унитегмальные. Нуцеллус представлен одним слоем из рано разрушающихся клеток. Единственный интегумент состоит из 9-12 слоев клеток. Интегументальный тапетум представлен слоем клеток вытянутой таблитчатой формы, дифференцируется в период мегаспорогенеза, окружает весь зародышевый мешок. У всех изученных видов и гибридов в основании фуникулуса имеются радиально вытянутые эпидермальные клетки, образующие фуникулярный обтуратор.
3. Проводящий пучок состоит из 3–4 слоев удлиненных прокамбиальных клеток; у S. emodi и S. × prestoniae дифференцируется по направлению к халазе, у S. wolfii, S. sweginzowii, S. josikaea, S. villosa и S. × henryi проходит через халазу.
4. Археспориальная клетка одна, закладывается у большинства исследованных видов и гибридов в третьей декаде мая, у S. villosa – во второй декаде мая.
5. Тетрада мегаспор линейная, функциональная мегаспора – халазальная.
6. Халазальная мегаспора является материнской клеткой зародышевого мешка. Митотические деления в зародышевом мешке наблюдались у S. sweginzowii в бутонах длиной 3 мм, у S. villosa, S. wolfii и S. × henryi – в бутонах длиной 4 мм, у S. josikaea, S. emodi и S. × prestoniae – в бутонах длиной 5 мм.
7. Зрелый зародышевый мешок вытянутой формы; состоит из яйцеклетки и двух синергид в микропилярной части, центральной клетки с двумя полярными ядрами, трех антипод в халазальной части. У S. josikaea и S. × prestoniae центральная часть более узкая, халазальная и микропилярная расширены. Слияние полярных ядер обнаружено до момента оплодотворения на стадии бутона (S. wolfii, S. emodi, S. sweginzowii), полуоткрытого цветка (S. josikaea) и открытого цветка (S. villosa, S. × prestoniae, S. × henryi).
8. Нарушений в развитии семязачатков и зародышевого мешка, которые могли бы послужить причиной низкой завязываемости плодов у исследованных видов и гибридов, не выявлено.
Рецензенты:Шамров И.И., д.б.н., профессор, заведующий кафедрой ботаники, ФГБОУ ВПО «Российский государственный педагогический университет им. А.И. Герцена», г. Санкт-Петербург;
Круглова Н.Н., д.б.н., профессор, заведующая лабораторией экспериментальной эмбриологии растений, ФГБУН ВПО «Институт биологии Уфимского научного центра РАН», г. Уфа.
Библиографическая ссылка
Жакова С.Н., Новоселова Л.В. ЭМБРИОЛОГИЧЕСКИЕ ОСОБЕННОСТИ СТРОЕНИЯ И РАЗВИТИЯ СЕМЯЗАЧАТКОВ И ЗАРОДЫШЕВЫХ МЕШКОВ НЕКОТОРЫХ ВИДОВ SYRINGA L // Современные проблемы науки и образования. 2014. № 6. ;URL: https://science-education.ru/ru/article/view?id=16959 (дата обращения: 23.02.2026).



