Весьма эффективным и естественным способом утилизации целлюлозосодержащих отходов, основанным на ферментативном разрушении органического субстрата, является микробная биодеградация. Она позволяет решить две основные задачи: создание экономически выгодного процесса производства целевого продукта и утилизацию потенциальных экологических загрязнителей. С помощью ферментов карбогидраз (в частности, целлюлаз и гемицеллюлаз) микроорганизмы расщепляют целлюлозу с образованием простых сахаров, которые затем могут быть конвертированы в различные полезные продукты: спирты, органические и аминокислоты, кормовые компоненты и пр. [2]. Промышленное получение технических ферментов является экологически и экономически выгодным, о чем свидетельствует возрастающий объем продаж технических ферментов на мировом рынке с ежегодной динамикой в 10 %. Одним из важнейших факторов рентабельности процессов биоконверсии лигноцеллюлозных материалов, наряду со стоимостью самого сырья, является эффективность гидролитического действия карбогидразных комплексов, которая, в свою очередь, определяется как свойствами индивидуальных ферментов, так и их взаимодействием в составе этого комплекса, а также стоимостью ферментационного процесса [4,6].
Основными продуцентами промышленных карбогидраз являются мицелиальные грибы рода Trichoderma, обладающие высокой секреторной способностью. Однако грибы рода Penicillium также по праву занимают одно из главных мест в ряду промышленно важных продуцентов, поскольку способны синтезировать ферментные комплексы более сбалансированного состава, кроме того, индивидуальные ферменты обладают более высокой удельной активностью и операционной стабильностью.
Оптимизация ферментационных сред и условий культивирования является важным этапом в разработке схем биоконверсии. Во многом затраты на производство ферментного препарата, получаемого на основе карбогидразного комплекса, определяются стоимостью компонентов ферментационной среды. В ферментационной среде для выращивания наиболее дорогим компонентом является микрокристаллическая целлюлоза (МКЦ), вклад которой в стоимость ферментации составляется около 50 %. Поэтому для получения технических ферментов обычно используют дешевые и доступные целлюлозосодержащие субстраты, являющиеся альтернативой дорогостоящей микрокристаллической целлюлозе (МКЦ) [3,5]. Следует также отметить, что отсутствие целлюлозного компонента (индуктора ферментов) в составе питательной среды существенно снижает продуктивность штаммов. Таким дешевым источником целлюлозы могут являться обрезки пергамента, производимые целлюлозно-бумажными комбинатами. Например, объемы отходов пергамента только Троицкой бумажной фабрики составляют до 1,5 тонн в день [3]. Пергамент – широко распространенный в настоящее время упаковочный материал. Его изготавливают из чистой целлюлозной бумаги-основы. После пергаментации бумага приобретает специфические свойства – становится жиро- и влагонепроницаемой, не разрушается в воде при кипячении и при увлажнении не теряет механической прочности [5].
Целью исследования являлась оптимизация состава питательной среды для культивирования гриба Penicillium verruculosum 221.
Материалы и методы
Штаммы микроорганизмов. P. verruculosum 221 – продуцент карбогидразного комплекса.
Состав сред. Инокуляционная среда (г/л): глюкоза - 15; дрожжевой экстракт - 10; (NH4)2SO4 - 5; KH2PO4 - 15; MgSO4 * 7H2O - 0,3; CaCl2 - 0,23). Режим стерилизации: 1 атм., 1 час.
Среда для культивирования в ферментере содержала (г/л): глюкоза - 40; пшеничные отруби - 10; целлюлозный субстрат - 60; дрожжевой экстракт - 10; (NH4)2SO4 - 5; KH2PO4 - 7; CaCl2 - 0,23; MgSO4 * 7H2O - 0,3; пеногаситель лапрол - 10 капель. Режим стерилизации ферментационной среды: 1 атм., 1 час (2 раза) и 1 раз 0,5 атм., 30 мин. рН среды после стерилизации: 5,3.
Культивирование штамма P. verruculosum. Предварительно выращивался инокулят в 100 мл инокуляционной среды в течение 48 часов при 32 ˚С и 250 об/мин. Штамм гриба культивировали, осуществляли в лабораторных 1-литровых ферментерах на установке «КФ-108» при следующих условиях: 30–32 ºС, рН 4,5 – 5,0, расход воздуха 0,7 л/мин. Поддержание этих параметров, а также скорости подачи подпитывающего раствора, осуществлялось в автоматическом режиме с помощью программного обеспечения «Quadrus@ (Проинтех, Россия). Мицелий для засева ферментеров выращивался на среде ИК в течение 24 часов при 30 ºС. Ферментация проводилась в 2 стадии: культивирование в режиме «batch» до 24 часов, культивирование с подаиткой (20% раствор глюкозы) в режиме «fed-batch» до 144 часов. Отбор проб осуществляли стерильно через специальный пробоотборник.
После окончания культивирования в ферментерах культуральную жидкость центрифугировали при 5000 об/мин 40 мин.
Определение ферментативных активностей. Активности ферментных препаратов по отношению к полисахаридным субстратам: карбоксиметилцеллюлозе (КМЦ), глюкуроноксилану березы (ксилан), микрокристаллической целлюлозе (МКЦ) – рассчитывали по начальным скоростям образования восстанавливающих сахаров (ВС), определяемых методом Шомоди – Нельсона [7]. За единицу активности принимали такое количество фермента, которое приводит к образованию 1 мкмоль ВС в минуту при концентрации субстрата 5 г/л. Активность по n-НФ-β-D-глюкопиранозиду (n-НФГ) определяли, измеряя начальную скорость образования n-нитрофенола. За единицу активности принимали количество фермента, необходимое для образования 1 мкмоль n-нитрофенола в минуту при концентрации субстрата 1 мМ.
Содержание белка в препаратах определяли по методу Лоури, используя в качестве стандарта ферментный препарат P. verruculosum известным содержанием белка (содержание белка составляло 899 мг/г) [1].
Ферментные препараты. Ферментный препарат на основе штамма P. verruculosum 221, выращенного по аналогичной схеме культивирования, был получен ранее с помощью лиофильной сушки культуральной жидкости.
Результаты и обсуждение
Было проведено культивирование штамма P. verruсulosum 221 на питательной среде с добавлением растительного пергамента (обрезки, накапливающиеся при производстве пергамента). Ферментацию проводили в режиме fed-batch, осуществляя дробную подпитку 50 %-ным раствором глюкозы. Длительность культивирования в различных вариантах была разной и зависела от времени достижения культурой максимального уровня синтеза ферментов. В контрольном эксперименте проводили культивирование с использованием МКЦ. На рис. 1 представлены максимальные значения активностей ферментов и содержания внеклеточного белка в КЖ.
При культивировании на пергаменте активности КМЦ-азы, ксиланазы и β-глюкозидазы в этом случае уступали контрольным значениям примерно на 24–27 %. Таким образом, учитывая низкую стоимость, отходы пергаментного производства являются весьма привлекательным субстратом для получения промышленных целлюлаз, так как обеспечивают достаточно высокий (сопоставимый с МКЦ) уровень синтеза целевых ферментов.
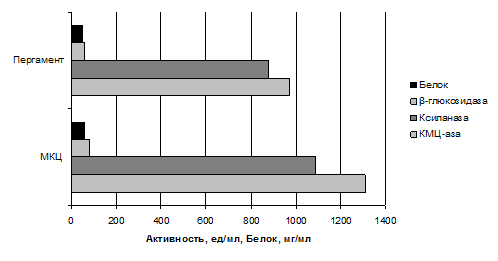
Рисунок 1. Активности ферментов и содержание внеклеточного белка в КЖ, полученной при культивировании штамма P. verruculosum 221 в 1-литровых ферментерах в режиме fed-batch на субстратах: микрокристаллической целлюлозе (МКЦ) и пергаменте
Стоит отметить, что при культивировании на пергаменте наблюдалась значительная задержка начального роста культуры (примерно 4–5 суток) (рис. 2), тогда как при культивировании на МКЦ она составляла 1–2 суток. Предположительно она вызвана наличием веществ, входящих в состав пергамента и подавляющих начальный рост гриба, а также синтез целлюлолитических ферментов. Одной из причин удлиненной лаг-фазы, вероятно, также может служить и повышенная устойчивость пергамента к ферментативному воздействию, обусловленная его надмолекулярной структурой.

Рисунок 2. Динамика накопления ферментов в КЖ при культивировании штамма P. verruсulosum 221 в 1-литровых ферментерах на 6 % пергамента без предобработки
Таким образом, из-за существенного увеличения продолжительности процесса культивирования получение карбогидраз с использованием пергамента, по сравнению с МКЦ, значительно удорожается.
В поисках решения этой проблемы было проведено периодическое культивирование штамма P. verruсulosum 221 в 1-литровых ферментерах на среде, содержащей 6 % пергамента, предварительно предобработанного ферментным препаратом P. verruсulosum 221 в дозах 1 и 2,5 мг белка ферментного препарата на 1 г пергамента (рис. 3 и 4).
Из полученных данных следует, что в результате предобработки пергамента ферментным препаратом в количестве 1 мг белка на 1 г субстрата лаг-фаза составила примерно 3 суток (рис. 3). Максимальные активности основных ферментов в КЖ были достигнуты на 120 часов культивирования и составили: КМЦ-аза – 780 ед/мл, ксиланаза – 163, β-глюкозидаза – 33 ед/мл, общее количество внеклеточного белка – 21,4 мг/мл.

Рисунок 3. Динамика накопления ферментов в КЖ при культивировании штамма P. verruculosum 221 в 1-литровых ферментерах с предварительной обработкой пергамента ферментным препаратом 221 (1 мг белка на 1 г субстрата)
При увеличении дозы ферментного препарата до 2,5 мг белка на 1 г субстрата (рис. 4) лаг-фаза составила примерно 2 суток, что примерно на 2 суток короче по сравнению с вариантом без предобработки. Максимальные активности основных ферментов в КЖ были получены также на 120 часов культивирования и составили: КМЦ-аза – 686 ед/мл, ксиланаза – 591 ед/мл, β-глюкозидаза – 31 ед/мл, общее количество внеклеточного белка – 21 мг/мл.

Рисунок 4. Динамика накопления ферментов в КЖ при культивировании штамма P. verruculosum 221 в 1-литровых ферментерах с предварительной обработкой пергамента ферментным препаратом 221 (2,5 мг белка на 1 г субстрата)
В целом, максимумы значений активностей ферментов и количество внеклеточного белка в КЖ, полученной при культивировании с предобработкой, в среднем на 25 % уступают таковым, полученным при культивировании без предобработки, однако эти потери могут быть компенсированы сокращением времени ферментации, так как максимальные значения активностей ферментов наблюдаются уже на 120 часов культивирования.
Заключение
В ходе проведения исследования была показана принципиальная возможность использования пергамента в качестве альтернативного МКЦ субстрата карбогидраз без существенного снижения уровня биосинтеза ферментов, продуцируемых грибом P. verruculosum 221. Устойчивость пергамента к микробной деструкции обусловливает увеличение продолжительности лаг-фазы и, следовательно, процесса биосинтеза ферментов в целом. Поэтому была разработана технология ферментативной предобработки пергамента, которая позволила значительно сократить лаг-период роста культуры и ускорить процесс культивирования продуцента почти в 2 раза.
Исследование выполнено при поддержке МОН РФ в рамках проекта RFMEFI62114X0002. В работе использовано оборудование и ресурсы ЦКП «Промышленные биотехнологии» ИНБИ РАН.
Рецензенты:
Попов В.О., д.х.н., профессор, директор института. ФГБУН Институт биохимии им. А.Н. Баха РАН, г. Москва;
Савицкий А.П., д.х.н., профессор. ФГБУН Институт биохимии им. А.Н. Баха РАН, г. Москва.
Библиографическая ссылка
Осипов Д.О., Немашкалов В.А., Кошелев А.В., Мерзлов Д.А., Короткова О.Г., Мерзлов Д.А. ОТХОДЫ ПЕРГАМЕНТНОГО ПРОИЗВОДСТВА, КАК СУБСТРАТ ДЛЯ ПОЛУЧЕНИЯ ФЕРМЕНТНОГО КОМПЛЕКСА КАРБОГИДРАЗ PENICILLIUM VERRUCULOSUM // Современные проблемы науки и образования. 2014. № 6. ;URL: https://science-education.ru/ru/article/view?id=16915 (дата обращения: 19.02.2026).



