В настоящее время известно достаточно большое количество природных и синтетических α-гидрокси-β-аминоалкиларенов, обладающих выраженной биологической активностью, а также применяющихся для лечения различных заболеваний [6, 7]. Ранее нами был описан синтез и свойства оригинальных и весьма перспективных потенциальных лекарственных препаратов α-гидрокси-β-диалкиламиноалкил- и α-гидрокси-β-диалкиламиноциклоалкилбензойных кислот [2], представленных на рис. 1. Эти соединения содержат фармакофорный фрагмент замещенных α-гидрокси-β-аминоалкиларенов, который по структуре близок к природным катехоламинам, что обуславливает их потенциальный фармакологический профиль как средств, регулирующих работу ЦНС. В нашем случае, наблюдалось наличие анксиолитической (транквилизирующей) активности, превышающей активность известного препарата Мебикар в сочетании с отсутствием седативного эффекта, что характерно для группы «дневных транквилизаторов».
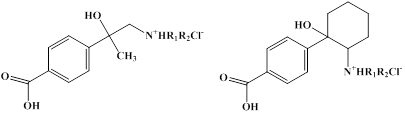
![]()
![]() R1R2 = ;
R1R2 = ;
R1R2 = .
Рис. 1. α-Гидрокси-β-диалкиламиноалкил-и α-гидрокси-β-диалкиламиноциклоалкилбензойные кислоты
Целью настоящей работы являлся синтез структурных аналогов указанных α-гидрокси-β-диалкиламиноалкилбензойных кислот. Одним из подходов к синтезу таких аналогов может являться модификация этих соединений по гидрокси-группе, например, за счет введения различных фенилкарбонилоксильных фрагментов. Такая модификация, очевидно, должна приводить к изменению биодоступности потенциальных лекарственных молекул. Кроме того, возможно изменение и фармакодинамических свойств [1].
В настоящей работе приведены результаты изучения реакции О-ацилирования (бензоилирования) α-гидрокси-β-диалкиламиноалкилбензойных кислот серией хлорангидридов п-замещенных бензойных кислот.
Синтез исходных α-гидрокси-β-диалкиламиноалкилбензойных кислот был осуществлен на основе 4-изопропенилбензойной кислоты [5], которую подвергали окислению раствором надуксусной кислоты в хлороформе при комнатной температуре [3], после чего осуществлялся аминолиз полученной 4-(2-метил-2-оксиранил)бензойной кислоты в присутствии вторичных аминов [2, 3].
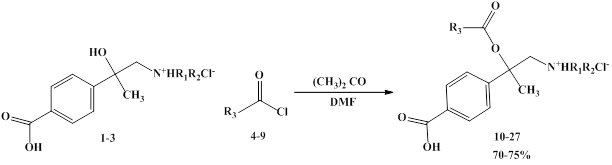
Синтез модифицированных α-гидрокси-β-диалкиламиноалкилбензойных кислот осуществляли из соответствующих кислот 1-3, представленных на схеме 1, с использованием реакции О-ацилирования (бензоилирования). В качестве ацилирующих реагентов были выбраны хлорангидриды ароматических карбоновых кислот (4-9).
R1 = C2H5–; R2 = C2H5– ;
![]()
![]() R1R2 = ;
R1R2 = ;
R1R2 = ;
R3 = C6H5–; n-CH3C6H4 –; n-C2H5C6H4– ; n-ClC6H4 –; n-NO2C6H4 –; n-AdC6H4–.
Схема 1. Синтез α-фенилкарбонилокси-β-диалкиламиноалкилбензойных кислот (10-27)
В литературе известно, что реакции такого типа не требуют жестких условий и протекают с хорошим выходом [4], но результаты эксперимента показали, что осуществление данного процесса при комнатной температуре в течение длительного времени при перемешивании не приводит к положительным результатам. Отсутствие протекания реакции, вероятно, связано с объемными препятствиями заместителей в окружении гидрокси-группы в соединениях 1-3. Таким образом, нами были предложены более жесткие условия протекания реакции.
Реакция О-ацилирования проводилась при нагревании и постепенном введении растворов аминоспиртов 1-3 в смеси растворителей сухого ацетона и N,N-диметилформамида (DMF) к растворам избытка хлорангидридов 4-9. При этом аминоэфиры 10-27 образовывались в виде гидрохлоридов с выходами 70-75%.
В результате исследования удалось создать такие условия реакции, которые обеспечивали селективное протекание реакции О-ацилирования до соединений 10-27. Продукты представляли собой коричневые кристаллические вещества, в основном гигроскопичные.
Нами были изучены факторы, которые влияют на образование целевых продуктов, а именно: мольное соотношение и порядок введения реагентов, время протекания и температура реакции. Наилучшие условия протекания реакции О-ацилирования представлены в таблице 1.
Таблица 1
Условия проведения реакции
|
Температура реакции, 0С |
Растворители |
Соотношение реагентов |
Время реак- ции, ч |
|
56-66 |
Ацетон / DMF = 1:1 |
п-R-С6Н4СОСl / субстрат (1-3) = 1:3 |
25 |
Как известно, реакции данного типа протекают в сухом ацетоне [4]. Однако исходные α-гидрокси-β-диалкиламиноалкилбензойной кислоты 1-3 в сухом ацетоне оказались практически нерастворимы. В связи с этим, в качестве растворителя была выбрана смесь ацетона и DMF в соотношении 1:1. Результаты эксперимента показали, что данное соотношение растворителей является оптимальным для того, что бы вести синтез при полном растворении исходных соединений.
Следующим этапом определения условий реакции О-ацилирования было изучение соотношения реагентов. Наилучшим соотношением реагентов аминоспирт 1-3 / хлорангидрид 4-9 оказалось 1:3, так как исходные α-гидрокси-β-диалкиламиноалкилбензойные кислоты содержат малореакционную третичную гидрокси-группу.
В таблице 2 представлена зависимость конверсии от времени протекания реакции. Показано, что полная конверсия α-гидрокси-β-диалкиламиноалкилбензойных кислот 1-3 наблюдалась при проведении реакции в течение 25 ч при температуре кипения растворителей.
Таблица 2
Зависимость конверсии от времени реакции
|
Время реакции, ч |
5 |
10 |
15 |
20 |
25 |
|
Конверсия, % |
23,7 |
47,5 |
71,2 |
95 |
100 |
*Условия: [аминоспирт]0 = 0,1 моль/л; [п-R-C6H5COCl]0 = 0,825 моль/л; температура – 56 0С; растворитель – (CH3)2CO / DMF
В результате работы была разработана методика выделения целевых продуктов из реакционной смеси. Для этого полученный после отгонки растворителей под вакуумом сухой остаток обрабатывали ацетоном, а нерастворившийся при этом осадок отфильтровывали. Далее ацетоновый экстракт и нерастворившийся осадок анализировали. С помощью ИК-спектроскопии и тонкослойной хроматографии было доказано, что нерастворившаяся часть относится к исходным кислотам 1-3, а в ацетоновом экстракте содержатся продукты реакции. Так, в ИК-спектре аминоэфира 10 наблюдаются сильные полосы поглощения валентных колебаний карбонильной группы, относящейся к сложному эфиру, при 1690 см-1 и 1200 см-1, валентные колебания NH+ гидрохлорида в области 2560 см-1. Дальнейшее выделение соответствующих аминоэфиров 10-27 осуществляли с помощью отгонки ацетона до кристаллизации продукта.
Так же строение синтезированных соединений подтверждали методом 1H ЯМР спектроскопии. В 1H ЯМР спектрах синтезированных соединений наблюдали четыре дуплета в области 7,00-8,00 м.д., относящиеся к двум ароматическим системам и отсутствие сигнала для протона гидрокси-группы в области 6,30-6,40 м.д., которая характерна для исходных кислот 1-3.
В настоящее время совместно с кафедрой фармакологии Ярославской государственной медицинской академии (г. Ярославль) проводятся фармакологические исследования in vivo для ряда синтезированных в данной работе соединений.
В заключение следует отметить, что в данной работе с использованием реакции О-ацилирования α-гидрокси-β-диалкиламиноалкилбензойных кислот синтезирована серия новых α-фенилкарбонилокси-β-диалкиламиноалкилбензойных кислот с выходом 70-75 %, которые могут обладать анксиолитической активностью. При этом реакция осуществлялась при соотношении п-R-С6Н4СОСl/субстрат, равном 3/1, в смеси растворителей ацетон / N,N-диметилформамид при соотношении, равном 1/1. При изучении влияния температуры было установлено, что указанная реакция О-ацилирования протекает в заметной степени только при кипячении реакционной смеси, а полная конверсия исходных α-гидрокси-β-диалкиламиноалкилбензойных кислот в указанной системе наблюдается при времени реакции 25 ч. Кроме этого, разработаны индивидуальные методики выделения новых α-фенилкарбонилокси-β-диалкиламиноалкилбензойных кислот, а их строение доказано с помощью ИК и ЯМР1Н спектроскопии.
Экспериментальная часть
В настоящем разделе представлены типичная методика и аналитические данные для некоторых синтезированных соединений.
1-(2-(4-Карбоксифенил)-2-фенилкарбонилоксипропил)морфолин-1-иум хлорид (10). К раствору 0,33 г (2,34 ммоль) хлористого бензоила в 4,00 мл сухом ацетоне порциями добавляют раствор 0,23 г (0,76 ммоль) 1-(2-(4-карбоксифенил)-2-гидроксипропил)морфолин-1-иум хлорида в смеси растворителей 4,00 мл сухого ацетона и 4,00 мл N,N-диметилформамид. Реакционную массу кипятят в течение 25 часов. После удаления растворителя под вакуумом получают 0,68 г (71,42 %) 1-(2-(4-карбоксифенил)-2-фенилкарбонилоксипропил)морфолин-1-иум хлорида (10). Т. пл. 90-101 oС; Rf = 0,71 (AcOH / н-гексан / толуол / ацетон = 0,1/ 1 / 1 / 0,5); ИК, ν, см-1: 2564,36 (NH4+), 1716,80 (С=O), 1691,42 (C=O), 1201,23 (C-O-C), 1618,76 (C6H4); 1Н ЯМР, δ, м.д. (300 МГц, DMSO-d6): 12,90 (с., 1Н); 10,10 (с., 1Н); 7,93 (д., 2Н, J=9,0 Гц); 7,76 (т., 1Н, J=9,0 Гц); 7,67 (т., 2Н, J=9,0 Гц); 7,55 (д., 2Н, J=8,8 Гц); 7,35 (д., 2Н, J=8,8 Гц); 4,10…3,69 (м., 4Н); 3,66…3,25 (м., 4Н); 3,15 (м., 2Н); 1,60 (с., 3Н).
1-(2-(4-Карбоксифенил)-2-фенилкарбонилоксипропил)пирролидин-1-иум хлорид (16). Выход 71,90 %. Т.пл. 97 – 100 oС; Rf = 0,70 (AcOH / н-гексан / толуол / ацетон = 0,1/ 1 / 1 / 0,5); ИК, ν, см-1: 2760,44 (NHR3+), 1722,14 (С=O), 1687,67 (C=O), 1205,20 (C-O-C), 1613,64 (C6H4); 1Н ЯМР, δ, м.д. (300 МГц, DMSO-d6): 12,90 (с., 1Н); 10,10 (с., 1Н); 7,96 (д., 2Н, J=9,0 Гц); 7,85 (т., 1Н, J=9,0 Гц); 7,44 (т., 2Н, J=9,0 Гц); 7,59 (д., 2Н, J=8,8 Гц); 7,30 (д., 2Н, J=8,8 Гц); 3,65 (м., 2Н); 3,24 (м., 4Н); 1,73(м., 4Н); 1,05 (с., 3Н).
1-(2-(4-Карбоксифенил)-2-фенилкарбонилоксипропил)диэтиламмониум-1-иум хлорид (22). Выход 70,10 %. Т. пл. 100-103 oС; Rf = 0,71 (AcOH / н-гексан / толуол / ацетон = 0,1/ 1 / 1 / 0,5); ИК, ν, см-1: 2569,66 (NH4+), 1720,80 (С=O), 1689,87 (C=O), 1206,53 (C-O-C), 1618,78 (C6H4); 1Н ЯМР, δ, м.д. (300 МГц, DMSO-d6): 12,90 (с., 1Н); 10,10 (с., 1Н); 7,96 (д., 2Н, J=9,0 Гц); 7,80 (т., 1Н, J=9,0 Гц); 7,33 (т., 2Н, J=9,0 Гц); 7,55 (д., 2Н, J=8,8 Гц); 7,38 (д., 2Н, J=8,8 Гц); 3,40 (м., 2Н); 3,10 (м., 2Н); 2,90 (м., 2Н); 1,60 (м.,3Н), 1,30 (м., 3Н); 1,09 (м., 3Н).
Настоящая работа выполнена при финансовой поддержке МОН РФ. Задание № 2014/259 на выполнение государственных работ в сфере научной деятельности в рамках базовой части государственного задания.
Рецензенты:
Герасимова Н.П., д.х.н., доцент, профессор кафедры химической технологии органических веществ ФГБОУ ВПО «Ярославский государственный технический университет», г. Ярославль;
Кофанов Е.Р., д.х.н., профессор, профессор кафедры органической химии ФГБОУ ВПО «Ярославский государственный технический университет», г. Ярославль.
Библиографическая ссылка
Камкина Н.В., Красников С.В. МОДИФИКАЦИЯ α-ГИДРОКСИ-β-ДИАЛКИЛАМИНОАЛКИЛБЕНЗОЙНЫХ КИСЛОТ В СИНТЕЗЕ НОВЫХ АНКСИОЛИТИКОВ // Современные проблемы науки и образования. 2014. № 6. ;URL: https://science-education.ru/ru/article/view?id=16518 (дата обращения: 23.02.2026).



