Из года в год растет интерес к фототерапии при профилактике и лечении ряда заболеваний. Наиболее часто в фототерапии применяют низкоинтенсивное излучение лазеров и светодиодных ламп [3, 6]. Альтернативой является источник белого света, излучение которого модулируется с помощью светофильтров [7]. Предлагаемый нами подход основан на использовании преобразованного солнечного света (ПСС), получаемого при помощи светофильтров с включением полупроводниковых нанокристаллов или квантовых точек (КТ), преобразующих УФ-компоненту солнечного спектра в свет оранжево-красного диапазона (λmax=626 нм). В литературе имеются лишь единичные упоминания об использовании преобразованного таким образом солнечного света для биомодуляции функций животных организмов, в частности при фотостимуляции репаративных процессов [5]. Целью данной работы было исследовать влияние оранжево-красной компоненты (λmax=626 нм) в спектре преобразованного модельного солнечного света на жизнеспособность клеток млекопитающих в условиях in vitro.
Материал и методы исследования
В качестве фотолюминофоров были взяты полупроводниковые флуоресцентные нанокристаллы CdSe/CdS (квантовые точки, КТ) размером 5-7 нм (НТИЦ «Нанотех-Дубна»). Спектры возбуждения и эмиссии КТ получали на спектрофлуориметре Cary Eclipse (Varian, США). Энергетическая освещённость световых потоков измерялась пиранометром CMP-3 (Kipp & Zonen, Нидеpланды). Облучение клеток с помощью лабораторного осветителя ЛОС-1 (Россия) с ксеноновой лампой OSRAM XBO150 (мощность 150 Вт), излучение которой в видимом диапазоне и в УФ- диапазоне спектра близко к спектру излучения Солнца, падающего на поверхность Земли (группа СС). Светопреобразующие экраны были изготовлены из пластин полиметилфенилсилоксана (ПФМС) толщиной 0,5 мм, с включением 0,1% квантовых точек CdSe/CdS, получаемый при этом световой поток называли преобразованным солнечным светом (группа ПСС). В качестве контроля использовали такие же пластины ПМФС без включения квантовых точек, которые поглощали свет, в том числе в УФ-диапазоне в той же мере, как и светопреобразующие экраны (группа CC-УФ). Расчетные данные по дозам облучения при использовании различных режимов облучения приведены в таблице 1. Нагрев среды культивирования во время проведения эксперимента не превышал 0,1ºC.
Таблица 1. Расчет экспозиционной дозы облучения при различных режимах.
|
Продолжительность облучения (сек) |
Группа СС (Дж/см2) |
Группа СС-УФ (Дж/см2) |
Группа ПСС (Дж/см2) |
|
2 |
0,3 |
0,051 |
0,051 |
|
50 |
6,5 |
1,1 |
1,1 |
|
150 |
19 |
3,2 |
3,3 |
|
600 |
77 |
12,8 |
13,3 |
|
1200 |
154 |
25,6 |
26,6 |
|
1800 |
231 |
38,4 |
39,9 |
Исследование in vitro проводили с использованием фибробластов линии 3Т3 clone NIH и эпителиальных клеток линии HEp-2 из коллекции клеточных культур Института Биофизики Клетки РАН, а также клеток роговицы глаза кролика линии SIRC (Коллекция культур клеток позвоночных). Клетки линии HEp-2 и SIRC культивировали в среде ДМЕМ/F12 (1:1) с добавлением 10% эмбриональной телячьей сыворотки (ЭТС; FBS HyClone) и 100 Ед/мл пенициллин/стрептомицина в атмосфере 5% СO2. Фибробласты культивировали в среде ДМЕМ, содержащей 10% ЭТС. Клетки высевали на поверхность 96-луночных планшетов с плотностью 20 тыс.кл/см2 и через 12 часов проводили облучение. Число параллельных экспериментов составляло не менее трех.
Определение жизнеспособности клеток проводили через сутки после облучения на микроскопе Axiovert 200 (Карл Цейс, Германия) с использованием окрашивания клеток набором L-7007 LIVE/DEAD BacLight Bacterial Viability Kit (Invitrogen), в который входят два флуоресцентных красителя: SYTO 9 и иодид пропидия. Исследование метаболической активности клеток проводили с использованием МТТ-теста по методике, опубликованной ранее [1]. Обработку результатов проводили с использованием критерия Стьюдента, статистически значимыми считали различия при p<0,05.
Результаты исследования
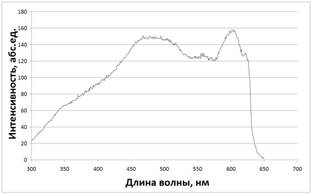
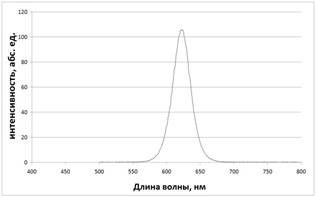
Спектры возбуждения и эмиссии растворов квантовых точек измеряли в диапазоне длин волн от 300 до 800 нм (Рис. 1).
|
|
|
|
Рисунок 1. Спектры возбуждения (А) и эмиссии (Б) квантовых точек CdSe/CdS в полиметилфенилсилоксане (ПФМС). |
|
Для КТ характерна широкая полоса возбуждения флуоресценции, простирающаяся от УФ (300 нм) до красной области оптического спектра, и узкая симметричная полоса эмиссии в области 580-660 нм. Это позволяет получать люминесцентное излучение в оранжево-красном диапазоне при возбуждении не только ультрафиолетом, но и светом в видимой области спектра [2].
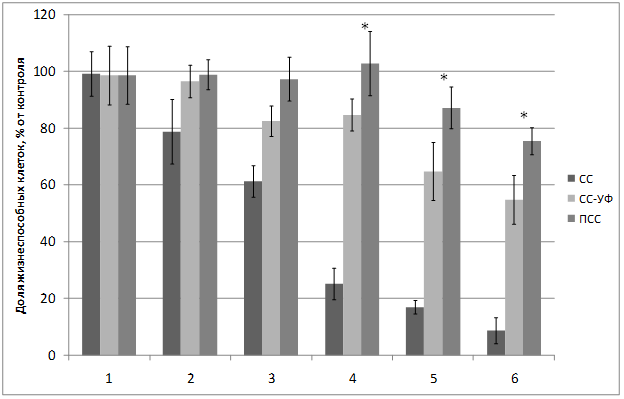
Проведенное исследование воздействия светового потока на жизнеспособность культуры фибробластов линии NIH 3Т3 показало, что воздействие света ксеноновой лампы (группа СС) приводит к зависимому от дозы облучения фотоповреждению клеток (Рис.2).
|
|
|
Рисунок 2. Жизнеспособность фибробластов 3T3 clone NIH при различных временах облучения: 1) 2 сек; 2) 50 сек; 3) 150 сек; 4) 600 сек; 5) 1200 сек; 6) 1800 сек. *-достоверные различия с ПСС с СС-УФ (p ≤ 0,05; t-test). M±SEM. |
При дозах облучения 0,3-19 Дж/см2 не наблюдается значимого различия в защитном действии материалов, отрезающих УФ-компоненту (СС-УФ), и материалов с квантовыми точками (ПСС). Однако, при повышении дозы облучения с 77 Дж/см2 до 231 Дж/см2 материалы, отрезающие УФ-компоненту, не справляются с защитой клеток, в то время как материалы с добавлением КТ полностью защищают клетки, оказывая даже незначительное стимулирующее воздействие по сравнению с интактным контролем, принятым за 100% (p ≤ 0,05). Эти данные показывают, что воздействие небольшой по интенсивности люминесцентной компоненты света оранжево-красного диапазона приводит к стимуляции внутриклеточных процессов, что приводит к повышению жизнеспособности клеток. Эти данные подтверждают гипотезу о биостимулирующем воздействии красного света [4].
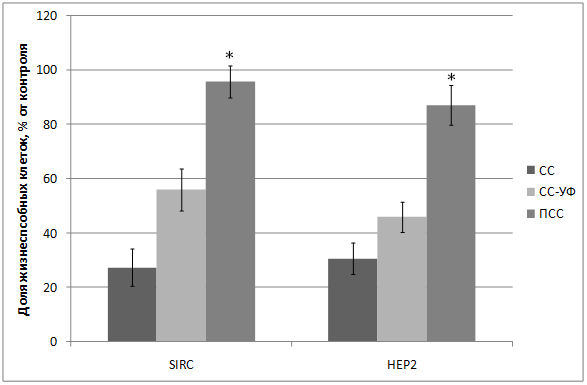
Протекторный эффект от повреждающего действия солнечного света также был показан и на других типах клеток: эпителиальных клетках линии HEp2 и клетках роговицы глаза кролика SIRC (рис. 3).
|
|
|
Рисунок 3. Жизнеспособность клеток линий HEp2 и SIRC (1800 сек облучения): 1) СС - 231 Дж/см2; 2) СС-УФ – 38,4 Дж/см2; 3) ПСС – 39,9 Дж/см2. *-достоверные различия с ПСС с СС-УФ (p ≤ 0,05; t-test). M±SEM. |
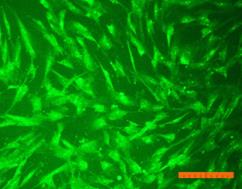
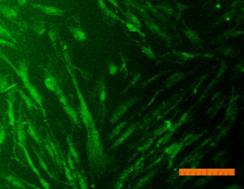
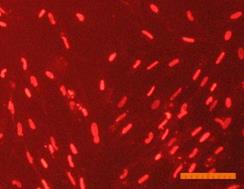
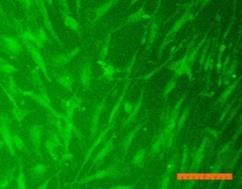
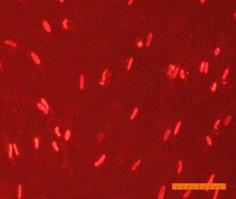
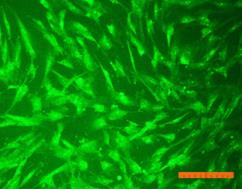
Внешний вид клеток, облученных солнечным светом в присутствии и в отсутствие фильтров, представлен на рис. 4. Флуоресцентный краситель SYTO 9 окрашивает все клетки в зеленый цвет, иодид пропидия окрашивает ядра погибших клеток в красный цвет, что позволяет подсчитать процент гибели клеток под воздействием облучения.
|
Контроль |
|||
|
А |
|
В |
|
|
СС |
|||
|
А |
|
В |
|
|
СС-УФ |
|||
|
А |
|
В |
|
|
ПСС |
|||
|
А |
|
В |
|
|
Рисунок 4. Внешний вид фибробластов линии 3T3 clone NIH. Флуоресцентное окрашивание SYTO 9 (А) и иодидом пропидия (В). Линейка 100 мкм 1) СС - 231 Дж/см2; 2) СС-УФ – 38,4 Дж/см2; 3) ПСС – 39,9 Дж/см2. |
|||
Исследование показало, что максимальная гибель клеток (89%) наблюдается при воздействии света ксеноновой лампы (группа СС). При использовании экрана, отрезающего УФ-компоненту, количество мертвых клеток снижается до 36% (группа СС-УФ). При облучении преобразованным светом с дополнительной люминесцентной компонентой (группа ПСС) количество мертвых клеток такое же, как и в контроле (6% и 3% соответственно).
Вывод
Проведенное нами исследование показало, что наличие даже небольшой по интенсивности дополнительной люминесцентной компоненты (λмакс=626нм) в спектре солнечного света приводит к стимуляции внутриклеточных процессов и возможному повышению регенераторных возможностей организма. Светопреобразующие материалы позволяют использовать солнечный спектр для возбуждения квантовых точек и формирования дополнительной люминесцентной компоненты с λмакс=626нм, таким образом можно говорить о возможности применения данных материалов в новой технологии фототерапии, являющейся альтернативой использованию лазеров и светодиодов.
Спектроскопические измерения выполнялись при поддержках стипендии Президента (СП-6350.2013.4) и гранта РФФИ (14-44-03672). Определение жизнеспособности и метаболической активности клеток проводили при поддержке РНФ (14-25-00055).
Рецензенты:
Гапеев А.Б., д.ф-м.н., проф., ФГБУН Институт биофизики клетки РАН, г.Пущино;
Белова Н.А., д.б.н., ФГБУН Институт теоретической и экспериментальной биофизики РАН, г.Пущино.
Библиографическая ссылка
Фахранурова Л.И., Селезнева И.И., Маноxин А.А., Давыдова Г.А., Храмов Р.Н. ИССЛЕДОВАНИЕ ВЛИЯНИЯ ОРАНЖЕВО-КРАСНОЙ КОМПОНЕНТЫ (λMAX=626 НМ) В СПЕКТРЕ МОДЕЛЬНОГО СОЛНЕЧНОГО СВЕТА НА ЖИЗНЕСПОСОБНОСТЬ КЛЕТОК МЛЕКОПИТАЮЩИХ В УСЛОВИЯХ IN VITRO // Современные проблемы науки и образования. 2014. № 6. ;URL: https://science-education.ru/ru/article/view?id=16163 (дата обращения: 07.01.2026).




 А
А
 Б
Б