В условиях промышленной технологии производства животноводческой продукции при высокой концентрации поголовья создаются предпосылки значительной контаминации основных элементов внешней среды микроорганизмами и продуктами метаболизма. Воздушная среда, являясь основным элементом среды обитания, оказывает существенное влияние на организм животных. Установлена прямая зависимость между состоянием здоровья животных и уровнем бактериального загрязнения окружающей среды. Проблема защиты воздушной среды, а также объектов помещения от загрязнения является весьма актуальной [2].
Высокая бактериальная обсемененность воздушной среды и других объектов животноводческих помещений является типичной для промышленных комплексов, и она небезразлична для организма животного.
Воздушная среда за счет образования в ней аэрозолей, содержащих микроорганизмы, служит основным фактором передачи и распространения аэрогенных инфекций. Необходимо имеет в виду также и сенсибилизирующее действие сапрофитной микрофлоры на животных и обслуживающий персонал. Не только живые микроорганизмы, но и убитые, обладая антигенными свойствам, могут индуцировать различные иммунопатологии и иммунные депрессии. Установлена повышенная чувствительность лошадей к антигенам микроорганизмов различной таксономической принадлежности [8].
Микробная контаминация воздуха зависит от типа помещения, вида и возраста животных, принятой технологии, микроклимата и комплекса санитарно-гигиенических мероприятий [9].
Биологический аэрозоль воздушной среды является динамической системой, в которой происходят количественные и качественные изменения. Не исключается возможность изменчивости экологических свойств отдельных представителей флоры, включая их инактивацию. Критерием оценки санитарно-гигиеническое состояние воздушной среды помещений и открытого пространств (загрязненности воздуха) являются не только показатели количественного и качественного состава микроорганизмов различных физиологических групп, но и специфика их временных, пространственных и экологических характеристик. Микрофлора воздуха закрытых помещений разнообразна и многочисленна. Среди микроорганизмов обитатели респираторного, желудочно-кишечного и урогенитального трактов, в том числе патогенные виды, попадающие в воздух с поверхности тела животного и с продуктами метаболизма. Основной источник загрязнения воздуха патогенными видами являются животные – бактерионосители. Уровень микробного загрязнения зависит, главным образом, от концентрации поголовья, особенностей технологического обеспечения процессов, санитарного состояния помещений. Самоочищения воздуха закрытых помещений не происходит, а регулярные проветривания (воздухообмен) и влажная уборка значительно снижают обсеменённость [4].
Объективная и всесторонняя оценка значимости биологического аэрозоля среды обитания может быть проведена при использовании наиболее эффективных устройств и методов обнаружения и анализа бактериальных вирусных и других биотических аэрозолей [1, 7].
Целью нашей работы явилась оценка эффективности существующих устройств и методов исследования количественного и качественного состава микроорганизмов в воздухе закрытых помещений.
В задачу наших исследований входило:
-
испытание разработанного нами улавливателя микроорганизмов [7] и прибора для санитарно-бактериологического анализа воздуха [1];
-
изыскание альтернативного метода посева улавливающей жидкости для определения коли-индекса и общей бактериальной обсемененности.
Материалы и методы. Исследования проводились в условиях хозяйства ОАО «Урожайное» Новоалександровского района Ставропольского края, а также в ФГБУ «Ставропольская межобластная ветеринарная лаборатория» в 2013-2014 г. Объектом для исследования служили помещения родильного отделения, содержания новорожденных телят, помещения для доращивания ремонтного молодняка и содержания дойных коров на промышленном комплексе.
Оценку бактериологической обсемененности воздушной среды проводили ежемесячно в течении всего периода наблюдений, учитывая количество животных в помещении. Забор проб воздуха в каждом помещении осуществляли несколько раз в течение суток: в утренние часы, различных точках помещений по вертикали и горизонтали когда животные находились в относительном покое (до осуществления дачи кормов, замены подстилки, выпаивание телят) и в дневное время, когда осуществлялись данные мероприятия. Учитывали конструктивные особенности помещений и концентрацию поголовья.
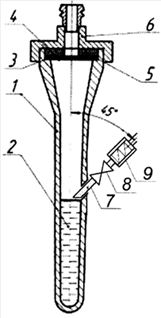
Для отбора проб воздуха использовали аспиратор модель 822 в режиме 10 л/мин 2минуты к которому с помощью вакуумного шланга присоединялись поочередно прибор для санитарно-бактериологического анализа воздуха (А.с .№ 927855) и улавливатель микроорганизмов (Патент № 141343) с 2 мл физиологического раствора в качестве улавливающей жидкости. На рисунках 1 и 2 представлены схемы устройств, которые использовались в процессе исследований.
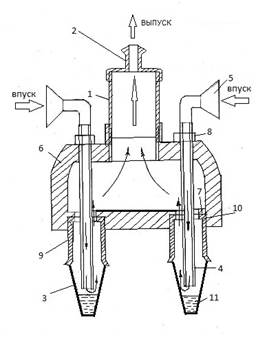
Условные обозначения: воздуховод 1; соединительная трубка 2; накопительные емкости 3; воздухозаборные трубки 4; воронки 5; распределительная камера 6; отверстия 7; гайки8 и 9; уплотнительные прокладки 10; улавливающая жидкость 11.
Рис. 1 Схема прибора для санитарно-бактериологического анализа воздуха
 .
.
Условные обозначения: конусообразную емкость 1 улавливающей жидкостью 2 ,сетка 3, фильтр 4, уплотнительное кольцо 5, крышка 6 , трубка 7 с отверстием, клапан 8, завихритель9.
Рис. 2 Схема Улавливателя микроорганизмов
Стерилизацию приборов проводили в сухожаровом шкафу при 800С в течение 30 минут и завернутыми в пергаментную бумагу.
После взятия проб воздуха улавливающую жидкость подвергалась дальнейшему анализу. Количество микроорганизмов определяли путем высева улавливающей жидкости на питательные среды. По количеству воздуха, пропущенные через аспиратор и количеству выросших колоний (КОЕ) определяли концентрация микроорганизмов в определенном объеме воздуха [5].
Для проведения сравнительных испытаний посевов использовалась улавливающая жидкость, отобранная в боксе III-IV группы патогенности и без посторонней контаминации воздушной среды. Пробы воздуха отбирались в количестве 30 проб в течении дня, так же использовались аналитические жидкости схожие с улавливающей, но искусственно контаминироваными непатогенными микроорганизмами(Staphylococcus epidermidis, Klebsiella pneumoniae) в концентрации 1*100, 1*1000, 1*10000 м.т./гр.
Определение общего количества микроорганизмов (микробного числа) по ГОСТ проводили глубинным посевом с использованием мясопептонного агара на чашки Петри. Коли-индекса определяли поверхностным посевом улавливающей жидкости на твердые среды Левина и Эндо [3].
Экспериментальный посев улавливающей жидкости на подложки RIDA COUNT Total и RIDA COUNT E.coli/Coliform [10] поводился непосредственно в условиях хозяйства.
Подсчет выросших колоний (КОЕ) осуществлялся после термостатирования при 37оС в течении 24-48 часов с последующим расчетом количества микроорганизмов, содержащихся в 1 л воздуха.
Результаты исследований
Предлагаемые технические средства могут использоваться для определения бактериальной обсемененности воздуха животноводческих помещений.
Высокая эффективность в процессе исследований обусловлена тем, что в устройствах совмещены все известные методы осаждения пылевых частиц, а конструктивные особенности позволяют проводить различные варианты анализа воздуха.
Таблица 1
Данные определения концентрации микроорганизмов в корпусах молочного комплекса
|
№ корпуса |
Кол – во животных гол. |
Кратность отбора проб\ кол-во проб воздуха |
Кол-во микроорганизмов в 1 м3 |
Коли-индекс воздуха м.т./л., M±m |
|
родильное отделение |
122 |
2/10 |
1,8*105 |
6,71±0,7 |
|
корпус доращивания ремонтного молодняка |
158 |
2/10 |
2,1*105 |
8,03±0,22 |
|
и корпус с дойными коровами |
193 |
2/10 |
2,3*105 |
7,88±0,31 |
|
корпусе для содержания телят |
139 |
2/10 |
1,9*105 |
7,09±0,25 |
Из данных приведённых а таблице 1 видно, что показатели общей бактериальной обсеменённости в помещениях где содержатся животные колеблется от 1,8*105-2,3*105 при норме обсемененности воздуха для беспривязного содержания коров не более-7*104.
По данным А.Ф. Дмитриева [5], показатель коли-индекса наиболее объективно отражает картину санитарного состояния исследуемого помещения. При изучении материалов таблицы можно сделать вывод, что содержание микроорганизмов группы кишечной палочки напрямую зависит от общего количества микроорганизмов и количества животных в помещении.
Таблица 2
Сравнительная оценка методов определения общего микробного числа
|
Критерии оценки |
Методы посева |
|
|
альтернативный метод |
стандартный метод |
|
|
Точность метода(%) |
98,3 |
94,8 |
|
Чувствительность метода (%) |
96,5 |
94,3 |
|
Специфичность метода (%) |
97,1 |
93,9 |
|
Затраты времени (мин) |
3 мин |
20 мин |
Таблица 3
Сравнительная оценка методов определения коли-индекса
|
Критерии оценки |
Методы посева |
|
|
альтернативный метод |
стандартный метод |
|
|
Точность метода(%) |
97,9 |
90,6 |
|
Чувствительность метода (%) |
95,9 |
89,3 |
|
Специфичность метода (%) |
96,8 |
88,7 |
|
Затраты времени (мин) |
3 мин |
10 мин |
Критерии оценок представленных в таблицах 2 и 3 показывают, что методы определения общего микробного числа и коли-индекса отличаются более высокими показаниями точности, чувствительности и специфичности, а так же более низкими затратами времени на проведение исследования.

Рис. 3. Отбор проб и исследования воздуха в условиях хозяйства
Выводы
1. Натурные испытания прибора для санитарно-бактериологического анализа воздуха помещений показали возможность его использования для оценки санитарно-гигиенического состояния воздушной среды. Улавливание микроорганизмов достигается использованием съемных циклонов с улавливающей жидкостью. Возможна стационарная установка прибора внутри помещения, в виду наличия стерильных съемных циклонов и осуществления стерилизации на месте его установки путем фломбирования.
2. Улавливатель микроорганизмов имеет преимущество, которое заключается в том, что он обладает высокой эффективностью улавливания микроорганизмов различных физиологических групп (бактерии, вирусы, грибы и др.) с последующей концентрацией микробиоты. Полное отделение микроорганизмов от газовой фазы и концентрация их в жидкой среде, с сохранением жизнеспособности, объясняется тем, что в одном «устройстве для улавливания микроорганизмов» совмещены все известные методы: инерционный, седиментационный и фильтрационный, а его конструктивные особенности позволяют проводить различные варианты микробиологического анализа воздуха, в том числе определение общего количества микроорганизмов и коли-титра. В зависимости от целей и задач исследований устройство обеспечивают выполнение различных вариантов микробиологического анализа воздуха, включая микроскопию, постановку биологической пробы, серологических реакций, посев на элективные среды, культуру клеток и др.
3. Предлагаемый метод посева улавливающей жидкости на подложки RIDA COUNT по сравнению с классическим (стандартным) оказался более точен, менее трудоемок, уменьшает затраты времени, расходных материалов и используемого оборудования.
Рецензенты:
Николаенко В. Н., д.в.н., профессор гл. научный сотрудник лаборатории инфекционных, незаразных болезней и патологии обмена отдела ветеринарной медицины ГНУ «Ставропольский научный институт животноводства и кормопроизводства» РАСХН, г. Ставрополь.
Ожередова Н.А., д.в.н., сотрудник кафедры эпизоотологии и микробиологии ФГБОУ ВПО «Ставропольский государственный аграрный университет», г. Ставрополь.
Библиографическая ссылка
Сытник Д.А., Дмитриев А.Ф. ОЦЕНКА ВЕТЕРИНАРНО-САНИТАРНОГО РЕЖИМА НА ЖИВОТНОВОДЧЕСКИХ ФЕРМАХ ПРОМЫШЛЕННОГО ТИПА // Современные проблемы науки и образования. 2014. № 6. ;URL: https://science-education.ru/ru/article/view?id=15803 (дата обращения: 13.01.2026).



