Актуальность проблемы
Миома матки самая распространенная опухоль у женщин, (25-30%), после 30 лет, причём ещё в репродуктивном возрасте. Основными проявлениями этого доброкачественного онкологического заболевания являются маточное кровотечение (меноррагия, метроррагия, менометроррагия), болевой синдром в области таза, обструкция мочеточника и другие симптомы [1]. Общеизвестно, что среди широкого спектра гинекологической патологии миома матки занимает ведущие позиции, частота выявления миомы матки колеблется от 10 до 35% у женщин репродуктивного возраста и возрастает до 43 — 48% у женщин в пременопаузальном возрасте [3].
Основными методами лечения миомы матки является консервативная миомэктомия, гистерэктомия и гормонотерапия. Каждый из этих методов имеет свои преимущества и недостатки. К основным отрицательным моментам можно отнести высокую частоту рецидивов и потерю репродуктивной функции после гистерэктомии [4]. Одним из методов остановки маточного кровотечения является перевязка внутренних подвздошных артерий, но операция не обеспечивает долговременный гемостаз, так как из-за быстрого развития коллатералей возникает рецидив кровотечения [6].
Наличие сочетанной соматической патологии может являться противопоказанием к медикаментозному, оперативному вмешательству, эндотрахеальному наркозу [1]. Некоторые пациентки категорически отказываются от операции из-за боязни операции, нереализованной репродуктивной функции.
В настоящее время эмболизация маточных артерий является методом выбора для остановки кровотечений из половых путей при неоперабельных образованиях матки и для предоперационной деваскуляризации сосудистых опухолей и артериовенозных аномалий с целью облегчения их хирургического удаления и снижения кровопотери [2].
Приоритет использования ЭМА при лейомиоме матки принадлежит французским исследователям. В 1995 году J.Ravina с соавт. представили работу, в которой эта методика использовалась до операции с целью уменьшения кровопотери во время последующей миомэктомии. Наблюдаемый клинический эффект позволил им применить ЭМА как альтернативу хирургическому лечению в начале у больных с крайне высоким операционным риском, а в последствии и у остальных категорий пациенток.
Эмболизация миомы матки (фибромиомы, лейомиомы, фиброида) - минимально инвазивная процедура и серьёзная альтернатива традиционной хирургической тактике. При ЭМА происходит прекращение тока крови к опухолевому узлу с развитием его инфаркта и дегенерации. В последующем, миома значительно уменьшается, её симптомы, в виде болей и кровотечений из матки, исчезают или значительно уменьшаются [9].
Большие преимущества ЭМА заключаются в следующем: ЭМА не затрагивает матку, матка, маточные трубы сохраняются нетронутыми, ЭМА сохраняет способность к деторождению, осложнения встречаются в десятки раз ниже, чем при хирургических операциях [8].
Минимальная травматичность высокоэффективных современных малоинвазивных рентгеноэндоваскулярных вмешательств позволяет уменьшить количество осложнений [7]. В Республике Татарстан ЭМА применяется с 2003 года на базе РКБ № 2 г. Казани (гл. врач Абашев А.Р.), и в настоящий момент мы располагаем опытом проведения более 511 технически успешных ЭМА. Наш опыт позволяет изучить результаты ЭМА, проанализировать технику и осложнения, встречающиеся во время проведения вмешательства и в послеоперационном периоде, а также оптимизировать методику проведения эмболизации маточных артерий у больных с миомами матки и маточными кровотечениями.
Материалы и методы
Обследовано 80 женщин с миомой матки, возраст которых колебался от 20 до 59 лет (в среднем 39,5 ± 0,5 года). Клинические проявления заболевания в виде меноррагии имели место у 71 женщин (88,7%), метроррагия – у 2 женщин (2,5%), более чем у половины пациенток (54,3%) наблюдался болевой синдром. Нарушения функции смежных органов выявлены у 14 женщин (17,5%). Длительность заболевания к моменту операции до 3х лет – 9 женщин (11,3%), от 3 до 5 лет у 51 женщин (63,7%), более 5 лет у 20 женщин (25%). Постгеморрагическая железодефицитная анемия наблюдалась у 76 женщин (92,5%). Средние размеры матки составляли (94,9 ± 5,0 мм) и не превышали 12 недель беременности. Интрамурально-субмукозная форма миомы матки диагностирована у 48 женщин (60,0 ± 5,3%). Субмукозная форма миомы матки наблюдалась у 23 женщин (28,7 ± 4,8%), множественная миома матки с интрамурально-субсерозной локализацией миоматозных узлов определена у 9 женщин (11,3 ± 3,5%).
Сопутствующие экстрагенитальные заболевания отмечены у 41 женщины (51,3 ± 5,6%). При этом гипертоническая болезнь встречалась у 5 женщин (6,3 ± 1,7%) – среди них у 2 больных в сочетании с сахарным диабетом и у 4 больных в сочетании с ожирением.
Всем больным проведено клинико-лабораторное исследование, включая коагулограмму, биохимическое исследование крови и онкомаркеров СА-125 и СА-19-9 по общепринятой методике.
Проводилось ультразвуковое исследование органов малого таза с доплерографией, позволяющее уточнить количество, структуру, локализацию миоматозных узлов. В послеоперционном периоде ультразвуковой мониторинг с целью оценки эффекта регрессии размеров миоматозных узлов.
У всех женщин были исключены острые воспалительные процессы женских половых органов.
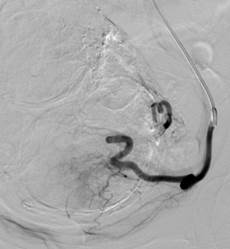
Рентгенэндоваскулярная эмболизация маточных артерий осуществлялись в операционной, оснащенной ангиографической дигитальной цифровой установкой с плоским детектором Axiom Artis dTA (Siemens Medical System). Эмболизация маточных артерий проводиться под местной анестезией чрезкатеторной пункцией правой общей бедренной артерии в асептических условиях по методике Сельдингера и является совершенно безболезненным. По проводнику устанавливается интродюссер 5F. Для эмболизации маточных артерий стали применять модифицированную технику катетеризации маточных артерий без применения катетера Cobra для контралатерального проведения проводника в подвздошную артерию. По усовершенствованной методике катетер Roberts на гидрофильном проводнике одномоментно устанавливается в контралатеральную подвздошную артерию. После селективной установки катетера Roberts в маточную артерию, вводятся эмболизационные частицы. В качестве эмболизирующего вещества были использованы частицы эмбосферы из акрилового полимера (BioSphere Medical), имеющие размеры от 300-700 мкм. Размеры частиц позволяют полностью закрыть сосуды, окружающие и питающие миоматозные узлы. Все операции завершались контрольной артериографией таза. (Рис.1).

Рис. 1. Одномоментная катетеризация катетером Roberts контралатеральной маточной артерии
Статистическая обработка проводилась с использованием пакета программ SPSS (v.13.0). Данные представлены в виде M±m, где M - средне арифметическое значение, m – стандартная ошибка среднего значения. Отличия полагались статистически значимыми при P < 0,05.
Результаты исследования
Ангиографическое исследование выполнено всем обследованным женщинам (80 больных). При этом маточные артерии были идентифицированы как одна из ветвей передних порций внутренней подвздошной артерии в 140 из160 катетеризированных артерий. Средний диаметр маточных артерий составил 4,3 ± 0,9 мм. Образование единого ствола маточной и запирательной или маточной и пузырной артерии было выявлено в 20 клинических наблюдениях.
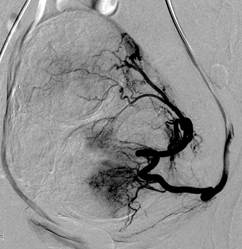
На всех ангиограммах были изменения, соответствующие доброкачественной гиперваскуляризации, при этом основные ветви маточных артерий образовывали округлую гиперваскулярную зону извитых сосудов без обрывов мелких артериальных ветвей, экстравазации и артериовенозного шунтировании. Накопление рентгеноконтрастного вещества в капиллярной фазе было неравномерным и усиленным, отражающим выраженный сосудистый компонент миоматозного узла и миометрия. Несмотря на это, значимого контрастирования дренирующих вен не отмечалось. Двухсторонняя катетеризация и эмболизация маточных артерий выполнялась 79 пациенткам (98,7%), тогда как у одной больной (1,3%) эмболизация маточной артерии осуществлялась на стороне преимущественного кровоснабжения (при этом диаметр контралатеральной маточной артерии был менее 1,5 мм).
Применение микрокатетера для суперселективной эмболизации маточных артерий потребовалась в 1 случае при высоком ответвлении влагалищной ветви от маточной артерии слева у одной пациентки (1,2%).
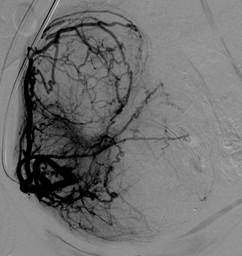
На ангиограммах артерий малого таза и маточных артерий, выполненных непосредственно во время операции до эмболизации и после эмболизации (Рис.2, А-Г), определялась полная деваскуляризация зоны патологического очага и признаки остановки (стаз контраста) кровотока по маточным артериям у 79 из 80 пациенток (98,7 ± 1,7%), тогда как у 1 пациентки (1,2 ± 0,7%) на контрольной ангиографии было выявлено частичное сохранение васкуляризации матки по маточным артериям, что потребовало повторного установления катетера и дополнительного введения эмболизирующих препаратов.
|
|
|
|
А. Ангиограмма левой маточной артерии пациентки Б., 46 лет. Множественная миома тела матки с субмукозным ростом одного из узлов с геморрагическим синдромом. Анемия 1ст. «Смешанный» тип кровоснабжения миоматозного узла. |
Б. Ангиограмма левой маточной артерии после ЭМА (жидкий эмболизат) Признаки остановки (стаза) контраста, с ретроградным выбросом контраста обеих маточных артерий после процедуры ЭМА. |
|
|
|
|
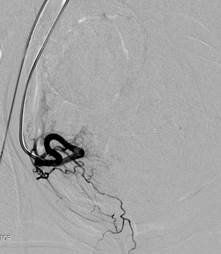
В. Ангиограмма правой маточной артерии |
Г. Ангиограмма правой маточной артерии после ЭМА (жидкий эмболизат). Признаки остановки (стаза) контраста, с ретроградным выбросом контраста обеих маточных артерий после процедуры ЭМА. |
Рис. 2.Этапы эмболизации маточных артерий
После эмболизации маточных артерий в раннем послеоперационном периоде у всех женщин наблюдались проявления постэмболизационного синдрома: отмечались боли внизу живота тянущего или схваткообразного характера. Наиболее выраженная интенсивность болей наблюдалась через 8 ± 0,4 часов после окончания внутрисосудистого вмешательства. Боли иррадиировали в область крестца и нижних конечностей у 12 женщин (20 ± 4,5%). Всем женщинам назначались ненаркотические анальгетики с первых суток послеоперационного периода. Наркотические анальгетики применялись по требованию только в первые 12 часов после вмешательства.
Повышение температуры тела после постоянной эмболизации маточных артерий наблюдалось у всех больных, однако более чем у половины пациенток (58,0 ± 3,9%) наблюдалась в пределах до 37,0 ºС. Продолжительность и выраженность гипертермии находились в непосредственной зависимости от размеров миоматозного узла.
Нормализация ритма и объема менструальной кровопотери и продолжительности менструации установлена у большинства больных (85,0 ± 4,6%) уже на шестом месяце наблюдения, и к концу первого года наблюдения количество женщин с восстановленным циклом и объемом менструальной кровопотери составило 76 (93,3 ± 3,2%).
Послеоперационный эффект окклюзии маточных артерий проявился трансервикальной экспульсией субмукозного миоматозного узла у 1 из 23 женщин с данной локализацией миомы матки в среднем 3,3 ± 0,4 месяца после внутрисосудистого вмешательства.
Ультразвуковое исследование органов малого таза выполнялось до и после эмболизации маточных артерий в качестве основного метода динамического наблюдения за структурой, размерами матки и миоматозных узлов.
До проведения эмболизации маточных артерий миоматозные узлы имели обычную однородную гипоэхогенную структуру с четкими ровными контурами. После эмболизации маточных артерий в раннем послеоперационном периоде (5-й день) эхографические показатели матки и миоматозных узлов достоверно не изменялись, показатели эхографической структуры миометрия были интактны. При этом средние размеры миоматозных узлов до операции составили 58,6 ± 9,6 мм., после операции 34,9±7,2 мм. через 12 месяцев. При этом средний объем миоматозных узлов соответсвенно до и после операции составили 148,1 ± 76,0 см3 и 54,2 ± 4,6 см3. Нормализация размеров матки и эхоструктуры миометрия во всех отделах матки при ультразвуковом мониторинге отмечено через 3 месяца после операции. Двусторонняя селективная эмболизация маточных артерии представляет собой эффективный метод лечения миомы матки. Преимуществами данного метода являются отсутствие общего наркоза и связанного с ним риска анестезиологических осложнений, минимальный объем кровопотери и риск осложнений, уменьшение риска рецидивов в перспективе.
Рецензенты:
Насруллаев М.Н., д.м.н., профессор кафедры хирургии ГБОУ ДПО КГМА Минздрава России, г. Казань;
Акберов Р.Ф., д.м.н., профессор кафедры лучевой диагностики ГБОУ ДПО КГМА Минздрава России, г. Казань.
Библиографическая ссылка
Шарафутдинов Б.М. ОЦЕНКА РЕЗУЛЬТАТОВ ЭМБОЛИЗАЦИИ МАТОЧНЫХ АРТЕРИЙ У БОЛЬНЫХ С МИОМАМИ МАТКИ И МАТОЧНЫМИ КРОВОТЕЧЕНИЯМИ ПО МОДИФИЦИРОВАННОЙ ТЕХНИКЕ // Современные проблемы науки и образования. 2014. № 6. ;URL: https://science-education.ru/ru/article/view?id=15701 (дата обращения: 23.02.2026).