В настоящее время наблюдается увеличение количества случаев употребления натрия оксибутирата и его прекурсоров, как одного из «клубных наркотиков» [9;10], наряду с психотропными препаратами амфетаминового ряда. Рост немедицинского употребления натрия оксибутирата на территории РФ, и в частности Омской области, отмечается в основном с 2010 года [3;4]. Применение гамма-гидроксимасляной кислоты (натрия оксибутирата) и её прекурсоров (бутиролактона) с целью получения наркотического опьянения в токсических дозах вызывает угнетение ЦНС, кому и апноэ, что без своевременной квалифицированной помощи может привести к летальному исходу. Неспецифическая картина отравления депримирующими и психотропными средствами требует лабораторного подтверждения диагноза. Нами ранее была разработана методика спектрофотометрического определения натрия оксибутирата в водных растворах, основанная на гидроксамовой реакции. Данная методика отличается экспрессностью, экономичностью и доступностью реактивов и оборудования, не требует концентрирования объекта и применима в диапазоне концентраций 0,1-0,6 мг/мл [1].
Изучение литературных источников показало, что при поступлении в токсической дозе натрия оксибутират выделяется с мочой в неизменном виде в количество около 1% от принятой дозы и соответствует интервалу 0,1-1,6 мг/мл [7;8].Таким образом, разработанная нами методика обнаружения гамма-гидроксимасляной кислоты и её прекурсоров в растворах может быть применима для определения натрия оксибутирата в моче людей, находящихся в состоянии острого отравления.
При анализе литературных данных выявлено, что состав мочи человека в норме и в состоянии шока различного генеза может значительно варьироваться. Наблюдаются олиго- и анурия, липидурия, возможно появление таких компонентов, как желчные пигменты (уробилин, билирубин), белки и продукты их распада, клеточные элементы, гемоглобин, слизь и др. Современными высокочувствительными инструментальными методами исследования в моче возможно обнаружить около 3000 химических веществ (метаболиты естественных, лекарственных, токсических веществ и т.п.) [5; 6]. В данном исследовании устанавливается возможность применения спектрофотометрической методики определения натрия оксибутирата в нативной моче лиц, находящихся в состоянии острого отравления (токсического шока).
Цель исследования – апробация спектрофотометрического экспресс-метода качественного и количественного определения натрия оксибутирата на моче пациентов с подозрением на отравление натрия оксибутиратом.
Материалы и методы эксперимента
Исследуемые образцы мочи были получены от трёх пациентов Отделения острых отравлений БУЗОО «Городская клиническая больница скорой медицинской помощи №1», мужского пола, 22-25 лет, находящихся в бессознательном состоянии с подозрением на отравление натрия оксибутиратом.
Реактивы: 50%-ный раствор кислоты серной, 1М раствор гидроксиламина гидрохлорида, 20%-ный раствор натрия гидроксида, кислота хлористоводородная концентрированная, 15%-ныйраствор железа (III) хлорида.
Оборудование:центрифугаОПН-3, спектрофотометр-2000.
Оценка физических свойств мочи проводилась в соответствии с методикой, предоставленнойклинико-диагностической лабораторией БУЗОО «Городская клиническая больница скорой медицинской помощи №1».
Методика пробоподготовки: в чистые сухие химические стаканы помещали образцы мочи по 5,0 мл, добавляли 0,5 мл 50%-ного раствора кислоты серной и 1,0 г кристаллического натрия сульфата, перемешивали в течение 5 мин, затем жидкость центрифугировали в течение 2 мин при 1500 об/мин; надосадочную жидкость помещали в чистую сухую делительную воронку и проводили трёхкратную экстракцию хлороформом порциями по 2,5 мл в течение 3 мин; хлороформные извлечения объединяли и упаривали на песчаной бане при температуре 55°С.
Методика определения: в чистые сухие пробирки помещали по 1,0 мл исследуемых образцов, к каждой пробе добавляли 0,5 мл 50%-ного раствора кислоты серной (до рН=1-2), выдерживали 5 мин при 20°С; добавляли 0,5 мл 1М раствора гидроксиламина гидрохлорида, 2,5 мл 20%-ного раствора натрия гидроксида (до рН=12-13) и выдерживали 30 мин при 20°С; добавляли 0,5 мл кислоты хлористоводородной концентрированной (до рН=1-2) и 0,5 мл 15%-ного раствора железа (III) хлорида, тщательно перемешивали в течение 10 мин.В случае развития розово-фиолетовой окраски проводили спектрофотометрирование при длине волны 520±2 нм в кюветах с толщиной слоя 1 см. Раствор сравнения: к 5,0 мл воды очищенной добавляли 0,5 мл 15%-ного раствора железа (III) хлорида и тщательно перемешивали.
Результаты эксперимента и их обсуждение
Образцы мочи пациентов №1 и №2 были насыщенно-жёлтого цвета с коричневатым оттенком, со стойкой пеной белого цвета. Образец мочи пациента №3 был жёлто-коричневого цвета, со стойкой пеной светло-жёлтого цвета. Образцы мочи от всех трёх пациентов имели выраженную опалесценцию. Данные результаты указывают на присутствие таких патологических компонентов, как белки и продукты их распада, желчные пигменты, липиды и др.
При проведении спектрофотометрической методики в отсутствии пробоподготовки во всех трёх образцах мочи развивалась насыщенная малиновая окраска, значительно превышающая максимальное значение оптической плотности, известное для натрия оксибутирата в диапазоне концентраций, характерных для острого отравления. Значения оптической плотности превышали оптимальный диапазон для измерения оптической плотности (0,1-1,0) и достигали значений 2,1-2,4. Превышение максимального значения оптической плотности более чем в 2 раза делает расчёт концентраций недостоверным. Изменение оттенка продукта реакции с розово-фиолетового на малиновый и интенсивности окраски возможно объяснить взаимодействием патологических компонентов мочи с указанными в методике реактивами.
Образцы мочи подвергали пробоподготовке по общепринятой методике жидкость-жидкостной экстракции с целью устранения балластных веществ (белков) и извлечения определяемых веществ кислого и нейтрального характера в органическую фазу (хлороформ). После упаривания хлороформного извлечения и разведения остатка в воде проводили спектрофотометрическую методику определения натрия оксибутирата – в результате развивалась слабая грязно-коричневая окраска, не соответствующая ожидаемой окраске продукта взаимодействия натрия оксибутирата с реактивами методики. Отсутствие розово-фиолетовой окраски интерпретировалось как отрицательный результат обнаружения натрия оксибутирата. В отсутствие розово-фиолетовой окраски спектрофотометрирование не проводилось.
Учитывая структуру таких веществ, как желчные пигменты, белки и продукты их распада, липиды, клеточные элементы и т.п., образующих патологический состав мочи, содержащиеся в них пиррольные циклы, ненасыщенные (двойные) связи, первичные и вторичные аминогруппы, иминогруппы, гидрокси-, оксо- и карбоксильные группы, вероятно предположить их взаимодействие с концентрированными минеральными кислотами и солями железа (III)[2].
Такие желчные пигменты, как уробилины I и D, стеркобилин и билирубин, могут вступать в реакцию комплексообразования с солями железа (III) из-за наличия третичных атомов азота, карбоксильных, имидных групп. Строение молекул желчных пигментов приведено на рисунке 1, указанные функциональные группы выделены красным цветом:
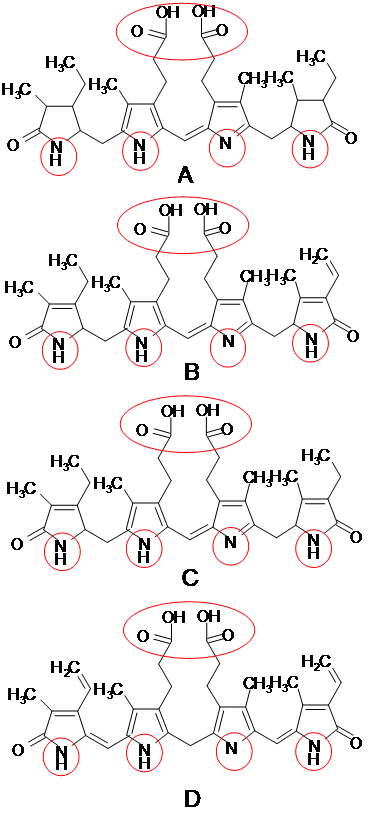
Рис.1. Строение молекул желчных пигментов: А – стеркобилин, В – уробилин D, С – уробилин I, D – билирубин.
В состоянии токсического шока в моче может повышаться содержание азотистых продуктов распада белков и пуриновых оснований, таких как мочевая и гиппуровая кислоты, креатинин, ксантин, индикан и др. В указанных веществах также присутствуют функциональные группы, способные к комплексообразованию с солями железа (III) – гидроксильные, имидные и карбоксильные группы. Строение веществ приведено на рисунке 2, указанные функциональные группы выделены красным цветом:
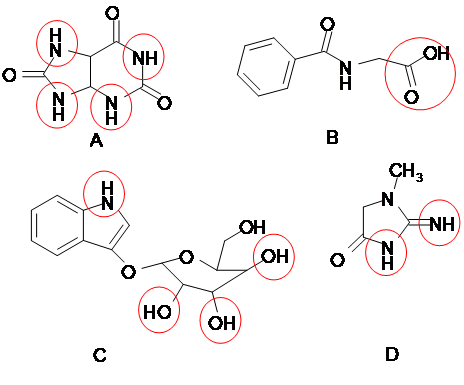
Рис.2. Строение молекул продуктов распада азотистых соединений: А – мочевая кислота; В – гиппуровая кислота; С – индикан; D – креатинин.
Присутствие щавелевой кислоты, кетоновых тел, сахаров, жиров, гетероциклических азотсодержащих соединений, веществ с амино- и иминогруппами в моче может привести к протеканию окислительно-восстановительных реакций с концентрированными минеральными кислотами или солями железа (III), в результате которых образуются конденсированные соединения, продукты осмоления, имеющие различную окраску. Производные пиррола (входят в состав желчных пигментов) являются электронообогащёнными ароматическими системами, способными к реакциям электрофильного замещения. С сильными кислотами протекает реакция протонирования, протонированный катион вступает в реакцию полимеризации с нативными молекулами пирролов, что приводит к образованию смолистых веществ, часто имеющих красную окраску [2].
Таким образом, развитие малиновой окраски при проведении спектрофотометрической методики без пробоподготовкии отсутствие необходимой окраски при проведении экстракции является следствием взаимодействия патологических компонентов мочи с реактивами гидроксамовой реакции. В данном исследовании установлено влияние патологических компонентов мочи пациентов, находящихся в состоянии токсического шока, на проведение определения гамма-гидроксимасляной кислоты и её прекурсоров методом спектрофотометрии, а также установлена необходимость пробоподготовки. Спектрофотометрическая методика без пробоподготовки применима для плановых скрининговых исследований мочи лиц, не находящихся в состоянии токсического шока.
В виду наличия в моче значительных количеств компонентов, мешающих протеканию гидроксамовой реакции, появление которых обусловлено различными патологическими состояниями, приёмом лекарственных препаратов, алкоголя и т.п., нами рекомендовано предварительное проведение пробоподготовки для выявления отравления натрия оксибутиратом у лиц, находящихся в состоянии токсического шока.
Выводы
Показано влияние патологических компонентов мочи на протекание гидроксамовой реакции. Показана необходимость проведения пробоподготовки перед спектрофотометрическим определением гамма-гидроксимасляной кислоты и её прекурсоров в моче пациентов.
Рецензенты:
Гришин А.В., д.фарм.н., профессор, заведующий кафедрой фармации ГБОУ ВПО «Омская государственная медицинская академия» Минздрава России, г. Омск.
Пеньевская Н.А., д.м.н., профессор, заведующий кафедрой фармацевтической технологии с курсом биотехнологии ГБОУ ВПО «Омская государственная медицинская академия» Минздрава России, г. Омск.
Библиографическая ссылка
Попова А.П., Гончаров Д.С., Чернышева О.В., Лукша Е.А. ОБОСНОВАНИЕ НЕОБХОДИМОСТИ ПРОБОПОДГОТОВКИ ПРИ СПЕКТРОФОТОМЕТРИЧЕСКОМ ОПРЕДЕЛЕНИИ ГАММА-ГИДРОКСИМАСЛЯНОЙ КИСЛОТЫ И ЕЁ ПРЕКУРСОРОВ // Современные проблемы науки и образования. 2014. № 5. ;URL: https://science-education.ru/ru/article/view?id=14944 (дата обращения: 20.01.2026).



