Диагностика бордетеллеза имеет большое значение, так как бордетеллёз – инфекционное заболевание, передающееся от домашних животных – собак, кошек – человеку [1, 2, 3, 4].
Животные-носители могут быть источниками распространения заболевания других животных и взрослых людей, со слабым иммунным статусом, имеющих в анамнезе хронические системные заболевания, перенесших травмы, операции. Особенно восприимчивы дети [7, 11].
Диагноз на бордетеллезную инфекцию собак устанавливают на основании комплексных клинико-эпизоотологических данных, результатов патологоанатомических, бактериологических и серологических исследований. В сложных случаях ставят биологическую пробу на щенках.
Слизь, отобранную из носовой полости или глотки центрифугируют при 2500 – 3000 об/мин в течение 15 минут, а из надосадочной жидкости делают высевы на питательные среды. Тампонами, смоченными в носовой слизи, проводят несколько раз по поверхности твёрдой питательной среды (лёгкое круговое втирание). В положительном случае уже через 24-48 часов инкубации высевов, при температуре +37°С, на агаре появляются мелкие колонии, размером 2-3 мм серовато-белого цвета. Зоны гемолиза образуются на средах с кровью. На среде Гартоха через 48 часов вырастают беловатые, каплевидные колонии, а на агаре Мак-Конки – розовые со светлым центром [1-23].
Ускоренная дифференциация культур бордетелл проводится с помощью реакции агглютинации на предметном стекле с положительными и отрицательными сыворотками; определение их биохимических особенностей на пёстром ряду и уреазной активности (положительная) с учётом микроскопических и культуральных результатов исследований [1, 5].
Материалы и методы. Нами разработана тeст-cистема индикации и идентификации бактерий B.bronchiseptica.
Бактериологическая детекция нацелена на выделение чистой культуры бактерий B.bronchiseptica.
Проводится взятие глубоких мазков из глотки животных на 2 чашки Петри с дифференциально-диагностической средой с селективной добавкой и без неё и культивирование в течение 24-48 ч в термостате при температуре 36+1°С.
На 2-3-е сутки исследования (48-72 ч): отбор и изучение не менее 3-х характерных колоний бирюзового цвета, возможно с темно-синим центром. Колонии других микроорганизмов могут изменять цвет среды с зеленого на жёлтоватый. Колонии B.bronchiseptica могут быть полиморфны. Подозрительными являются россинчатые, выпуклые, влажные, гладкие, блестящие с ровными краями, маслянистой консистенции, легко снимающиеся с поверхности среды колонии диаметром от 1 до 2 мм (фаза I) и более крупные (до 3-4 мм), плоские с приподнятым центром и шероховатыми краями колонии (фаза III) или переходные формы (фаза II). При наличии значительного количества однотипных подозрительных колоний проводят микроскопию окрашенных по Граму мазков с обнаружением мелких грамотрицательных коккобацил, равномерно располагающиеся в мазке одиночно, по парам или короткими цепочками. Проводят отсев подозрительных колоний на скошенный МПА для выделения чистой культуры и наращивания бактериальной массы в течение 24 ч. При отсутствии роста подозрительных колоний чашки Петри вновь помещают в термостат на 24-48 ч и просматривают повторно.
На 3-4-е сутки исследования (72-96 ч) просматривают посевы для выделения чистой культуры, проводят микроскопию и биохимические тесты. Учитывают хороший рост B.bronchiseptica на МПА в течение 24-48 ч, аэробность, наличие оксидазной, каталазной и гемолитической активности. Если в течение 4-х суток на среде выращивания не обнаружены подозрительные колонии дают окончательный отрицательный ответ.
Иммунологическая детекция применяется для обнаружения в исследуемом материале с помощью гипериммунной сыворотки специфических антигенов B.bronchiseptica (дополнительный компонент бактериологического исследования).
При помощи иммунопрепаратов проводят пластинчатую реакцию агглютинации на предметном стекле или реакцию диффузной прецепитации.
Молекулярно-генетическая детекция нацелена на обнаружение ДНК бактерий B.bronchiseptica в биоматериале без выделения чистой культуры или как подтверждение бактериологического исследования.
Проводят выделение нуклеиновых кислот из культур сорбентным способом, проведение мультиплексной полимеразной цепной реакции с разработанными системами праймеров (Pr1-1 (5’ ccttccagcacctggcggtacgagttgctcc 3’), Pr1-2 (5’ ccccgtgccggggtgcctggacctgggcg 3’) для гена BfrA ДНК B.bronchiseptica; Pr3-1 (5’ggacgaccaggatcacatcttcc 3’), Pr3-2 (5’ gctttcctggtagttgg-cgtagg 3’) для гена BfrZ; Pr4-1 (5’ gcattgctccatcctgttgtgcg 3’), Pr4-2 (5’ gatgggttatctgagcgcgc 3’) для гена Cytochrom–C–oxidase и Pr5-1 (5’ ctacgggggaaagcggggga 3’), Pr5-1 (5’ gaccgtactccccaggcggt 3’) для гена 16S rRNA), флуоресцентный зонд для системы праймеров участка гена bfrZ), детекция с помощью горизонтального электрофореза и в режиме «реального времени». Программа проведения ПЦР с электрофоретической детекцией − 1) 95°С−5 мин, 2) 95°С−10 сек, 62°С−10 сек, 72°С−20 сек − 40 циклов, 3) 72°С−2 мин; для детекции в режиме реального времени − 1) 95°С−5 мин, 2) 95°С−10 сек, 62°С−15 сек − 40 циклов, 3) 72°С−1 мин.
Детекция специфическими фагами позволяет обнаружить бактерии B.bronchiseptica реакцией нарастания титра фага (РНФ) без выделения чистой культуры (самостоятельный метод) или подтверждение бактериологического исследования методом «стекающей капли» (дополнительный метод к бактериологической схеме). Для постановки реакции нарастания титра фага (РНФ) каждую исследуемую пробу вносят в стерильную колбу с МПБ в соотношении 1:10. Содержимое колбы встряхивают с последующим отстаиванием взвеси в течение 10 минут. Готовят 3 широкие пробирки (диаметр 20 мм), их нумеруют №1, №2, №3. В пробирки №1, №2 вносят по 9 мл исследуемой взвеси, в пробирку №3 - 9 мл стерильного МПБ. В пробирки №1 и №3 добавляют 1 мл биопрепарата «ББР-117 УГСХА», в пробирку №2 вносят 1 мл МПБ. Пробирка №1 является опытной. Пробирка №2 – является контролем для выявления в пробах свободного фага. Пробирка №3 – контроль на титр индикаторного фага. Все три пробирки выдерживают в течение 7 часов при температуре 37ºС. Затем содержимое каждой пробирки разводят питательным бульоном (рН 7,4-7,6) так, чтобы при высеве 1 мл содержимого из пробирки №3 (контроль на титр фага) на чашках Петри образовалось несколько десятков негативных колоний (зон лизиса) фага. В пробирке №3 индикаторный фаг находился в концентрации нескольких тысяч корпускул в 1 мл, и для того, чтобы получить в конечном разведении несколько десятков корпускул в 1 мл, содержимое пробирки №3 разводили в 20 раз, т.е. 0,25 мл исследуемой смеси вносят в 4,5 мл бульона. Содержимое опытных пробирок №1 и №2, разводят аналогично. Инактивацию микрофлоры разведенных смесей проводят путем обработки хлороформом в соотношении к фаголизату 1:10 в течение 15 минут. Содержимое пробирок исследуют на определение числа корпускул бактериофага методом агаровых слоев. Результат реакции учитывают методом подсчета негативных колоний фага в опытных и контрольных чашках Петри. Положительная реакция характеризуется увеличением количества корпускул по сравнению с контролем в 5 и более раз.
Для постановки реакции «стекающей капли» на поверхность дифференциально-диагностической среды пипеткой наносят 3-4 капли бульонной 18 ч культуры исследуемых микроорганизмов, распределяют её по поверхности среды, подсушивают, делят чашку на два сектора и наносят на один сектор фаговый биопрепарат, на другой – стерильный МПБ. Наличие зоны лизиса на сплошном газоне исследуемой культуры сектора с биопрепаратом указывает на принадлежность штамма к бактериям B.bronchiseptica.
Алгоритм использования ТСИИ ББР представлен на рисунке 1. Все компоненты имеют сильные и слабые стороны, что надо учитывать исходя из целей и масштабов исследований.
Так, бактериологический компонент системы эффективен и обладает достаточно высокой специфичностью, но его проведение трудоемко, длительно (72-96 ч) и является дорогостоящим.
Иммунологический компонент экспрессный, но недостаточно специфичный и не может быть использован как самостоятельный.
Молекулярно-генетический компонент идентификации, являясь быстрым, высокочувствительным и специфичным, не позволяет определить жизнеспособность микроорганизмов и дифференцировать текущую инфекцию от прошедшей.
Мультиплексная ПЦР дает возможность выделить возбудителя среди близкородственных бактерий. Негативными моментами являются высокая стоимость анализов, многоэтапность и возможность получения ложноположительных и ложноотрицательных результатов, как следствие контаминации лабораторий ДНК материалом и ошибок операторов.
Фаговый компонент экономичнее бактериологического, так как на его проведение затрачивается меньшее количество лабораторной посуды, сред и реактивов. Методика фагодиагностики бордетеллёза является простой, высоко специфичной и занимает 26 ч при постановке реакции нарастания титра фага и 60 ч – СПОТ-теста.
РНФ может использоваться как самостоятельный компонент тест-системы, СПОТ-тест в качестве дополнения бактериологической схемы.
Рекомендуем для эффективного выбора отдельных диагностических компонентов или их сочетанного использования учитывать: масштабы планируемых исследований (массовые или индивидуальные обследования), контингент животных (уличные, домашние, вид, возраст, иммунный статус и др.), период инфекционного цикла (инкубация, простудные симптомы, «лающий кашель», выздоровление) и возможности лаборатории.
Тест-систему рекомендуем использовать для подтверждения клинического диагноза, выявления атипичных форм заболевания, обнаружения бактерионосителей.
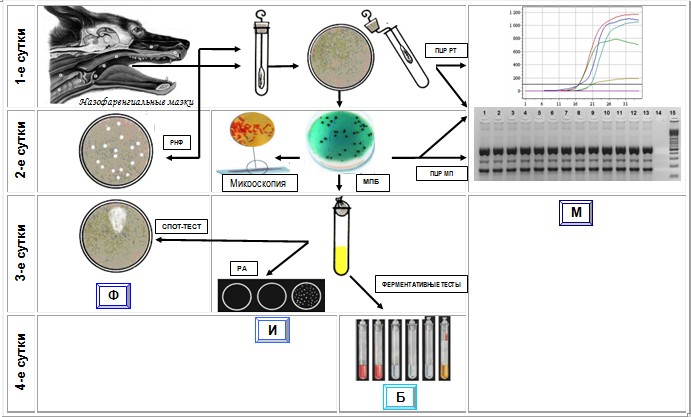
Рис. 1. Компоненты ТИСС ББР. Ф – фаговый, И – иммунологический, Б – бактериологический, М – молекулярно-генетический
Рецензенты:
Золотухин С.Н., д.б.н., профессор кафедры микробиологии, вирусологии, эпизоотологии и ВСЭ ФГБОУ ВПО «Ульяновская государственная сельскохозяйственная академия имени П.А. Столыпина», г. Ульяновск;
Нафеев А.А., д.м.н., заведующий отделением особо опасных инфекций, природно-очаговых инфекций и профилактики туберкулеза ФБУЗ «Центр гигиены и эпидемиологии в Ульяновской области», г. Ульяновск.
Библиографическая ссылка
Васильева Ю.Б., Мастиленко А.В., Васильев Д.А., Бадаев Р.Р., Мерчина С.В., Швиденко И.Г., Суркова Е.И. АЛГОРИТМ ИСПОЛЬЗОВАНИЯ ТECT-CИСТЕМЫ ИНДИКАЦИИ И ИДЕНТИФИКАЦИИ БАКТЕРИЙ B. BRONCHISEPTICA // Современные проблемы науки и образования. 2014. № 5. ;URL: https://science-education.ru/ru/article/view?id=14900 (дата обращения: 20.01.2026).



