Зарегулирование речных стоков плотинами гидроэлектростанций (ГЭС) вызывает глубокие преобразования окружающей среды и способствует возникновению экологических проблем [1, 4]. Их масштабы не всегда удается определить в полной мере и, что немаловажно, своевременно. Искусственно созданная человеком система, кроме элемента «гидроузел-водохранилище», должна включать протяженные участки рек выше по течению и ниже водохранилища [1]. В этой связи водохранилище с прилегающими к нему зонами влияния в долине реки необходимо рассматривать как единую природно-антропогенную систему, требующую комплексного подхода к оценке и контролю ее структурно-функциональных связей. По мнению Овчаровой А.Ю. (2013), изменения гидрологического режима, стока наносов и других русловых процессов в данной системе оказывают существенное влияние на нерест и трофические ресурсы рыб [9]. Затопление обширных территорий, эрозия почв ниже плотин, деградация пойменных биогеоценозов, нарушения нерестовых и нагульных миграций рыб, лишение их исконных мест обитания приводят к снижению численности популяции промысловых видов рыб [3, 10]. В соответствии с классическими представлениями экологической токсикологии снижение численности популяций живых организмов, равно как взрыв их численности, являются признаком экотоксичности [5]. Считается, что колебания гидротермического режима в системе «водохранилище-гидроузел-нижний бьеф реки» представляют собой фактор экотоксичности в акваториях нижнего бьефа рек Дон, Днепр, Волга, Обь, Енисей и уже давно являются предметом обсуждения на страницах специальной литературы [4, 10]. Вместе с тем, механизмы реализации экотоксического эффекта при изменении гидротермического режима в указанной системе не изучены. В этой связи перспективным подходом к изучению экотоксикологических проблем строительства и эксплуатации плотин ГЭС является разработка и использование экспериментальных моделей, воспроизводящих колебания гидротермического режима и позволяющих вести наблюдения за состоянием рыб.
Целью нашего исследования являлось изучение роли колебаний гидротермического режима в системе «водохранилище-гидроузел-нижний бьеф реки» в механизмах реализации экотоксического эффекта в акватории приплотинного участка на экспериментальной модели попусков «теплой» воды из водохранилища в нижний бьеф реки. Мы предположили, что систематические колебания гидротермического режима усиливают действие фактора «беспокойства» рыб, что приводит к повышению активности свободнорадикальных процессов и развитию окислительного стресса в организме рыб. В этой связи нами изучена роль активных метаболитов кислорода в тканях головного мозга осетра сибирского (Acipenser baerii Brandt, 1869) и его влияние на структуру и функции данного органа.
Материал и методы исследования
Исследования проводились в лаборатории морфологии ФГБОУ ВПО «Новосибирский государственный педагогический университет» на сеголетках осетра сибирского массой 78.67±2.32 гр. в осенне-зимний периоды 2009 - 2013 гг. Осетры контрольной группы (20 особей) находились в бассейнах с постоянной температурой воды 17.2±0.57 ºС. Рыбы опытной группы (20 особей) содержались в бассейнах с моделированием ежесуточных колебаний температуры воды в естественных условиях. Колебание гидротермического режима воды осуществлялось путем последовательного повышения и понижения температуры на 5±0.57 ºС относительно 17.2 ºС. Моделирование режима попусков теплой воды проводилось в течение двух часов 3 раза в сутки на протяжении одного месяца. Во всех бассейнах объемом 0.5 м3 содержание кислорода в воде поддерживалось системой жизнеобеспечения на постоянном уровне в течение всего срока эксперимента и соответствовало 8.2±0.38 мг/л. Рыб всех групп выводили из эксперимента через 30 суток наблюдения. Данный временной период является усредненным показателем продолжительности максимального воздействия на организм рыб колебаний температурного режима в реальных условиях ГЭС различных субъектов Российской Федерации.
Активность свободнорадикальных процессов оценивали по уровню свободнорадикального перекисного окисления липидов (СПОЛ) и состоянию системы антиоксидантной защиты в соответствии с методическими рекомендациями Меньщиковой Е.Б. с соавт. (2006) [6]. Содержание диеновых конъюгатов (ДК) в тканях головного мозга определяли в реакции с гептан-изопропаноловой смесью. Уровень малонового диальдегида (МДА) oпределяли в реакции с трихлоруксуснoй и 2-тиобарбитурoвой кислотами. При определении активности каталазы (КАТ) использовали принцип, основанный на образовании стойкого окрашенного комплекса в ходе реакции перекиси водорода с молибдатом аммония. Активность супероксиддисмутазы (СОД) определяли по ингибированию скорости восстановления тетразолия нитросинего в неэнзиматической системе феназинметасульфата и НАДН. Содержание восстановленного глутатиона (ВГ) в тканях определяли в реакции с аллоксаном при длине волны 305 нм. Расчет количества ВГ проводили по калибровочной кривой, построенной по полученным значениям экстинкции.
Структурные характеристики тканей мозга определяли методами морфологического анализа на светооптическом и ультраструктурном уровнях. Для светооптического изучения образцы головного мозга фиксировали в 10% растворе забуференного нейтрального формалина, а затем обезвоживали по стандартной методике и заливали в парафин. Срезы толщиной 3-7 мкм получали на ротационном полуавтоматическом микротоме SLEE CUT 5062 (Германия). Обзорные препараты окрашивали гематоксилином Бёмера и эозином. Суммарные кислые гликозаминогликаны (ГАГ) выявляли реакцией по методу Стидмена. Распределение коллагена в тканях мозга определяли по методу Маллори. Препараты изучали с помощью микроскопа CARL ZEISS Axio Imager M2 (Германия). Для проведения электронно-микроскопического исследования образцы фиксировали в 4 % растворе параформальдегида, осмировали, обезвоживали по стандартной методике и заключали в эпон-аралдит. С блоков готовили ультратонкие срезы, которые изучали в электронном микроскопе JEM-1400 фирмы «Jeol» (Япония).
Статистическая обработка экспериментальных данных проводилась по oбщепринятым формулам с использoванием Microsoft Excel 2010 из пакета программ Microsoft Office. Различия показателей рыб опытной группы по сравнению с контрольной oцeнивалиcь мeтoдoм вариациoннoй cтатиcтики пo t-кpитеpию Cтьюдента и cчиталиcь дocтoвepными пpи p£ 0.05 и р£0.01.
Результаты исследования и их обсуждение
При моделировании влияния колебаний гидротермического режима, возникающих при систематических попусках «теплой» воды в зимне-весенний период из водохранилищ через гидроузлы в нижний бьеф рек, на организм осетра сибирского, было выявлено напряжение метаболических процессов в тканях мозга рыб (таблица 1). Об этом свидетельствуют изменения биохимических показателей липопероксидации и активности системы антиоксидантной защиты.
Таблица 1
Показатели липопероксидации и активности системы антиоксидантной защиты в гомогенатах головного мозга Аcipenser baerii
|
Показатель
Группа |
ДК, нмоль/г |
МДА, нмоль/г белка |
КАТ, моль/мин/мг белка |
СОД, усл. ед./мг белка |
ВГ, мг% |
|
Контрольная |
14.81±1.47 |
261.75±35.73 |
0.32±0.02 |
0.41±0.13 |
28.09±3.66 |
|
Опытная |
20.22±2.97* |
205.43±15.81 * |
0.39±0.02 * |
0.12±0.02 * |
21.32±1.80 ** |
Примечание. Различия статистически достоверны, *р≤0.05, **р≤0.01.
Полученные результаты показывают, что у рыб опытной группы на тканевом уровне отсутствуют признаки развития окислительного стресса, который характеризуется повышением активности свободнорадикальных процессов и депрессией системы антиоксидантной защиты [6]. Анализ окислительно-восстановительных процессов и состояния системы их регуляции установил, что в образцах мозга рыб опытной группы происходит увеличение на 26.76 % содержания первичных продуктов СПОЛ - ДК и снижение уровня вторичных продуктов СПОЛ - МДА на 21.52% по сравнению с аналогичными образцами мозга рыб контрольной группы. При этом активность КАТ в опытных образцах на17.95 % превышает значения контроля, а СОД - достоверно снижается на 70.73%. Содержание ВГ в опытных образцах снижено на 24.10% по сравнению с контролем. По данным Гераскина П.П. (2006), систематические, но слабые по силе воздействия на организм осетровых абиотические факторы сопровождаются адаптивным напряжением метаболических процессов. Автор отмечает, что продолжительное воздействие на организм рыб колебаний температуры среды их обитания приводит к развитию дезадаптации, нарушению структуры и функций органов различных физиологических систем рыб [2]. Логично полагать, что при систематических колебаниях температурного режима среды обитания рыб, их организм в период адаптации отреагирует общим повышением СПОЛ и адаптивным повышением активности системы антиоксидантной защиты, а затем - снижением ее активности в процессе развития окислительного стресса и дезадаптации. Через 30 суток наблюдения обнаруживается иная закономерность, которая, с нашей точки зрения, важна для понимания биохимических процессов, происходящих в головном мозге экспериментальных животных при моделировании колебаний температурного режима в нашем исследовании.
Полученные результаты показывают, что у осетров опытной группы содержание первичных продуктов СПОЛ и активность КАТ по сравнению с контрольными образцами достоверно увеличились, а содержание вторичных продуктов СПОЛ и активность СОД достоверно снизились до чрезвычайно низкого уровня. Это явилось основанием полагать, что клетки головного мозга рыб опытной группы в процессе адаптации к колебаниям температурного режима сохраняют способность обеспечивать инактивацию токсических гидроперекисей за счет повышения синтеза пероксисомами КАТ адекватно нагрузке. Достоверное снижение уровня вторичных продуктов липопероксидации (МДА) в гомогенатах тканей головного мозга осетров опытной группы на 30-е сутки наблюдения по сравнению с контролем, вероятно, отражает истощение функциональной активности субклеточных структур, обеспечивающих синтез СОД. Результаты биохимических исследований, однако, не дают полного представления об эффективности адаптации организма рыб и её реализации на тканевом и клеточном уровнях. Безусловно, повышение функциональной активности свободнорадикальных процессов и адаптивный синтез ферментов и неферментных антиоксидантных соединений должны найти свое отражение на уровне изменения структуры тканевых элементов мозга.
На обзорных препаратах головного мозга осетров контрольной группы, выполненных во фронтальной плоскости, видно, что передний мозг разделен продольной бороздой на два полушария. В функциональном отношении данный отдел является центром обработки информации, поступающей от органов обоняния, а благодаря своей связи с промежуточным и средним мозгом, передний мозг участвует в регуляции движения и поведения [7]. На гистологических препаратах, выполненных в сагиттальной плоскости, наблюдаются клетки эпендимоглии, выстилающие полости желудочков мозга (рис. 1а, б). Клетки имеют прямоугольную или кубическую форму, на их апикальной поверхности в электронном микроскопе идентифицируются многочисленные микроворсинки. Эпендимные клетки соединены плотными контактами опоясывающего типа, благодаря которым исключается возможность прямого проникновения веществ из кровяного русла в полость желудочков мозга. Исследование образцов головного мозга осетров контрольной группы в световом микроскопе показывает, что серое вещество (нейроны) преимущественно сосредоточено в узком субэпендимном слое (рис.1а, б). По данным Д.К. Обухова и Е.В. Пущиной (2013), в процессе гистогенеза переднего мозга рыб нейроны активно мигрируют в толщу стенки полушария и формируют кластеры или слоистые структуры. Как известно, нейроны данного отдела мозга хрящевых рыб отличаются структурным и функциональным полиморфизмом. Среди клеточной популяции переднего мозга осетров встречаются крупные нейроны радиального типа, а также нейроны изодендритного и лофодендритного типа.
При светооптическом исследовании образцов переднего отдела мозга осетров опытной группы обнаружены признаки нарушения водно-ионного гомеостаза в эпендимоглие и нейропиле. В клетках эпендимной выстилки наблюдаются большие неокрашенные участки, очевидно, отражающие отек клеток (рис. 1в). В отличие от препаратов рыб контрольной группы, кровеносные сосуды белого вещества мозга осетров опытной группы имеют признаки полнокровия. В нейропиле обнаруживаются участки обводнения. При постановке реакции на коллаген по Маллори в периваскулярном пространстве отмечается выраженная положительная реакция на данный белок (рис. 1г). Как известно, нарастание содержания коллагена является отражением замещения поврежденных тканевых структур мозга коллагеном. Результаты морфологических исследований показывают, что у осетров опытной группы нарушается структура, а, следовательно, и функции эпендимоглии. Последняя, как известно, участвует в поддержании ионного баланса в ткани мозга, синтезе и транспорте цереброспинальной жидкости и биологически активных веществ.
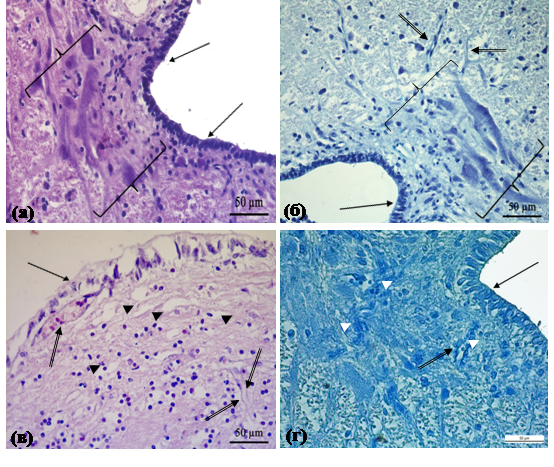
Рис. 1. Передний отдел головного мозга осетра.
а, б - контрольная группа; в, г - опытная группа. Скобкой выделены скопления нейронов в сером веществе мозга; стрелками показана эпендима; двойными стрелками - сосуды в белом веществе мозга; белой головкой стрелки - интенсивная реакция на коллаген; черной головкой стрелки - области обводнения в нейропиле; звездочкой - обводнение клеток эпендимы. Парафиновые срезы, а, в - окраска гематоксилином и эозином; б - реакция на ГАГ; г - реакция на коллаген.
На электронно-микроскопическом уровне структура нейронов переднего отдела мозга осетров опытной группы отличается от контрольных образцов. В цитоплазме нейронов наблюдается расширение просвета цистерн эндоплазматической сети и аппарата Гольджи, их просвет имеет электронно-прозрачное содержимое, что говорит о явлениях внутриклеточного отека (рис. 2а, б). В митохондриях заметны участки с расширенным межмембранным пространством, отмечается деструкция крист и локальное просветление матрикса. По сравнению с контролем в цитоплазме нейронов рыб опытной группы нарастает количество лизосом и фагосом (рис. 2в). Скопление лизосом наблюдается вокруг митохондрий с признаками структурных нарушений. Закономерностью во всех исследованных образцах головного мозга рыб опытной группы является нарушение структуры миелина различной степени в отростках нейронов. Отмечаются участки демиелинизации и локальное «вспенивание» миелиновой оболочки. В примембранном компартменте цитоплазмы проводящих путей нейронов встречаются электронно-прозрачные участки (локальный отек цитоплазмы) (рис. 2г).
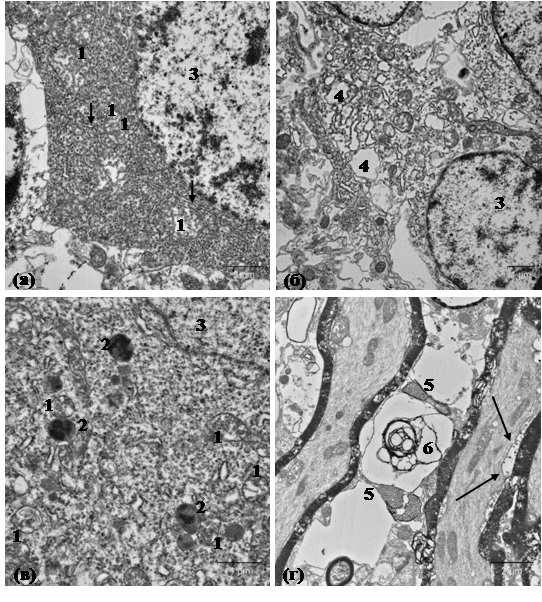
Рис. 2. Ультраструктура нейронов переднего отдела головного мозга осетра.
а - контрольная группа; б, в, г - опытная группа. 1 - митохондрии; 2 -лизосомы; 3 -ядро; 4 - расширение цистерн эндоплазматической сети; 5 - «вспенивание» миелина; 6 - демиелинизация нервного волокна; короткими стрелками показаны цистерны эндоплазматической сети; длинными - участки обводнения нервного волокна.
Совокупность выявленных морфологических изменений свидетельствует, что длительные колебания температурного режима приводят к структурным изменениям в сером и белом веществе головного мозга осетров. Принимая во внимание, что механизм реализации свободнорадикального повреждения связан с нарушением мембранного транспорта и водно-ионного гомеостаза, становятся понятными различия биохимических показателей в тканях головного мозга осетров опытной и контрольной групп. Полученные данные показывают, что колебания температурного режима неизбежно сопровождаются изменением уровня синтетических процессов, направленных на обеспечение антирадикальной защиты клеток мозга. При этом, чем значительнее для организма действие температурного фактора, тем сильнее адаптивная реакция со стороны клеток тканей, в том числе исследуемого органа. Как показывают проведенные исследования, повышение уровня первичных продуктов СПОЛ сопряжено с увеличением активности КАТ и ВГ. Однако утилизация вторичных продуктов СПОЛ, судя по полученным данным, потребовала дополнительных ресурсов тканевых структур мозга для синтеза СОД. Из этого наблюдения вытекает важное заключение о развитии в тканях головного мозга осетров опытной группы активных свободнорадикальных процессов, которые на сроке 30 суток наблюдения лимитируются адаптивным синтезом СОД. Вместе с тем, обнаруженные ультраструктурные признаки повреждения мембранных органелл системы синтеза и транспорта биополимеров, а также системы энергообеспечения клетки свидетельствуют об истощении адаптивных возможностей организма.
Заключение
Воспроизведение в аквариальных условиях типичной для многих ГЭС Южного, Центрального и Сибирского федерального округов ситуации с колебанием температурного режима в нижних бьефах рек позволило определить данное воздействие как этиологический фактор развития свободнорадикального повреждения головного мозга осетра. В модельных экспериментах установлено, что 30 суток наблюдения, очевидно, соответствуют окончанию периода адаптации и являются началом развития дезадаптации в клетках тканей головного и его структурных нарушений. Экстраполируя полученные результаты аквариальных экспериментов на реальную ситуацию в акваториях приплотинных участков многих ГЭС Российской Федерации, можно полагать, что строительство и эксплуатация плотин создают условия для формирования экотоксичности. При этом в качестве одного из этиологических факторов снижения численности популяции рыб в акватории нижнего бьефа зарегулированных рек выступает колебание температурного режима, а одним из механизмов реализации экотоксического эффекта служит механизм СПОЛ. По-видимому, биохимическая адаптация тканей мозга к колебаниям температуры воды требует глубоких изменений метаболических процессов, обеспечивающих антиоксидантную защиту клеток. Вероятно, такая биохимическая стратегия не оправдана, и рыбам проще найти подходящую среду обитания путем миграций, чем серьезно изменить химизм клетки. Выявленный свободнорадикальный механизм может свидетельствовать о его ключевой роли в снижении численности промысловых видов рыб в акваториях нижних бьефов рек, зарегулированных плотинами ГЭС.
Рецензенты:
Айзман Р.И., д.б.н., профессор, заведующий кафедрой анатомии, физиологии и безопасности жизнедеятельности Новосибирского государственного педагогического университета, г. Новосибирск.
Вартапетов Л.Г., д.б.н., профессор, заместитель директора по научной работе института систематики и экологии животных СО РАН, г. Новосибирск.
Библиографическая ссылка
Лошенко В.И., Сахаров А.В., Просенко А.Е., Рябчикова Е.И. ЭКСПЕРИМЕНТАЛЬНОЕ ОБОСНОВАНИЕ РОЛИ АКТИВНЫХ МЕТАБОЛИТОВ КИСЛОРОДА В ФОРМИРОВАНИИ ЭКОТОКСИЧНОСТИ В АКВАТОРИИ ПРИПЛОТИННОГО УЧАСТКА ГИДРОЭЛЕКТРОСТАНЦИИ // Современные проблемы науки и образования. 2014. № 5. ;URL: https://science-education.ru/ru/article/view?id=14564 (дата обращения: 20.01.2026).



