Ишемический инсульт (ИИ) - острое нарушение мозгового кровообращения с развитием стойких симптомов поражения, вызванных инфарктом в мозговое вещество [6]. Независимо от причины и патогенетического варианта развития ИИ возникает острая локальная церебральная ишемия. Очаг ишемии мозга неоднороден, в нем выделяют: ядро инфаркта и зону пенумбры. За счет зоны пенумбры происходит постепенное увеличение размеров инфаркта. К настоящему времени известно, что единый организованный ответ на острую церебральную ишемию осуществляется благодаря взаимодействию нервной, иммунной и эндокринной систем, использующих для этого нейротрансмиттеры, цитокины, факторы роста, гормоны и действующих на сходные рецепторы. Развитие острого асептического воспаления лежит в основе разширения зоны инфаркта мозга в течение первой недели после возникновения ИИ, а в более поздние сроки - организации зоны инфаркта мозга. Данные об изменении уровня β-эндорфина при нарушениях мозгового кровообращения практически отсутствуют. Выделяют два основных направления в патогенетической терапии ИИ: улучшение перфузии ткани мозга – реперфузия, и нейропротективная терапия. Воздействие на зону пенумбры является ключевым звеном терапии инсульта. Основной целью этой терапии является предотвращение гибели клеток в зоне пенумбры, что уменьшает объем инфаркта мозга. Достичь это возможно за счет разработки таких воздействий и лекарственных препаратов, которые приводили бы к максимальному сохранению интактной ткани мозга и, следовательно, менее выраженному неврологическому дефициту. Однако, на сегодняшний день все имеющиеся нейропротекторные препараты, испытанные в мультифокальных клинических исследованиях, недостаточно эффективны. Ряд препаратов, уменьшающих ишемическое повреждение мозга в эксперименте, в клинических испытаниях дали отрицательные результаты. Для клинических испытаний важно разработать комбинированную лекарственную патофизиологически значимую терапию с количественной оценкой обратимости повреждений вещества мозга. Поэтому разработка новых подходов к терапии и профилактике инсульта является важнейшей задачей медицины. Немедикаментозный метод ТЭС-терапии, предложенный профессором В. П. Лебедевым и соавт. (1983), направлен на избирательную активацию защитных (антиноцицептивных) механизмов мозга, деятельность которых осуществляется с участием β-эндорфинов и серотонина, обладает многообразием эффектов, общей направленностью которых является нормализация гомеостаза. Однако, до сих пор, не исследована возможность использования ТЭС-терапии с целью коррекции про-/антиоксидантного статуса в острейший период ИИ, нарушение которого является важным патофизиологическим фактором развития и течения этой нозологии.
Цель исследования. Изучение в эксперименте возможности улучшения показателей прооксидантно-антиоксидантной системы и уменьшения повреждения ткани мозга в острейший период ишемического инсульта применением ТЭС-терапии.
Материалы и методы. Эксперименты проведены на 100 взрослых белых нелинейных крысах-самцах средней массой 200±25 гр. Возраст животных колебался от 9 месяцев до 1 года. У животных моделировали ИИ. У них осуществляли забор крови, тканей ГМ. Содержание животных и постановка экспериментов проводилась в соответствии с требованиями приказов № 1179 МЗ СССР от 11.10.1983 года и № 267 МЗ РФ от 19.06.2003 года, а также международными правилами «Guide for the Care and Use of Laboratory Animals». Все проводимые вмешательства в экспериментах проводили под общим золетил-ксиланитовым наркозом. Животные были разделены на 3 группы. 1 группа (n=20) – контрольная – интактные крысы, животные подвергались эвтаназии без проведения оперативного вмешательства. 2 группа (n=40) – крысы с моделированием ИИ без проведения ТЭС-терапии. 3 группа (n=40) - крысы с моделированием ИИ, которым проводилась ТЭС-терапия в анальгетическом режиме в течение 7 дней после моделирования ИИ. Эвтаназию проводили по 10 животных на 1, 3, 7 и 14 сутки после операции. Применялась методика моделирования ИИ путем создания у крыс острой локальной церебральной ишемии за счет коагуляции правой средней мозговой артерии (ПСМА) [9]. Для морфологического подтверждения ИИ и оценки выраженности повреждения ткани мозга в разных группах животных у них изымали головной мозг (ГМ) и проводили гистохимическое исследование: окраска гематоксилином и эозином по Д. Э. Коржевскому, А. В. Гилярову (2010), окраска ткани головного мозга толуидиновым синим по Нисслю (Д. Э. Коржевский, А. В. Гиляров, 2010), окраска ткани мозга по Чиаччио (R. D. Lillie, 1965). Микроскопию проводили с использованием микроскопа Микромед-6 (Россия). Фотографии получали с использованием окулярной камеры «Levenchuk 230» (США). ТЭС-терапию экспериментальным животным проводили модифицированным двухпрограммным электростимулятором «ТРАНСАИР-03» (ООО «Центр транскраниальной электростимуляции», г. Санкт-Петербург) в анальгетическом режиме (В. П. Лебедев и соавт., 1988; М. Г. Ковалев, 1993). В работе были изучены показатели про-/антиоксидантного статуса и уровень β-эндорфинов у животных 3 исследуемых групп. Уровень β-эндорфина в сыворотке крови определяли иммуноферментным методом с помощью набора «Elabscience Biotechnology Co., Ltd», (Китай). Люминол-зависимая H2O2-индуцированная хемилюминесценция плазмы крови измерялась на хемилюминотестере ЛТ-1 производства СП «ХОРОС» (г. Ростов-на-Дону) по методике НИИБИ в собственной модификации [7]. Определение антиокислительной активности (АОА) плазмы крови амперометрическим способом проводилось на анализаторе антиоксидантной активности «Яуза-01-ААА», производства ОАО НПО «Химавтоматика» по методу (А. Я. Яшин и соавт., 2003) в собственной модификации [1]. Активность каталазы (КАТ) оценивали в гемолизате эритроцитов по методу (R. Beers и соавт., 1952) в собственной модификации [8]. Для определения активности супероксиддисмутазы (СОД) использовали методику (В. А. Костюк и соавт., 1990) в собственной модификации [8]. Статистическую обработку полученных данных осуществляли методами непараметрической статистики с использованием программного обеспечения «Statistika 6.0 for Windows» фирмы «Stat Soft, Inc.» и «Micrisoft Office Excel 2003». Полученные результаты исследуемых групп после статистической обработки выражали в виде средних значений (M) и ошибки среднего (m). Сравнение выборок проводилось по непараметрическому критерию Манна-Уитни, с установлением уровня значимости *p≤0,05 и **p≤0,01.
Результаты исследования. Результаты, полученные в проведенных экспериментальных исследованиях, согласуются с литературными данными о механизмах активации окислительного стресса (ОС) и его роли в повреждении ГМ. Наблюдаемое в 1 сутки после моделирования ИИ достоверное (p<0,05) увеличение максимальной амплитуды вспышки хемилюминисценции (МВХЛ) (на 131,4 % по сравнению с контрольной группой) свидетельствует об активации процессов свободнорадикального окисления (СРО). Рост амплитуды МВХЛ продолжался вплоть до 7 суток, достигая 395,6 %. К 14 суткам происходило достоверное (p<0,05) снижение (до 255,5 % по сравнению с контрольной группой) амплитуды МВХЛ, однако она превышала уровень контрольной группы на 31,6 %. Это указывает на выраженную активность оксидантной системы. Одновременно с этим, в ответ на возрастающую прооксидантную нагрузку, повышалась активность СОД, которая к 7 суткам тоже достоверно (p<0,05) достигала максимума (увеличение на 151,9 % по сравнению с контрольной группой). К 14 суткам ее активность резко падала, превышая показатель контрольной группы животных только на 22,1 %. При этом отмечено падение активности второго фермента АОЗ - КАТ. Она к 14 суткам была достоверно (p<0,05) ниже уровня контрольной группы на 34,5 %. АОА отражает общую антиоксидантную активность плазмы крови или ее антиокислительный потенциал (Ю. О. Теселкин, 2003). Проведенными исследованиями показано, что АОА плазмы крови уже на 1 сутки моделирования ИИ достоверно (p<0,05) возрастала на 49,2 %, относительно показателя в группе интактных животных. На 3 сутки рост этого показателя продолжался. Он достоверно (p<0,05) превосходил нормальные показатели, характерные для группы интактных животных, на 103,3 %. На 7 сутки он оставался на том уровне. К 14 суткам он достоверно (p<0,05) падал даже ниже показателя группы контроля на 18,7 %, что вероятно связано с дезадаптацией системы АОЗ.
Морфологические исследования состояния ткани мозга в очаге инфаркта в 1 сутки показали, что там появились клетки-тени (рис. 1.3) и единичные нейтрофилы (рис. 1.4). В нейронах выявлялся практически полный тигролиз. На периферии очага некроза развивался клеточный ответ (рис. 1.2). В очаге ишемии наблюдалась гипохромия ядер клеток, что отражало процессы деполимеризации ДНК в некротизированных клетках. Выявлялись признаки перицеллюлярного отека ткани мозга (рис. 1), что подтверждалось значительной разреженностью нейропиля. В центре области ишемии капилляры запустевали и становились незаметными на общем фоне.

Рис. 1. Область формирующегося инфаркта в ткани мозга. Ув. об. 40. Окраска гематоксилин-эозин.
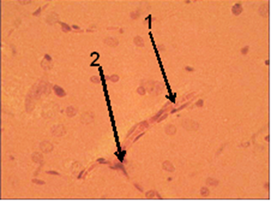
Рис. 2. Капилляры на периферии очага ишемии. Крысы группы 2. Ув. об. 90. Окраска гематоксилин-эозин.
Хотя по периферии очага ишемии они хорошо прокрашивались (рис 2.1). В них были заметны признаки отека эндотелиоцитов и стаза крови. Отмечалась адгезия нейтрофилов к эндотелию капилляров (рис. 2.2). На периферии очага некроза мозговой ткани развивался клеточный ответ (появились единичные нейтрофилы). Все это свидетельствовало о нарушениях кровоснабжения и появлении некроза нейронов, в зоне образующегося инфаркта. Кроме того имелись признаки развития местной воспалительной реакции. В 1 сутки, после моделирования острого ИИ, происходила активация СРО. Это сопровождалось выраженным падением уровня β-эндорфина в крови, которое отмечено весь период наблюдения. Интенсивность СРО на 3 сутки продолжала расти, одновременно имело место значительное увеличение активности СОД и резкое падение активности КАТ (это приводило к перепроизводству перекиси водорода, как источника СР).
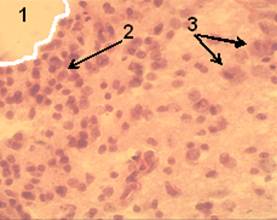
Рис. 3. Срез ткани мозга крысы группы 2. Ув. об. 40. Окраска гематоксилин-эозин.
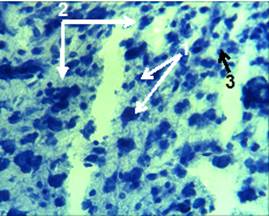
Рис. 4. Срез ткани мозга крысы группы 2. Ув. об. 40. Окраска по Нисслю.
В этот период четко контурировалась зона инфаркта мозга (рис. 3.1). Значительно увеличилось количество погибших нейронов (рис. 3.3). Усиливался перицеллюлярный отек. Появилась выраженная воспалительная клеточная инфильтрация (рис. 3.2). На 3 сутки после моделирования ИИ, при окраске по Нисслю (рис. 4), на микропрепаратах ткани мозга животных 2 группы, видны дистрофически измененные нейроны (рис. 4.1), отмечаются признаки нейронофагии (рис. 4.2) и выраженная воспалительная клеточная инфильтрация (рис. 4.3). На 7 сутки отмечался максимум амплитуды МВХЛ, что свидетельствует о значительной активности оксидантной системы. Это сопровождается очень высокой активностью СОД и низкой – КАТ. В этот период в зоне деструкции ткани мозга и по ее границам отмечалось скопление зернистых шаров (рис. 5.1). Нейроны в зоне деструкции не обнаружены. В области самого инфаркта мозга отмечалась выраженная клеточная реакция и разреженность нейропиля (рис. 6.2). Наблюдалось значительное количество воспалительного клеточного инфильтрата. Хорошо выделялся формирующийся незрелый глиомезодермальный рубец (рис. 6.1).
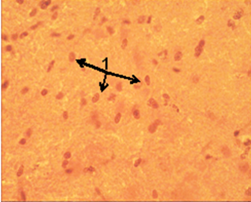
Рис. 5. Срез ткани мозга крысы группы 2. Ув. об. 40. Окраска гематоксилин-эозин.
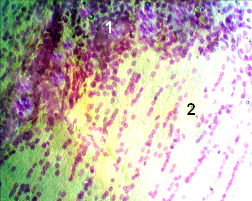
Рис. 6. Срез ткани мозга крысы группы 2. Ув. об. 20. Окраска по Чиаччио.
На 14 сутки, после моделирования ИИ, амплитуда МВХЛ незначительно снижалась. При этом происходило резкое падение активности СОД, активность КАТ оставалась на низких цифрах. Одновременно значительно уменьшалась АОА плазмы крови. Хотя по периферии очага наблюдалось появление новых капилляров, с прорастанием в зону деструкции, но организация очага инфаркта мозга в это время осуществлялась медленно с появлением тканевых дефектов. В очаге инфаркта и по его границам отмечалось значительное скопление клеток глии, составляющих основу глиомезодермального рубца. К этому времени еще происходила организация зоны деструкции.
В 3 группе животных, которым после моделирования ИИ проводили ТЭС-терапию, уровень показателя СРО – ХЛ плазмы крови была в 1,3 раза ниже, чем у животных 2 группы. Максимум амплитуды вспышки ХЛ (МВХЛ), наблюдаемый на 7 сутки, не достигал уровня животных 2 группы (был меньше на 30,6%). К 14 суткам амплитуда МВХЛ была на 33,1% ниже, чем у животных 2 группы. Это указывало на более низкую активность процессов СРО. При этом отмечено, что максимум активности СОД (7 сутки) был ниже на 50,0%. К 14 суткам ее активность возвращалась к исходной величине. Более низкая активность СОД связана с меньшей продукцией СР. Кроме того отсутствие гиперактивности СОД снижает количество образующейся перекиси водорода, что благоприятно на фоне низкой активности КАТ. Динамика активности КАТ не отличалось от таковой у животных 2 группы. Однако к 14 суткам ее активность возвращалась к исходной величине. Таким образом, активность ферментов АОС возвращалась к исходной к 14 суткам, чего не наблюдалось у животных 2 группы. Изменения общей АОА плазмы крови была ниже в 1,2 раза. Максимума она достигала (в отличие от животных 2 группы) к 7 суткам, но была ниже на 14,3%. Однако к 14 суткам АОА оставалась выше исходной величины на 34,7%. Это свидетельствует об активности АОЗ.
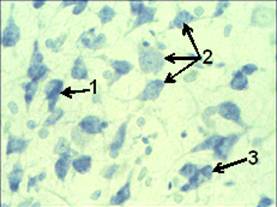
Рис. 7. Срез ткани мозга крысы группы 3. Ув. об. 40. Окраска по Нисслю.
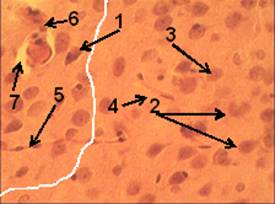
Рис. 8. Срез ткани мозга крысы группы 3. Ув. об. 40. Окраска гематоксилин-эозин
Итак, применение ТЭС-терапии в острейший период ИИ уменьшает СРО (следовательно, снижает образование СР), стимулирует активность АОС, поддерживает АОЗ. Кроме того применение ТЭС-терапии в острейший период позволяет повысить уровень β-эндорфина в крови и поддерживать его в течение периода наблюдения, что согласуется с данными литературы [2,3,4,5,10]. Указанный эффект ТЭС-терапии обусловливают положительное влияние на состояние ткани мозга в очаге ишемии. Клеточный ответ и признаки перицеллюлярного отека ткани мозга менее выражены. В зоне инфаркта мозга наблюдались единичные клетки-тени и единичные нейтрофилы. Отмечалось преобладание гиперхромных дистрофически измененных нейронов (рис. 7.1, рис. 8.1) с признаками только частичного тигролиза (рис. 7.2), над содержанием клеток-теней (рис. 7.3, рис. 8.2) (по сравнению с животными 2 группы). Капилляры в центре области ишемии также запустевали и становились незаметными на общем фоне (рис. 8.4). По периферии очага ишемии капилляры хорошо прокрашивались (рис. 8.5). В них выявлялись признаки отека эндотелиоцитов, стаза крови, наблюдалась адгезия нейтрофилов к эндотелию (рис. 8.6). Однако значительно меньше наблюдалось нейтрофилов (рис. 8.3), что связано с менее значительным повреждением нейронов и меньшей выраженностью воспаления.
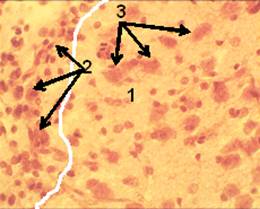
Рис. 9. Срез ткани мозга крысы группы 3. Ув. об. 40. Окраска гематоксилин-эозин.
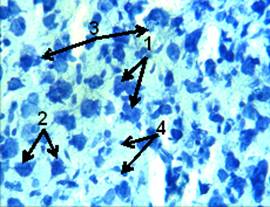
Рис. 10. Срез ткани мозга крысы группы 3. Ув. об. 40. Окраска по Нисслю.
К 3 суткам, после моделирования ИИ, область инфаркта мозга четко выявлялась (рис. 9.1). Количество погибших нейронов было значительно меньше, чем в тот же период времени у крыс группы 2 (рис. 9.3). При этом у крыс группы 3 наблюдалось значительно большее количество нейронов с признаками частичного тигролиза (рис. 10.1) у некоторых из них. Гиперхромных дистрофически измененных нейронов выявлялось мало (рис. 10.2).
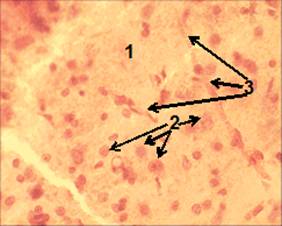
Рис. 11. Срез ткани мозга крысы группы 3. Ув. об. 40. Окраска гематоксилин-эозин.
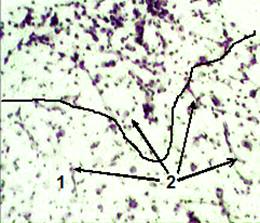
Рис. 12. Срез ткани мозга крысы группы 3. Ув. об. 10. Окраска по Нисслю.
Зона деструкции была выражена менее значительно (рис. 9.2). В ней выявлялись редкие рассеянные гипохромные клеточные ядра. По периферии зоны деструкции располагалась область плотного компактно сгруппированного расположения ядер клеток (область воспалительного клеточного ответа). Воспалительная клеточная инфильтрация зоны инфаркта ткани мозга была выражена менее значительно, чем у крыс группы 2 (рис. 10.4). На 7 сутки, после моделирования ИИ, нейронов в зоне деструкции ткани мозга не обнаружено. У крыс группы 3 обнаружено больше зернистых шаров, по сравнению с животными группы 2 (рис. 11.1). Обращает внимание наличие у крыс группы 3 по периферии области инфаркта мозга значительного количества новообразованных капилляров, прорастающих вглубь зоны деструкции, в отличие от животных группы 2 (рис. 11.2). У животных 3 группы глиомезодермальный рубец выглядит более сформированным по сравнению с животными 2 группы (рис. 12.1).
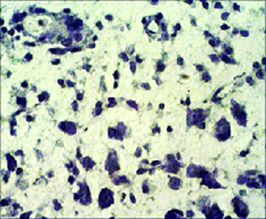
Рис. 13. Срез ткани мозга крысы группы 3. Ув. об. 40. Окраска по Нисслю.
Рис. 14. Срез ткани мозга крысы группы 3. Ув. об. 10. Окраска по Чиаччио.
О большей степени зрелости глиомезодермального рубца свидетельствует более равномерное распределение ядер клеток по зоне деструкции. Это отражает процесс ее организации. Формирующийся глиомезодермальный рубец не блокирует ход нервных волокон. В области формирования глиомезодермального рубца по периферии отмечено появление новообразованных капилляров (рис. 12.2). На 14 сутки, после моделирования ИИ, у крыс группы 3 видно активное формирование зоны деструкции. По ее периферии формируется глиомезодермальный рубец (рис. 13, рис. 14). Он выглядит более зрелым и гораздо менее плотным по сравнению с животными 2 группы (рис. 13, рис. 14).
Таким образом, проведение ТЭС-терапии после моделирования ИИ уменьшает степень повреждения мозга в зоне ишемии. Необходимо отметить, что благодаря протективному влиянию ТЭС-терапии не происходило расширения зоны инфаркта (за счет пенумбры). Все выявленные эффекты ТЭС-терапии дают возможность использовать ее в практике терапии острого ИИ в острейший период.
Рецензенты:
Гуменюк С.Е., д.м.н., профессор, заведующий кафедрой хирургии стоматологического и педиатрического факультетов ГБОУ ВПО КубГМУ Минздрава России, г. Краснодар.
Цымбалов О.В., д.м.н., профессор, профессор кафедры хирургической стоматологии и челюстно-лицевой хирургии ГБОУ ВПО КубГМУ Минздрава России, г. Краснодар.
Библиографическая ссылка
Левичкин В.Д., Трофименко А.И., Каде А.Х., Павлюченко И.И., Занин С.А. КОРРЕКЦИЯ ПОКАЗАТЕЛЕЙ ПРООКСИДАНТНО-АНТИОКСИДАНТНОЙ СИСТЕМЫ ПРИ ИШЕМИЧЕСКОМ ИНСУЛЬТЕ ТЭС-ТЕРАПИЕЙ // Современные проблемы науки и образования. 2014. № 4. ;URL: https://science-education.ru/ru/article/view?id=14427 (дата обращения: 06.03.2026).



