Введение
Витамин К относится к классу жирорастворимых витаминов, влияющих на систему гемостаза. К природным витаминам группы К относятся два типа метилированных хиноидных соединений с боковыми цепями, представленными изопреноидными звеньями: витамины К1 и К2. В основе структуры указанных витаминов лежит система 1,4-нафтохинона. Витамин К1 (филлохинон) синтезируется всеми фотосинтезирующими организмами. Витамин К2 (менахинон) синтезируется микрофлорой толстого кишечника. Биологическая роль витаминов группы К заключается в активации факторов свертывающей и противосвертывающей систем млекопитающих [1].
В настоящее время определена физиологическая потребность в витамине К для взрослых - 120 мкг/сутки и для детей - от 30 до 75 мкг/сутки [4].
В медицинской практике препараты растительного происхождения, содержащие филлохинон, используются для коррекции геморрагических осложнений. В Государственную фармакопею 11 издания включены следующие виды лекарственного растительного сырья, обладающие гемостатическим витамин К-зависимым эффектом: кора калины (Соrtex Viburni), столбики с рыльцами кукурузы (Styli cum stigmatis Zeae maydis), листья крапивы (Folia Urticae), трава пастушьей сумки (Herba Bursae pastoris) [3]. Установлено, что витамин К1 также содержится в траве тысячелистника, горца перечного, горца почечуйного и спорыша, что определяет возможность применения указанного сырья при желудочных, маточных и геморроидальных кровотечениях [5]. В Государственной фармакопее, в настоящее время, отсутствуют методики определения филлохинона в растительном сырье. Для оценки целесообразности использования лекарственного растительного сырья в качестве источников витамина К1, актуальной проблемой является решение вопросов стандартизации и разработки методик, направленных на определение содержания филлохинона в растительных объектах.
Цель работы: разработка методики определения витамина К1 в лекарственном растительном сырье.
Материалы и методы исследования
Объектами исследования являлись официнальные виды лекарственного растительного сырья: кора калины, столбики с рыльцами кукурузы, листья крапивы, трава пастушьей сумки. Все виды сырья были приобретены через аптечные сети. Выбор рационального способа определения витамина К1 проводили на основании оценки валидационных характеристик, полученных с помощью хроматографических и спектрофотометрических методов анализа. Для разработки методики количественного определения филлохинона в растительном сырье использовали метод обращенно-фазовой высокоэффективной хроматографии высокого давления (ВЭЖХ) с диодно-матричным детектором на приборе Shimadzu LC-20 Prominence в изократическом режиме в следующих условиях: аналитическая колонка, заполненная сорбентом PerfectSil 300 ODS C18, 4,6х250 мм, с размером частиц 5 мкм; состав подвижной фазы: ацетонитрил–изопропанол-вода в соотношении 75:20:5; детектирование при длине волны 254 нм; температура колонки – комнатная; скорость подвижной фазы 1 мл/мин; объем вводимой пробы 20 мкл. Оценку результатов проводили по величине времени удерживания (tr) филлохинона, совпадающим с показателем tr РСО (20.00±1.00 мин.) и по величине площади пика филлохинона. Обработку результатов производили с использованием программного обеспечения LC Solutions.
Спектрофотометрическое определение содержания витамина К1 проводили на приборе UNICO 2802S в кварцевой кювете с толщиной слоя 1 см.
Обработку результатов выполняли с использованием программы STATISTICA 8.0. Для описания полученных результатов, после проверки нормальности распределения, приводили значение среднего (Xср), стандартного отклонения (S), относительного стандартного отклонения (RSD), дисперсии (S2), доверительного интервала среднего (Δxср) при уровне значимости α=0,05.
В качестве стандартного образца использовали рабочий стандартный образец (РСО) витамина К1, выделенного методом препаративной колоночной хроматографии из гексанового извлечения листьев крапивы двудомной. Рабочий стандартный образец представляет собой желтую вязкую невысыхающую маслянистую жидкость, практически не растворимую в воде, растворимую в органических растворителях и растительных маслах, температура плавления -20ºС. Спектральные характеристики спиртового раствора рабочего стандартного образца (после удаления гексана) представлены на рис. 1.
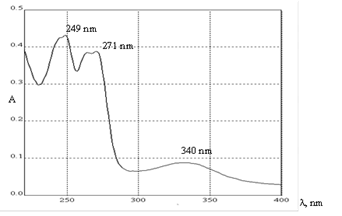
Рис. 1. Спектр в УФ- и видимой области раствора РСО филлохинона (витамина К1)
Для максимального извлечения витамина К1 из исследуемых образцов подбирали следующие параметры пробоподготовки: степень измельченности сырья, вид экстрагента, количественные соотношения сырья и экстрагента, время и кратность экстракции, температурный и световой режим экстрагирования.
Результаты и обсуждение. С целью разработки рационального метода определения содержания витамина К1 были подобраны условия для его извлечения из сырья. В качестве объекта для разработки методики служили листья крапивы. С учетом неустойчивости филлохинона к воздействию световой энергии, все этапы исследования проводили в условиях, предполагающих защиту извлечений от света. Полноту извлечения определяли методом ВЭЖХ по величине площади пика с tr 20.00±2.00 мин. В результате оценки влияния факторов пробоподготовки на полноту извлечения филлохинона были подобраны следующие параметры и условия: измельченность сырья – частицы, проходящие сквозь сито с величиной диаметра отверстий 0,5 мм; экстрагент – гексан; количественное соотношение «сырье:экстрагент» - 1:25; однократная экспозиция в течение 60 мин.; температурный режим – комнатная температура (20-22ºС).
Для разработки методики определения витамина К1 в растениях спектрофотометрическим методом, предварительно был проведен сравнительный анализ спектров поглощений извлечений из фармакопейного сырья (рис. 2) и раствора РСО филлохинона (рис. 1). В результате было установлено, что доказать присутствие витамина К1 в сырье по референтному максимуму (249 нм) не представляется возможным, ввиду отсутствия данного максимума в спектре всех исследуемых объектов. Следовательно, методика определения витамина К1 в суммарном комплексе биологически активных веществ растительного сырья прямым спектрофотометрическим методом изначально не может быть положительно провалидирована по показателю «специфичность». Повысить показатель специфичности методики при использовании спектрофотометрии возможно при условии извлечения из сырья очищенного филлохинона, что требует введения дополнительных препаративных манипуляций на стадии пробоподготовки объекта исследования. Дополнительная очистка извлечения может отрицательно повлиять на экспрессность и точность методики в конечном результате.
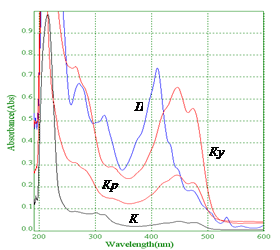
Рисунок 2 – Спектры поглощения извлечений из лекарственного растительного сырья, содержащего филлохинон (Кр – листья крапивы, К – кора калины, Ку – столбики с рыльцами кукурузы, П – трава пастушьей сумки)
Наиболее приемлемым вариантом для определения витамина К1 в растительном сырье представляется использование метода обращенно-фазовой высокоэффективной хроматографии высокого давления (ВЭЖХ) с диодно-матричным детектором. По разработанным параметрам пробоподготовки сырья к анализу была разработана следующая методика: аналитическую пробу сырья измельчают до размера частиц, проходящих сквозь сито с отверстиями диаметром 0,5 мм. Около 1,0 г (точная навеска) измельченного сырья помещают в коническую колбу вместимостью 50 мл, заливают 25 мл гексана, закрывают пробкой и перемешивают на механическом встряхивателе в течение 60 минут. Извлечение фильтруют через бумажный фильтр в круглодонную колбу и отгоняют гексан на ротационном испарителе. Остаток количественно переносят в мерную колбу на 5 мл (пикнометр) с помощью 4 мл этанола. Доводят объем раствора до метки тем же растворителем и перемешивают. 0,02 мл раствора вводят в хроматограф.
Приготовление стандартного образца: К 0,0005 г (точная навеска) РСО филлохинона приливают 4 мл этанола, переносят в мерную колбу вместимостью 5 мл. Доводят объем раствора до метки растворителем и перемешивают. 0,02 мл раствора вводят в хроматограф.
![]() Содержание филлохинона (X) в абсолютно сухом сырье в процентах вычисляют по формуле:
Содержание филлохинона (X) в абсолютно сухом сырье в процентах вычисляют по формуле:
где So – площадь пика на хроматограмме раствора РСО филлохинона; S – площадь пика филлохинона на хроматограмме испытуемого раствора; mo– навеска РСО филлохинона, в г; m – навеска сырья, в г; W - потеря в массе при высушивании сырья, в %; Р – содержание филлохинона в РСО филлохинона, в %.
По результатам количественного определения филлохинона методом обращенно-фазовой ВЭЖХ было определено содержание витамина К1 в листьях крапивы (табл. 1).
Таблица 1 – Метрологическая характеристика метода количественного определения филлохинона в листьях крапивы (%) (n=6)
|
Xmin |
Xmax |
Xср |
S2 |
S |
tα (0,95) |
Xср ± Δхср |
|
0,0041 |
0,0044 |
0,00425 |
0,000000011 |
0,000105 |
2,571 |
0,00425 ± 0,00021 |
Ввиду малого содержания витамина К1 в сырье предлагаем производить расчеты в мг%, для этого необходимо внести изменения в расчетную формулу для перевода единиц измерения (г в мг):
![]()
Валидационную оценку методики проводили по показателям – специфичность, линейность, прецизионность (воспроизводимость) и точность [6].
Специфичность. Идентификация филлохинона подтверждалась совпадением времени удерживания анализируемого компонента в сырье и РСО филлохинона (рис. 3). Пики сопутствующих соединений, входящих в состав извлечений растительного сырья, хорошо разделяются с пиком филлохинона, и не влияют на аналитическое определение.
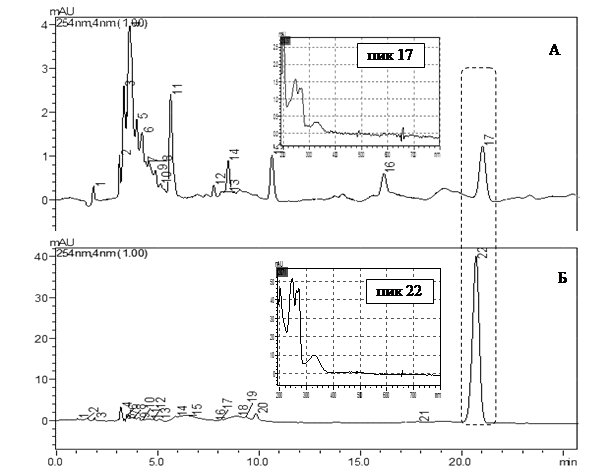
Рис. 3. Хроматограмма извлечения листьев крапивы (А - пик 17,tr =20.37 мин соответствует филлохинону) и рабочего стандартного образца филлохинона (Б – пик 22 ,tr =20.71 мин)
Линейность и аналитическая область методики была подтверждена анализом 7 проб разных концентраций в диапазоне от 13 до 417 % от концентрации (0,12 мг/мл), принятой за 100 %. Сравнение зависимости между содержанием филлохинона (мг/мл) в испытуемых растворах и величинами площадей хроматографических пиков показало, что она имеет линейный характер и описывается уравнением y = 5104417,9 x + 10944,88. Коэффициент корреляции (rxy) равен 0,999, что позволяет использовать данную методику для количественного определения филлохинона в растительных объектах в диапазоне концентраций от 0,016 до 0,5 мг/мл.
Воспроизводимость (прецизионность) определялась путем проведения анализа разными (двумя) аналитиками на одной серии сырья в разное время. Число повторностей для каждого аналитика – 3, общее число повторностей – 6. Относительное стандартное отклонение, выраженное в процентах (RSD, %), не должно превышать 5 % [2]. По результатам проведенных исследований RSD составило 1,21 %, что характеризует надежность анализа в выбранных условиях (табл. 2).
Таблица 2 – Результаты определения прецизионности методики
|
№ пп |
Повторность |
Аналитик |
Определено в образце, мг% |
Метрологические характеристики |
|
1 |
1 |
1 |
4,0410 |
Xср = 4,00525 мг % S = 0,04850 мг %
RSD=1,21 % |
|
2 |
2 |
4,0398 |
||
|
3 |
3 |
4,0408 |
||
|
4 |
1 |
2 |
3,9909 |
|
|
5 |
2 |
4,0021 |
||
|
6 |
3 |
3,9169 |
Для определения точности методики анализировали образцы листьев крапивы из одной партии сырья в 3 уровнях навесок (по 0,5, 1,0 и 1,5 г), трижды проводя отбор проб для каждого уровня. Содержание витамина К1 определяли в мг в навеске сырья. Предварительно рассчитывали ожидаемую (теоретическую) величину, исходя из установленного среднего показателя по содержанию витамина К1 в листьях крапивы, равного 4,1 мг%. Теоретический показатель значения сравнивали с фактическим. Для оценки полученных результатов использовали показатель «открываемость» (R), критерий приемлемости для которого принят в пределах 98-102 % от расчетной величины [6].
Таблица 3 – Результаты определения точности методики
|
№ п/п |
Уровень |
Навеска сырья, в г |
Фактическое содержание филлохинона, мг |
Расчетное содержание филлохинона, мг |
Открываемость (R), % |
(Ri − Rср) |
(Ri − Rср)2 |
Метрологические характеристики |
|
1 |
1 |
0,526 |
0,02133 |
0,02157 |
101,13 |
2,40 |
5,7600 |
Rср=98,73 % S=1,87164 %
RSD=1,90 % |
|
2 |
1 |
0,497 |
0,02061 |
0,02038 |
98,88 |
0,15 |
0,0230 |
|
|
3 |
1 |
0,496 |
0,02009 |
0,02038 |
101,44 |
2,71 |
7,3400 |
|
|
4 |
2 |
1,1456 |
0,04937 |
0,04697 |
95,14 |
-3,59 |
12,890 |
|
|
5 |
2 |
0,9827 |
0,04110 |
0,04029 |
98,03 |
-0,70 |
0,4900 |
|
|
6 |
2 |
1,0056 |
0,04223 |
0,04123 |
97,63 |
-1,10 |
1,2100 |
|
|
7 |
3 |
1,4895 |
0,06191 |
0,06107 |
98,64 |
-0,09 |
0,0081 |
|
|
8 |
3 |
1,5011 |
0,06204 |
0,06155 |
99,21 |
0,48 |
0,2304 |
|
|
9 |
3 |
1,5125 |
0,06298 |
0,06201 |
98,46 |
-0,27 |
0,0730 |
Результаты определения точности методики, представленные в таблице 3, показали, что открываемость R составляет 98,73 %, величина относительного стандартного отклонения (RSD) не превышает 5 %, что характеризует точность методики как удовлетворительную.
Таким образом, установлено, что предлагаемая методика количественного определения витамина К1 методом ВЭЖХ в листьях крапивы является специфичной, воспроизводимой и точной. Данная методика была воспроизведена для определения витамина К1 в других видах лекарственного растительного сырья (табл. 4).
Таблица 4 – Содержание витамина К1 (мг%) в лекарственном растительном сырье
|
Объект (n=6) |
Xср |
S2 |
S |
tα (0,95) |
Xср ± Δхср |
|
Столбики с рыльцами кукурузы |
0,548 |
0,300×10-3 |
0,0172 |
2,571 |
0,548±0,020 |
|
Трава пастушьей сумки |
2,203 |
0,307×10-3 |
0,0175 |
2,203±0,018 |
|
|
Кора калины |
1,667 |
0,707×10-3 |
0,0266 |
1,667 ± 0,028 |
Проведенные исследования показали целесообразность использования метода обращенно-фазовой ВЭЖХ для определения филлохинона в растительном сырье. Преимуществом метода ВЭЖХ является возможность проведения оценки качественного и количественного содержания филлохинона в одной навеске сырья, что существенно экономит временные затраты на анализ. Разработанная методика может быть использована для определения содержания витамина К1 в растительных объектах.
Рецензенты:
Гришин А.В. д.фарм.н., профессор, зав. кафедрой фармации ГБОУ ВПО ОмГМА Минздрава России, г.Омск.
Пеньевская Н.А. д.м.н., доцент, зав. кафедрой фармацевтической технологии с курсом биотехнологии ГБОУ ВПО ОмГМА Минздрава России, г.Омск.
Библиографическая ссылка
Лукша Е.А., Погодин И.С., Калинкина Г.И., Коломиец Н.Э., Величко Г.Н. РАЗРАБОТКА МЕТОДИКИ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ ФИЛЛОХИНОНА (ВИТАМИНА К1) В РАСТИТЕЛЬНЫХ ОБЪЕКТАХ // Современные проблемы науки и образования. 2014. № 3. ;URL: https://science-education.ru/ru/article/view?id=13736 (дата обращения: 11.02.2026).



