Фотокатализ – это изменение скорости или возбуждение химических реакций под действием света в присутствии фотокатализаторов, которые в результате поглощения или квантов света способны вызывать химические превращения участников реакции, вступая с последними в промежуточные химические взаимодействия и регенерируя свой химический состав после каждого цикла таких взаимодействий.[1]
К фотокаталитическим реакциям в гетерогенных системах относят реакции превращения исходных реагентов А в продукты В под действием квантов света на поверхности фотокатализатора К, т.е.:
А+К+hv→В+К
Необходимым условием фотокаталитичности реакции является химическая неизменность фотокатализатора К в конце цикла превращений.
Рассмотрим процессы, происходящие при поглощении кванта света на поверхности диоксида титана. Заполненная валентная зона и свободная зона проводимости TiO2 разделены запрещенной зоной шириной 3,2 эВ [6]. Валентная зона образована преимущественно 2р-орбиталями кислорода, а зона проводимости 3d – орбиталями титана. Координационное число поверхностных атомов титана изменяется от 4 до 6, и все они экранированы друг от друга анионами кислорода.
Под действием излучения с энергией фотона hv больше или равной энергии запрещенной зоны TiO2 происходит возбуждение электрона из валентной зоны в зону проводимости:
TiO2+hv→h+ +e-
Реакция взаимодействия адсорбированной воды или ОН-групп ведет к образованию гидроксильного радикала:
h++>TiIVOH→ (>TiIVOH•)+
h++H2O→ OH•адс+ H+адс
Присутствие радикалов OH• на облучаемом образце диоксида титана с адсорбированной водой обнаружено в работе [3].
Образуемые на поверхности гидроксильные радикалы являются сильными окислителями, принимающими участие в последующем окислении адсорбированных органических и неорганических веществ.
Фотогенерированные электроны участвуют во взаимодействиях с поверхностными акцепторами:
e-+>TiIVOH→(>TiIIIOH); e-+>TiIVOH→>TiIII
и в процессах фотоадсорбции кислорода:
e-+O2адс →O2-адс
Под действием УФ-света диоксид титана может катализировать окисление многих соединений, т.к. на поверхности TiO2 присутствуют реакционно-способные кислородосодержащие частицы. Общепринятым для процессов адсорбции и десорбции кислорода на поверхности TiO2 под действием УФ-света является механизм, предложенный в работе [1]. Суммируя стадии, получаем общее уравнение фотоадсорбции кислорода:
2O-адс+O2=2O2-адс
В работах [3, 10] обнаружено, что при малых покрытиях кислородом дигидроксилированного TiO2 преобладают анион-радикалы O3-, а при больших - O2-.
Таким образом, основную роль в фотокаталитическом окислении играют различные кислородосодержащие частицы, которые образуются при взаимодействии кислорода, поверхностных гидроксильных групп и воды со свободными носителями заряда, генерируемыми при фотооблучении TiO2.
В общем виде процесс превращения органических соединений на поверхности TiO2 под действием УФ-света можно представить в видесхемы (рис. 1) [2]:
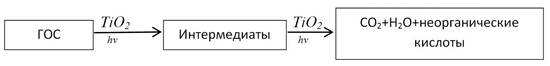
Рис. 1. Процесс превращения органических соединений на поверхности TiO2 под действием УФ-света, где: ГОС – газообразные органические субстраты
В большинстве реакций, особенно это характерно для сложных органических соединений, образуются относительно стабильные интермедиаты, т.е. полное превращение до конечных продуктов – двуокиси углерода и воды. Неорганические кислоты образуются, если в органической молекуле субстрата присутствовал гетероатом – сера, азот или хлор.
При окислении предельных углеводородов в газовой фазе наблюдалось образование различных промежуточных продуктов, появление которых связано с их слабой адсорбцией на поверхности катализатора. Это обуславливает отсутствие в газообразных продуктах спиртов и присутствие альдегидов и кетонов. Такая же ситуация по продуктам превращения прослеживается и для олефинов [4].
Окисление альдегидов и кетонов протекает без образования промежуточных газообразных продуктов [7]. В таблице 1 (в качестве примера) приведены величины конверсий газофазногофотокаталитического окисления некоторых органических веществ (Q=200 мл/мин, Е=500).
Таблица 1. Данные по конверсии ряда загрязнителей воздуха при фотокаталитической минерализации
|
Субстрат |
Концентрация, ppm |
Конверсия, % |
|
Трихлорэтилен |
480 |
99,9 |
|
Ацетон |
467 |
98,7 |
|
Изооктан |
400 |
95,0 |
|
Метанол |
572 |
92,4 |
|
Метилэтилкетон |
497 |
93,6 |
|
Толуол |
560 |
92,4 |
|
Изопропанол |
572 |
83,5 |
Процессы, происходящие при фотоокислении органических соединений на поверхности TiO2 с участием различных носителей заряда, представлены на рис. 2 [2, 5].
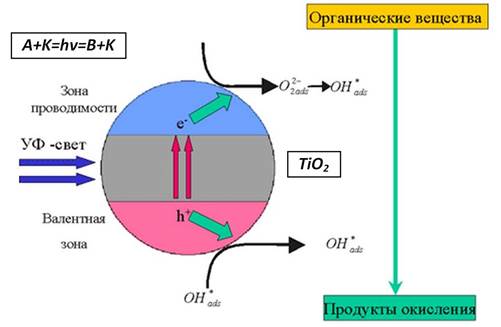
Рис. 2. Процессы, происходящие при фотоокислении органических продуктов на поверхности TiO2
На основании изучения кинетики фотокаталитического разложения веществ:
- определены скорости минерализации основных загрязнителей воздуха в металлургических процессах;
- разработана конструкция и создан фотокаталитический очиститель воздуха С-350;
- разработан способ очистки воздуха от залповых выбросов, которые возможны в металлургических технологиях, используя прототип фотокаталитического очистителя;
- разработана диффузионная модель очистки воздуха в промышленном помещении.
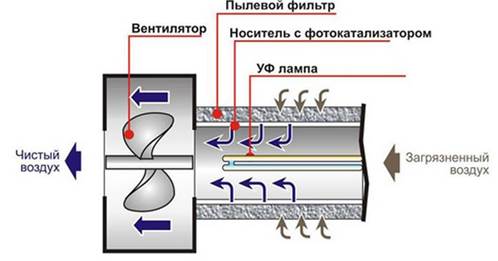
Рис. 3. Схема работы фотокаталитического очистителя воздуха
Технические характеристики очистителя воздуха С-350:
- производительность – 350 м/час;
- напряжение питания – 220 В;
- потребляемая мощность – 220 вт;
- тип источника УФ-света – люминесцентные лампы PhilipsCleoPL-L 36 w;
- интенсивность УФ-света – на поверхности фотокатализатора – 9,2 мВт/см;
- габаритные размеры – 12000мм ×340мм × 340мм;
- масса – 12 кг;
- тип фотокатализатора – платинированный TiO, модифицированный раствором серной кислоты;
- масса фотокатализатора – 8,97 г;
- тип носителя фотокатализатора – волокнистый синтетический нетканый материал;
- на основе ПЭТФ – полиэтилтерефталат;
- производительность – вентилятор – 350 м/час, ВК-125 БИ.
Особенностью данной работы являлось экспериментальное изучение фотокаталитических процессов в условиях, моделирующих состояние воздуха помещений Ново-Липецкого металлургического комбината, результаты представлены в табл. 2.
Таблица 2. Концентрации основных веществ до и после проведения эксперимента
|
№ п/п |
Вещество |
Концентрация до начала эксперимента |
Концентрация после завершения эксперимента |
% конверсии газофазного загрязнителя |
|
1 |
Аммиак |
14,9 ррm (10 мг/м3) |
0,4 мг/м3 |
96% |
|
2 |
Сероводород |
0,009 ррm (0,012 мг/м3) |
0,0003 мг/м3 |
97,5 % |
|
3 |
Фенол |
0,05 ррm (0,2 мг/м3) |
0,006 мг/м3 |
97% |
|
4 |
3,4-бенз(а)пирен |
1*10-7ррm (1*10-6 мг/м3) |
1*10-9 мг/м3 |
99% |
|
5 |
Бензол |
7,8 ррm (24 мг/м3) |
0,2 мг/м3 |
99,2 % |
|
6 |
Пиридин |
0,06 ррm (0,2 мг/м3) |
0,001 мг/м3 |
95% |
|
7 |
Диоксид серы |
0,3 ррm (0,6 мг/м3) |
0,42 мг/м3 |
15% |
|
8 |
Цианистый водород |
0,1 ррm (0,1 мг/м3) |
0,0002 мг/м3 |
99% |
|
9 |
Метан |
228 ррm (144 мг/м3) |
0,87 мг/м3 |
99% |
|
10 |
Ксилол |
2 ррm (8 мг/м3) |
0,25 мг/м3 |
97% |
|
11 |
Толуол |
10,7 ррm (39 мг/м3) |
0,79 мг/м3 |
98% |
|
12 |
Серная кислота |
0,12 ррm (0,5 мг/м3) |
0,28 мг/м3 |
44% |
|
13 |
Этилбензол |
3 ррm (1,2 мг/м3) |
0,02 мг/м3 |
98% |
|
14 |
Нафталин |
0,03 ррm (0,12 мг/м3) |
0,0024 мг/м3 |
98% |
|
15 |
Оксид углерода |
44 ррm (35 мг/м3) |
0,9 мг/м3 |
99.9% |
|
16 |
Диметиламин |
0,017ррm (0,033мг/м3) |
0,0019 мг/м3 |
94% |
|
17 |
Формальдегид |
0,09ррm (0,1 мг/м3) |
0,001 мг/м3 |
99% |
Рецензенты:
Шаталов Р.Л., д.т.н., профессор, кафедра «Машины и технологии обработки металлов давлением» Университета Машиностроения (МАМИ), г. Москва.
Невская Г.Ф., д.м.н., профессор, зав. кафедрой «Безопасность и экология» Московского государственного открытого университета им. Черномырдина, г. Москва.
[1] Понятие «фотокатализ» дал академик Г.К. Береснев.
Библиографическая ссылка
Курылев В.В., Владимиров С.Н. ПРИНЦИПЫ ОЧИСТКИ ВОЗДУХА ОТ ГАЗООБРАЗНЫХ ЗАГРЯЗНИТЕЛЕЙ ФОТОКАТАЛИЗАТОРАМИ НА ОСНОВЕ TiO2 // Современные проблемы науки и образования. 2014. № 3. ;URL: https://science-education.ru/ru/article/view?id=13484 (дата обращения: 24.01.2026).



