Известно, что многие представители классов сульфонилазотсодержащих соединений (сульфониламидины, амиды, гуанидины, мочевины и др.) обладают высокой биологической активностью и применяются в качестве лекарственных препаратов нового поколения пестицидов, эффективных заменителей сахара, а также в других сферах жизнеобеспечения человека [1, 2, 6]. Поэтому разработка методов синтеза новых классов сульфонил-азотсодержащих соединений является важной проблемой современной химической науки.
В последние годы в качестве структурных блоков для получения сульфонилазотсодержащих соединений широко используются аддукты, комплексы, реакционные частицы и другие интермедиаты, легко образующиеся при взаимодействии триоксида серы с цианогруппами нитрилов и других цианосодержащих соединений.
Перспективными реагентами в этом плане оказываются гетероциклические аддукты нитрилов и триоксида серы – 2,6-дизамещенные 1,4,3,5-оксатиадиазин-4,4-диоксиды [4].
Целью данной работы является изучение новых путей синтеза сульфонилазотсодержащих соединений на основе взаимодействия цианидов с 2,6-дизамещенными 1,4,3,5-оксатиадиазин-4,4,-диоксидами.
Ранее нами было показано, что 2,6-дизамещенные 1,4,3,5-оксатиадиазин-4,4-диоксиды (I) реагируют с дизамещенными цианамидами с образованием различных соединений [4].
В данной работе подробно исследовано влияние природы заместителей (R1 и R2) в диоксиде (I) и возможность использования по аналогии с цианамидами других классов цианосодержащих реагентов в реакции:
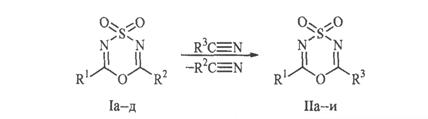
I, R1 = CCl3, R2 = 4-NO2C6H4 (a); R1 = CCl3, R2 = 4-ClC6H4 (б); R1 = CCl3, R2 = CH2=C-CH3 (в); R1 = CBr3, R2 = CH3 (г); R1 = C6F5, R2 = CH3 (д); II, R1 = CCl3, R3 = 4-ClC6H4 (а); R1 = CCl3, R3 = C6H5 (б); R1 = CCl3, R3 = (CH3)2CHS (в); R1 = CCl3, R3 = пиперидино (г); R1 = CBr3, R3 = пиперидино (д); R1 = CBr3, R3 = морфолино (е); R1 = CBr3, R3 = (С2H5)2N (ж); R1 = C6F5, R3 = пиперидино (з); R1 = R3 = CCl3 (и).
В качестве реагентов был взят большой ряд соединений, цианогруппы которых, как сильно нуклеофильны (цианамиды, тиоцианаты), так и напротив, характеризуются большим дефицитом электронной плотности (трихлорацетонитрил).
К раствору соответствующего диоксида (I) в бензоле прибавляли эквимолярное количество цианида и выдерживали при 60˚С в атмосфере осушенного азота. Смесь выдерживали при этой температуре определенное время. Растворитель удаляли, остаток обрабатывали гексаном. Получили диоксиды (II а-и). Продолжительность реакций, выходы, температуры плавления, ИК-спектры диоксидов (II а-и) приведены в табл. 1, спектры ЯМР 1Н диоксидов (II в-д, з) и элементный состав диоксидов (II в, д-з) представлены в табл. 2. ИК-спектры соединений записаны на спектрофотометрах UR-20 и Specord 80-M в метиленхлориде. Спектры ЯМР 1Н записаны на спектрометре Gemini 300 (рабочая частота 300 МГц), внутренний стандарт – ТМС.
Таблица 1
Продолжительность реакции, выходы, температуры плавления и ИК-спектры диоксидов (II а-и)
|
№ соединения |
Время, ч (60˚C, C6H6) |
Выход, % |
Т. пл. (разл.), ˚C |
ИК-спектр, |
|
|
SO2 |
C=N |
||||
|
IIа |
7 |
96 |
125-126а |
1190, 1350 |
1635, 1730 |
|
IIб |
4 |
97 |
152-154б |
1200, 1400 |
1640, 1725 |
|
IIв |
4 |
95 |
127 |
1180, 1350 |
1635, 1725 |
|
IIг |
5 |
85 |
144в |
1170, 1395 |
1680, 1750 |
|
IIд |
5 |
94 |
152 |
1180, 1375 |
1650, 1725 |
|
IIе |
5 |
89 |
178 |
1185, 1360 |
1650, 1720 |
|
IIж |
5 |
93 |
139 |
1180, 1360 |
1655, 1720 |
|
IIз |
9 |
93 |
138 |
1185, 1360 |
1670, 1730 |
|
IIи |
9 |
94 |
146-147 |
1185, 1385 |
1720 |
Примечание. а Лит. т. пл. 125-126˚С [5]. б Лит. т. пл. 153-155˚С [5]. в Лит. т. пл. 144˚С [5].
Таблица 2
Спектры ЯМР 1Н и данные элементного анализа диоксидов (IIв-з)
|
№ соединения |
Спектр ЯМР 1Н, δ, м. д. |
Найдено/вычислено, % |
Формула |
||||
|
С |
Н |
Hlg |
N |
S |
|||
|
IIв |
1.24 д (6Н, СН3), 3.12-3.84 м (1Н, СН)а |
23.07 23.11 |
2.19 2.25 |
34.21 34.19 |
4.50 4.49 |
20.50 20.58 |
C6H7Cl3NO3S2 |
|
IIг |
1.48-1.84 м (6Н, СН2),3.44-3.82т [4H, (CH2)2N]б |
- |
- |
- |
- |
- |
- |
|
IIд |
1.75-1.99 м (6H, CH2),3.50-3.81т [4H, (CH2)2N]б |
20.75 20.53 |
2.13 2.15 |
51.11 51.22 |
8.81 8.98 |
6.83 6.88 |
C8H10Br3N3O3S |
|
IIе |
- |
17.95 17.90 |
1.70 1.72 |
51.10 51.04 |
8.98 8.94 |
6.80 6.78 |
C7H8Br3N3O4S |
|
IIж |
- |
18.48 18.45 |
1.10 1.11 |
52.62 52.60 |
5.25 5.27 |
7.00 7.08 |
C7H5Br3N2O3S |
|
IIз |
1.55-1.70 м (6Н, СН2),3.50-3.65т [4H, (CH2)2N]б |
40.81 40.74 |
2.60 2.63 |
24.72 24.78 |
10.75 10.96
|
8.32 8.35 |
C13H10F5N3O3S |
Примечание. а Спектр ЯМР 1Н в CDCl3. б Спектры в ацетоне-d6.
В результате работы выявлено, что направление взаимодействия цианогруппы реагента контролируется также, прежде всего, электронными эффектами заместителей в субстрате (I).
Установлено, что замена иминного фрагмента R2CN в субстрате протекает при взаимодействии диоксидов (I), имеющих сильные акцепторные группы R1 (CCl3, CBr3, C6F5) и слабые электроноакцепторные или донорные группы R2 (4-NO2C6H4, 4-ClC6H4, CH3). Это направление реализуется, как правило, при использовании в реакции соединений, имеющих более нуклеофильные цианогруппы по отношению к нитрилу, выделяемому в реакции из цикла диоксида (I).
Также установлено, что при резком увеличении электроноакцепторных свойств заместителя R2 в диоксиде (I) (R2 = CCl3) и повышении нуклеофильности цианогруппы в цианиде R3CN (при использовании в реакции вместо нитрилов цианамидов) изменяется направление реакции. В этом случае происходит образование 2,4,6-тризамещенных 1,2,3,5-оксатиадиазин-2-оксидов, описанных в работе [3].
Полученные в ходе работы данные позволяют предположить пути протекания реакции. Замещение иминного фрагмента протекает с участием во взаимодействии с цианогруппой электрофильного атома серы и нуклеофильного атома кислорода цикла диоксида (I). Можно полагать, что различия в поведении цианидов, содержащих сильнодонорные группы, с одной стороны, и сильноакцепторные - с другой, обусловлены образованием в реакции различных интермедиатов. Диоксиды (I), имеющие сильноакцепторные (R1 = CCl3, CBr3, C6F5) и менее акцепторные группы (R2 = 4-NO2C6H4, C6H5, CH2=C(CH3), CH3) реагируют с нитрилами, имеющими донорные или слабоакцепторные группы (C6H5, 4-ClC6H4), по-видимому, по типу [4+2]-циклоприсоединения.
В реакциях тех же диоксидов с цианамидами и тиоцианатами, цианогруппы которых обладают более высокой нуклеофильностью за счет сильных пара-донорных групп, больший вклад во взаимодействие вносится за счет координирования атомов серы в диоксиде (I) и азота цианогруппы и реакция идет по типу замещения.
При взаимодействии указанных диоксидов (I) с трихлорацетонитрилом, характеризующимся большим дефицитом электронной плотности на цианогруппе, больший вклад вносится за счет координирования атома кислорода гетероцикла (I) и атома углерода цианогруппы.
Если же исходный диоксид (I) имеет два сильных акцепторных заместителя R1 и R2, его взаимодействие с достаточно нуклеофильными цианогруппами (цианамиды) не приводит к образованию продуктов переиминирования.
Таким образом, выявлены четкие критерии осуществимости реакции 2,6-дизамещенных 1,4,3,5-оксатиадиазин-4,4-диоксидов с нитрилами, тиоцианатами и N,N-дизамещенными цианамидами, селективно протекающей с заменой иминного фрагмента в исходном субстрате соответствующим фрагментом цианида. Эта реакция позволит целенаправленно вводить заместители с заданными свойствами в молекулу диоксида (I), не нарушая ее гетероциклической структуры.
Рецензенты:
Казанцев О.А., д.х.н., профессор кафедры «Химическая технология органических веществ», заместитель директора по научно-исследовательской работе, Дзержинский политехнический институт (филиал) федерального государственного бюджетного образовательного учреждения высшего профессионального образования «Нижегородский государственный технический университет имени Р.Е. Алексеева», г. Дзержинск;
Данов С.М., д.т.н., профессор, заведующий кафедрой «Химическая технология органических веществ», Дзержинский политехнический институт (филиал) федерального государственного бюджетного образовательного учреждения высшего профессионального образования «Нижегородский государственный технический университет имени Р.Е. Алексеева», г.Дзержинск.
Библиографическая ссылка
Сажина Е.Н. РЕАКЦИЯ ПЕРЕИМИНИРОВАНИЯ КАК ПУТЬ К НОВЫМ С-ЗАМЕЩЕННЫМ 1,4,3,5-ОКСАТИАДИАЗИН-4,4-ДИОКСИДАМ // Современные проблемы науки и образования. 2014. № 3. ;URL: https://science-education.ru/ru/article/view?id=13025 (дата обращения: 11.02.2026).



