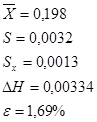Введение
Одним из актуальных лекарственных препаратов, применяемых для лечения ишемической болезни сердца, инфаркта миокарда и др., является рибоксин [1, 2]. Он выпускается промышленностью в виде таблеток, покрытых оболочкой по 0,2 г и 2 % раствора для инъекций. При пероральном приеме препарата возможны побочные действия: раздражающее – на желудочно-кишечный тракт, тошнота, аллергические реакции и др. Устранить побочные реакции лекарственных веществ способны ректальные лекарственные формы [3].
Целью исследования явилась разработка состава, технологии и стандартизация рациональной лекарственной формы – суппозиториев с рибоксином по 0,2 г.
Материалы и методы исследования
В работе использовали методы: спектрофотометрии, хроматографии в тонком слое сорбента, диализа через полупроницаемую мембрану, термического разложения.
Выбор оптимальной основы, биодоступность рибоксина и процесс высвобождения его из суппозиториев исследовали методом диализа через полупроницаемую мембрану.
Для подтверждения подлинности и изучения продуктов деструкции рибоксина использовали метод тонкослойной хроматографии на пластинках «Сорбфил» в оптимальной системе растворителей хлороформ-ацетон (1:1). Проявляли пятна в УФ-свете [4, 5].
Для количественного определения использовали спектрофотометрический метод. Изучение спектров поглощения рибоксина проводили на спектрофотометре СФ-101.
Качество приготовленных суппозиториев оценивали согласно требованиям Государственной фармакопеи XII издания. Для этой цели использовали показатели: описание, подлинность, средняя масса суппозиториев и отклонения от нее, время полной деформации, температура плавления, посторонние примеси, количественное содержание.
Проведена валидационная оценка разработанных суппозиториев. Для этого использовали показатели: линейность, прецизионность, правильность.
Результаты исследования и их обсуждение
При выборе основы суппозиториев использовали липофильные: комплексную жировую основу (КЖО), масло какао, твердый жир типа А, гидрофильные: полиэтиленоксидную (ПЭО) и дифильную – витепсол.
Кинетику высвобождения рибоксина изучали методом равновесного диализа по Крувчинскому через полупроницаемую мембрану при температуре +37 °С. Диализной средой был 1,5 % раствор натрия гидрокарбоната, значение рН которого максимально приближено к рH прямой кишки. Количественное определение рибоксина проводили спектрофотометрическим методом. Результаты приведены на рис. 1.
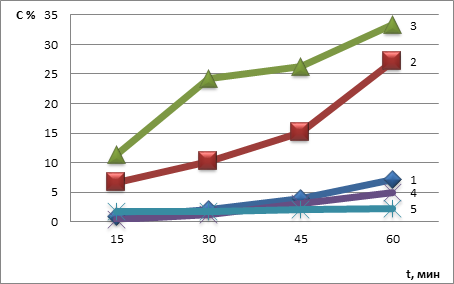
Рисунок 1. График высвобождения рибоксина из суппозиториев с основами:
1 – ПЭО; 2 – витепсол;3 – КЖО; 4 – масло какао; 5 – твердый жир тип А
Установлено, что более полное высвобождение наблюдается из суппозиториев, приготовленных на основе витепсол и комплексной жировой основе.
При выборе вспомогательных веществ использованы: аэросил, эмульгатор № 1, поливиниловый спирт (ПВС), твин-80. Вспомогательным веществом выбран твин-80, в присутствии которого высвобождается наибольшее количество рибоксина. Установлено, что включение в состав основы 3 % твина-80 оказывает пролонгирующее действие на высвобождение рибоксина.
Метод тонкослойной хроматографии был использован нами для подтверждения подлинности, изучения стабильности рибоксина и обнаружения возможных продуктов деструкции [5]. Для работы были использованы ряд систем, описанных в литературе, и пластинки «Сорбфил» (табл. 1).
Таблица 1. Результаты выбора системы растворителей
|
Состав системы |
Rf |
Время анализа, мин |
|
Хлороформ–н-бутанол (98:2) |
0,71 |
22 |
|
Хлороформ–ацетон (1:1) |
0,77 |
15 |
|
Хлороформ–этанол (99:1) |
0,91 |
27 |
|
Бензол–этанол(95:5) |
0,86 |
22 |
|
Бензол–этанол(90:10) |
0,82 |
17 |
В результате проведенного эксперимента для анализа была выбрана система растворителей хлороформ–ацетон (1:1).
Для изучения возможных продуктов деструкции было проведено термическое разложение рибоксина. Лекарственное вещество помещали в бюкс и нагревали в сушильном шкафу при температуре 105 °С. Контроль рибоксина проводили через каждые сутки методом тонкослойной хроматографии (ТСХ). Установлено, что через 3 суток у рибоксина обнаружен продукт его деструкции с Rf = 0,1 (рис. 2).

1 2
![]()
Рисунок 2. Хроматограммарибоксина через 3 суток термического разложения
1 – рибоксина СО;
2 – рибоксин после термического разложения в течение 3 суток.
Таким образом, установлено, что при обнаружении на хроматограммерибоксина дополнительного пятна этот образец можно считать не соответствующим требованиям ФС.
Количественное определение рибоксина проводили спектрофотометрическим методом в максимуме поглощения при длине волны 247 нм.
Таблица 2. Результаты определения относительной погрешности определения рибоксина в суппозиториях
|
Ах |
Аст |
mст |
Р1суп |
Навеска, г |
Найдено, г |
Метрологические характеристики |
|
0,418 |
0,425 |
0,2000 |
2,0014 |
1,9981 |
0,197 |
|
|
0,413 |
1,9801 |
0,196 |
||||
|
0,431 |
2,0023 |
0,203 |
||||
|
0,430 |
1,9998 |
0,202 |
||||
|
0,417 |
1,9968 |
0,197 |
||||
|
0,415 |
2,0012 |
0,196 |
Результаты, приведенные в таблице 2, показали, что относительная погрешность анализа рибоксина в суппозиториях не превышает ±1,69 %.
Проведена валидационная оценка спектрофотометрического анализа рибоксина в суппозиториях по показателям: линейность, прецизионность, правильность. Для подтверждения линейности методики построен градуировочный график рибоксина (рис. 3).
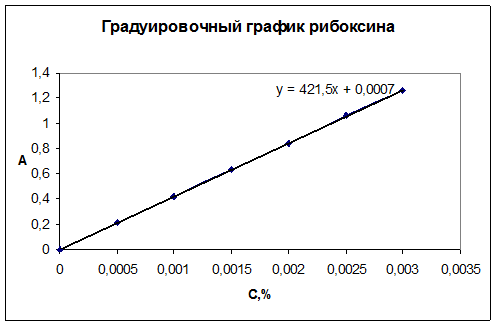
Рисунок 3. Градуировочный график рибоксина
Рассчитаны уравнение градуировочного графика и коэффициент корреляции, равный 0,999, что подтверждает линейность разработанной методики.
Проведено определение прецизионности и правильности методики (табл. 3).
Таблица 3. Результаты определения прецизионности и правильности методик
|
Показатель |
Результаты |
|
прецизионность: относительное стандартное отклонение (RSD) |
1,61 |
|
правильность: открываемость R, % |
100,1 |
Полученные результаты свидетельствуют о валидности методик и возможности их использования для анализа изучаемых суппозиториев.
Проведена стандартизация суппозиториев по показателям: описание, подлинность, средняя масса суппозиториев и отклонения от нее, время полной деформации, температура плавления, посторонние примеси, количественное содержание (табл. 4).
Таблица 4. Результаты стандартизации суппозиториев с рибоксином
|
Показатели качества |
Нормы качества |
Результаты |
|
описание |
суппозитории должны быть белого цвета, торпедообразной формы |
суппозитории белого цвета, торпедообразной формы |
|
подлинность |
на хроматограмме должно наблюдаться одно пятно |
на хроматограмме наблюдается одно пятно |
|
время полной деформации |
не более15 минут |
9-10 минут |
|
температура плавления |
не более 37°С |
35,5-36,5°С |
|
средняя масса суппозитория, г |
1,9-2,1 г |
1,93-2,03 |
|
отклонение от средней массы, % |
±10 |
от +3,1-до -2,7 |
|
посторонние примеси |
на хроматограмме не должно быть дополнительных пятен |
на хроматограмме нет дополнительных пятен |
|
количественное содержание рибоксина, г |
0,18-0,22 |
0,185-0,208 |
Установлено, что приготовленные суппозитории по всем показателям качества соответствуют требованиям, предъявляемым к данной лекарственной форме (табл. 4).
Для того чтобы оценить качество изготовленных суппозиториев, мы хранили их в холодильнике (4±1) ºС, подвергая контролю через 6, 12, 18, 24 месяца с помощью химических и физико-химических методов исследования. С этой целью готовили суппозитории, упаковывали их в контурные упаковки из полимерных материалов.
Оценку качества проводили по указанным выше показателям.
Результаты визуального контроля показали, что внешний вид суппозиториев не менялся в течение всего срока наблюдения, а суппозиторная масса оставалась однородной.
Установлено, что количество действующего вещества в процессе хранения суппозиториев практически не изменялось.
При испытании на подлинность на хроматограмме наблюдалось одно пятно, соответствующие по величине значению Rf пятна СО рибоксина.
При проведении хроматографического анализа на пластинках отсутствовали дополнительные пятна, что свидетельствовало об отсутствии продуктов деструкции.
Температура плавления не превышала 36,5 °С, также не наблюдалось ее снижения. Время полной деформации суппозиториев не превышало 15 мин и составляло в процессе хранения 9–10 мин.
Средняя масса суппозиториев оставалась стабильной.
На основании проведенных исследований можно сделать заключение: разработанные суппозитории стабильны в течение 24 мес., что позволяет установить срок их хранения – 2 года.
Выводы. Разработана технология суппозиториев с рибоксином, выбрана оптимальная основа и вспомогательное вещество. Разработана методика идентификации рибоксина и продукта его деструкции методом хроматографии в тонком слое сорбента. Разработана методика количественного анализа рибоксина в суппозиториях спектрофотометрическим методом. Проведена стандартизация суппозиториев и установлен срок их хранения – 2 года.
Рецензенты:
Андреева И.Н., д.фарм.н., профессор кафедры «Туризм» института сервиса и технологий (филиал) ФГБОУ ВПО «Донской государственный технический университет» в г. Пятигорске, г. Пятигорск.
Молчанов Г.И., д.фарм.н., профессор кафедры экономики и управления Пятигорского филиала ГОУ ВПО Российского государственного торгово-экономического университета, г. Пятигорск.
Библиографическая ссылка
Степанова Э.Ф., Саенко А.Ю., Компанцев Д.В., Петров А.Ю., Куль И.Я. СОЗДАНИЕ СУППОЗИТОРИЕВ С РИБОКСИНОМ: ТЕХНОЛОГИЯ, БИОФАРМАЦЕВТИЧЕСКАЯ ХАРАКТЕРИСТИКА, СТАНДАРТИЗАЦИЯ // Современные проблемы науки и образования. 2014. № 2. ;URL: https://science-education.ru/ru/article/view?id=12862 (дата обращения: 15.02.2026).