В настоящее время в связи с распространением селенодефицитных состояний проводится синтез и изучение биологической активности селеноорганических соединений. Для лечения и профилактики селенодефицита у сельскохозяйственных животных и птиц применяется селеноорганический препарат ДАФС-25, для которого установлена антиоксидантная, антитоксическая и иммуномодулирующая активность [1; 3; 8]. Ранее установлено антиоксидантное и антитоксическое действие препарата ДАФС-25 и его производных [8; 9].
В связи с этим целью настоящей работы явилось изучение влияния 1,5-ди-(п-хлорфенил)-3-селенапентандион-1,5 на свободнорадикальное окисление, антиоксидантный статус, функциональное состояние тканей и отдельные стороны обмена веществ у белых беспородных мышей.
Материалы и методы
В работе использовали селеноорганическое соединение 1,5-ди-(м-нитрофенил)-3-селенапентандион-1,5 (соединение 1), которое растворяли в растительном масле (рис. 1). Соединение любезно предоставлено д.х.н., профессором Б.И. Древко.
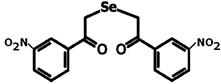
Соединение 1
Рис. 1. Соединение 1 - 1,5-ди-(м-нитрофенил)-3-селенапентандион-1,5
Эксперимент проводили на самцах белых беспородных мышей возрастом 2 месяца и массой 20 г. Каждая группа мышей включала 7 животных. Животным первой группы (контроль) вводили per os растительное масло в количестве 10 мкл. Животным опытной группы вводили per os соединение 1 в количестве 10 мкл, с дозой 800 мкг/кг. Эксперимент проводили в течение 14 дней. Все работы с лабораторными мышами проводили согласно принципам гуманного отношения к животным в соответствии с «Международными рекомендациями по проведению медико-биологических исследований с использованием животных», «Правилами проведения работ с использованием экспериментальных животных» и «Правилами лабораторной практики в Российской Федерации» (приказ МЗ РФ № 267 от 19.06.2003). Кровь собирали в пробирку с гепарином. Состояние здоровья животных оценивалось по основным биохимическим показателям плазмы крови, а также показателям свободнорадикального окисления и антиоксидантного статуса. Биохимический анализ включал определение в сыворотке крови активности ферментов (g-глутамилтрансферазы (ГГТ), аланинаминотрансферазы (АлАТ), аспартатаминотрансферазы (АсАТ)), состояния белково-образующей функции печени (альбумин, общий белок) и мочевыделительной системы (креатинин, мочевина), а также определение концентрации глюкозы и холестерина. Для проведения клинико-лабораторного исследования сыворотки крови опытных животных использовали полуавтоматический анализатор Hospitex Screen master plus с использованием стандартных наборов реактивов фирмы ЗАО «Диакон ДС» (Россия). Для оценки свободнорадикального окисления и антиоксидантного статуса в цельной крови определяли активность фермента глутатионпероксидазы (ГПО) на полуавтоматическом анализаторе Hospitex Screen master plus с использованием наборов реактивов фирмы Randox (UK). После центрифугирования цельной крови получали плазму крови и эритроциты. Гомогенаты печени, почек, мозга и легких готовили путем гомогенизации с использованием фосфатного буфера. В плазме, гемолизате эритроцитов и гомогенаты тканей определяли активность ферментов супероксиддисмутазы (СОД) [2] и каталазы [4], а также содержание диеновых конъюгатов (ДК) [5] и малонового диальдегида (МДА) [6]. Определение проводили на фотоэлектроколориметре КФК-3.
Статистическую обработку полученных данных осуществляли на персональном компьютере при помощи программы Microsoft Office Excel. Большинство данных не удовлетворяют закону нормального распределения случайной величины, поэтому для сравнения значений использовали Т-критерий Манна-Уитни, на основании которого оценивали уровень доверительной вероятности 1-α (комплементарная ей величина α называется уровнем значимости). Критический уровень доверительной вероятности при проверке статистических гипотез принимали равным 1-α=0,95 (критический уровень значимости α=0,05), что соответствует показателю достоверности p [7].
Результаты и их обсуждение
Результаты биохимического анализа плазмы крови мышей представлены в таблице 1.
Таблица 1. Биохимические показатели плазмы крови мышей
|
Показатель |
Группы животных |
|
|
Контрольная |
Опытная |
|
|
Глюкоза, ммоль/л |
3,71±1,03 |
1,96±0,15 |
|
Общий белок, г/л |
69,58±3,88 |
75,68±2,44 |
|
Альбумин, г/л |
32,94±3,01 |
31,84±1,41 |
|
Креатинин, мкмоль/л |
36,38±3,74 |
58,92±4,85* |
|
Мочевина, ммоль/л |
3,97±0,675 |
4,86±0,15 |
|
Холестерин, ммоль/л |
1,34±0,15 |
1,35±0,17 |
|
АлАТ, МЕ |
44,81±8,25 |
59,28±9,45 |
|
АсАТ, МЕ |
101,13±11,28 |
168,14±11,51* |
|
ГГТ, МЕ |
14,36±1,25 |
16,42±1,79 |
* - Р<0,05
Согласно полученным результатам, селеноорганический препарат не оказывал значительного токсического действия на организм экспериментальных животных. Однако можно отметить увеличение активности АсАТ на 66,3% и увеличение концентрации креатинина плазмы крови на 61,9% у мышей опытной группы (Р<0,05) (табл. 1).
В нашей работе для оценки влияния селеноорганического препарата на свободнорадикальное окисление и антиоксидантный статус проводилось изучение содержания диеновых конъюгатов (ДК) и малонового диальдегида (МДА) и активности антиоксидантных ферментов: каталазы и СОД в плазме крови и гемолизате эритроцитов, гомогенатах органов (печени, почек, мозга и легких), а также активности ГПО в цельной крови.
Под действием соединения 1 у экспериментальных животных снижалась концентрация МДА в гемолизате эритроцитов (63,1%), плазме (62,5%), гомогенатах мозга (48,9%) и легких (22,4%), а также концентрация ДК в гомогенате мозга (24,3%). Следует отметить лишь незначительное увеличение содержания ДК в гомогенате почек на 24,3% (табл. 2).
Таблица 2. Антиоксидантные показатели у мышей контрольной и опытной групп
|
Исследуемый показатель |
Эритроциты |
Плазма крови |
Гомогенаты тканей |
||||
|
печени |
мозга |
легких |
почек |
||||
|
ДК, ммоль/л |
Контрольная группа |
1,64± 0,06 |
0,65± 0,01 |
4,19± 0,47 |
6,88± 0,32 |
11,59± 0,92 |
3,35± 0,19 |
|
Опытная группа |
1,74± 0,08 |
0,73± 0,04 |
4,87± 0,26 |
5,21± 0,27* |
13,13± 0,17 |
4,51± 0,18* |
|
|
МДА, ммоль/л |
Контрольная группа |
0,84± 0,05 |
0,08± 0,02 |
3,36± 0,03 |
7,97± 0,18 |
3,88± 0,14 |
2,03± 0,23 |
|
Опытная группа |
0,31± 0,02* |
0,03± 0,002* |
3,69± 0,43 |
4,07± 0,19* |
3,01± 0,22* |
1,74± 0,28 |
|
|
Каталаза, ммоль/ (мин·л) |
Контрольная группа |
0,31± 0,03 |
0,13± 0,01 |
0,04± 0,003 |
0,03± 0,002 |
0,01± 0,001 |
0,04± 0,01 |
|
Опытная группа |
0,97± 0,07* |
0,32± 0,03* |
0,17± 0,01* |
0,04± 0,003* |
0,05± 0,01* |
0,07± 0,01* |
|
|
СОД, усл. ед. |
Контрольная группа |
1291,67± 89,5 |
1121,31± 112,5 |
1436,16± 84,3 |
895,33± 83,5 |
3121,76± 142,2 |
1806,83± 71,9 |
|
Опытная группа |
18333,33± 1102,2* |
2954,67± 153,6* |
3422,86± 145,6* |
1591,87± 46,7* |
4511,67± 263,4* |
3551,67± 172,3* |
|
Примечание: * - р<0,05.
Антиоксидантное действие селеноорганического соединения также характеризовалось увеличением активности ферментов каталазы, СОД и ГПО. Активность каталазы возрастала в гемолизате эритроцитов (на 213%), плазме (146%), гомогенатах печени (325%), мозга (33,3%), легких (400%) и почек (75%).
Активность СОД также значительно возрастала во всех исследованных образцах крови и тканей: в гемолизате эритроцитов (в 14 раз), плазме (на 163,5%), гомогенатах печени (138,3%), мозга (77,8%), легких (44,5%) и почек (96,6%).
У мышей, получавших перорально соединение 1, активность селенозависимой ГПО возрастала на 98,9% по сравнению с контролем (табл. 3).
Таблица 3. Активность глутатионпероксидазы (ГПО) в цельной крови у мышей всех групп
|
Определяемый показатель |
Контрольная группа |
Опытная группа |
|
ГПО, ед/ г Hb |
365,31 ±13,4 |
726,52± 33,5* |
Примечания: * - р<0,05.
Подводя итог полученным результатам, следует отметить, что исследованное селеноорганическое соединение наиболее эффективно оказывало, с одной стороны, небольшой нефротоксический эффект (за счет повышения концентрации креатинина в плазме крови), а с другой - обладало антиоксидантной активностью в тканях белых мышей, в первую очередь в мозге и легких. Наименьшая антиоксидантная активность исследованных соединений обнаружена в клетках печени и почек, поскольку в печени происходит детоксикация ксенобиотиков, а почки участвуют в их выведении.
Селеноорганическое соединение обладало высокой антиоксидантной активностью, что выражалось в значительном снижении реакций ПОЛ в мозге, легких, эритроцитах и плазме.
Как было описано ранее [8], выраженная антиоксидантная активность соединения 1,5-ди-(м-нитрофенил)-3-селенапентандион-1,5 обусловлена, как предполагается, освобождением атома селена из соединения и включением его в активный центр главного антиоксидантного фермента ГПО. Освобождение атома селена из этого соединения возможно благодаря разрыхлению связей C-Se в их молекулах. Этому способствуют карбонильные группы в составе исследованных соединений, которые обладают отрицательным индуктивным эффектом и способны оттягивать на себя электроны, приводя к разрыхлению связи C-Se и освобождению атома селена из молекулы. Нитрогруппа в составе препарата 1 способна вызывать разрыхление связи C-Se, т.к. она обладает отрицательным мезомерным эффектом и способна оттягивать на себя электронную плотность в сопряженной системе [8; 10].
Заключение
Учитывая незначительную токсичность и высокую антиоксидантную активность соединения 1,5-ди-(м-нитрофенил)-3-селенапентандион-1,5, можно рекомендовать это соединение для дальнейших исследований с целью создания нового препарата, содержащего селен в биодоступной органической форме.
Рецензенты:
Горошинская И.А., д.б.н., профессор, руководитель биохимической лаборатории ФГБУ «Ростовский научно-исследовательский онкологический институт» Минздрава России, г. Ростов-на-Дону.
Коннова С.А., д.б.н., профессор, зав. кафедрой биохимии и биофизики ФГБУ ВПО «Саратовский государственный университет им. Н.Г. Чернышевского» Минобрнауки России, г. Саратов.
Библиографическая ссылка
Русецкая Н.Ю. АНАЛИЗ БИОЛОГИЧЕСКОЙ АКТИВНОСТИ СЕЛЕНООРГАНИЧЕСКОГО СОЕДИНЕНИЯ 1,5-ДИ-(М-НИТРОФЕНИЛ)-3-СЕЛЕНАПЕНТАНДИОН-1,5 // Современные проблемы науки и образования. 2014. № 3. ;URL: https://science-education.ru/ru/article/view?id=12752 (дата обращения: 11.02.2026).



