Введение
Наиболее перспективной технологией получения чистых и сверхчистых железорудных концентратов является химическое обогащение железных руд, которое изучается во многих странах [3]. В лабораторных исследованиях и промышленных испытаниях получены с помощью химического обогащения, сверхчистые железорудные концентраты с содержанием примесей на уровне сотых долей процента [4].
Системные исследования, проведенные в Томском политехническом университете, показали возможность очистки рядовых железорудных концентратов, предназначенных для доменного получения железа, растворами кислот от кальция и магния [5, 6]; при этом наиболее полная очистка наблюдается при обработке исходного концентрата 10–20 %-й азотной кислотой одновременно с процессом его измельчения [7].
Во всех железных рудах и рядовых концентратах основной примесью являются соединения кремния, очистка от которых обеспечивается растворами щёлочи – гидроксида натрия. Изучен процесс выщелачивания кремния в широком интервале концентраций щёлочного раствора при температурах ниже температур кипения растворов, то есть при атмосферном давлении [8] и при повышенных температурах в автоклаве [9, 10].
Следует иметь в виду, что во всех исследованиях по химическому обогащению железных руд основное внимание уделяется определению технологических параметров выщелачивания, тогда как изучению скорости и механизма процессов, протекающих при выщелачивании, не уделяется должного внимания. В этой статье мы частично заполняем этот пробел математическим описанием процесса выщелачивания кремния из рядового Криворожского концентрата растворами гидроксида натрия при атмосферном давлении.
Результаты экспериментов
Математическое описание процесса относится к опытным данным по выщелачиванию кремния из рядового Криворожского концентрата при температурах ниже температур кипения растворов, которые приведены в работе [8] и здесь на рис. 1, 2 и 3.
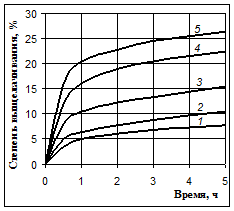
Рис. 1. Выщелачивание кремния при 100 °С раствором NaOH с массовой долей 10 % (1), 20 % (2), 30 % (3), 40 % (4) и 50 % (5)
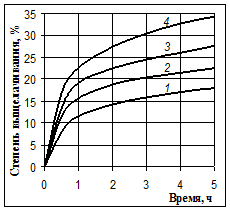
Рис. 2. Выщелачивание кремния 40 %-м NaOH при 80 °С (1), 100 °С (2), 115 °С (3) и 125 °С (4) без перемешивания пульпы
На этих рисунках видно, что после 30 минутного выщелачивания происходит резкое уменьшение скорости процесса. Но равновесие реакции между оксидом кремния и гидроксидом натрия смещено вправо, и с термодинамической стороны нет причин для прекращения этой реакции. Растворимость силиката натрия в щелочах достаточно высока: известно, что растворы с содержанием SiO2 до 20 г/л при концентрации NaOH 70 г/л вполне устойчивы [1].
В наших опытах [8] максимальная концентрация кремния (в
расчёте на SiO2) к концу
5-часового выщелачивания, при температуре 130 °С и при массовой доле NaOH 50 %, составляет 1,82
г/л, то есть предел насыщения раствора силикатом натрия далеко не достигнут.
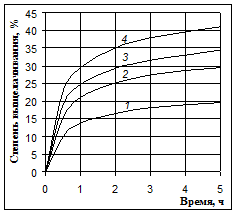
Рис. 3 Выщелачивание кремния 40 %-м NaOH при температурах 80 °С (1), 100 °С (2), 115 °С (3) и 125 °С (4) c перемешиванием пульпы
Вместе с кремнием выщелачивается алюминий (вследствие амфотерности его оксида и гидроксида). Тогда при совместном присутствии в щелочном растворе силиката и алюминия натрия их растворимость уменьшается ввиду образования малорастворимого гидроалюмосиликата натрия Na2O·Al2O3·2SiO2·2H2O. Растворимость этого соединения в воде при 100 °C составляет 3,2 г/л по SiO2, а в растворе гидроксида натрия с массовой долей 40 % при 140 °C – 4,0 г/л по SiO2 и 7,1 г/л по Al2O3 [11]. Полученные в наших опытах концентрации по SiO2 в 3–4 раза меньше, и с этой точки зрения также нет причины для торможения процесса.
Тормозящее влияние на процесс выщелачивания могут оказывать нерастворимые компоненты исходного рядового концентрата – соединения железа, толщина слоя которых увеличивается по мере протекания реакции.
Основанием для этого утверждения является наблюдаемое в опытах [7] увеличение степени выщелачивания при уменьшении размера частиц руды. Следовательно, в изученных условиях процесс выщелачивания кремния протекает в диффузионном режиме. Но окончательные выводы о кинетике процесса выщелачивания возможны по результатам математической обработки экспериментальных результатов.
Обработка экспериментальных результатов
Математическая обработка экспериментальных результатов проведена по уравнению для самотормозящихся реакций [2]:
![]() ln
ln![]() –
b·
–
b·![]() = M
= M
в котором t – время от начала опыта,
a – степень извлечения примеси (в данном случае кремния),
b и M – постоянные величины, которые учитывают характеристики реагентов и условия проведения и которые не изменяются или незначительно изменяются в ходе реакции:
![]() ,
, ![]()
где V – объём раствора, C – начальная концентрация щёлочи в растворе, S – поверхность раздела фаз (поверхность твёрдого вещества), B – отношение объёма раствора к объёму твёрдого вещества, m – коэффициент перехода от концентрации щёлочи в объёме к поверхностной концентрации, K – константа скорости реакции первого порядка, D – коэффициент диффузии раствора в твёрдом веществе.
О применимости данного уравнения может свидетельствовать прямолинейность экспериментальных результатов в координатах:
![]() ln
ln![]() ¾
¾ ![]() ,
,
и если уравнение приемлемо, то опытные данные укладываются на прямую линию, тангенс угла наклона которой равен коэффициенту b, а отрезок, отсекаемый на вертикальной оси, – коэффициенту М. Соответствующие расчеты нами проведены, и на рис. 4 и 5 построены графики в указанных координатах.
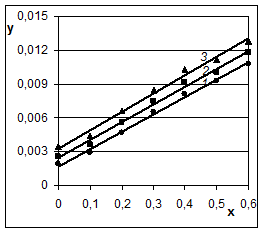
Рис. 4
Результаты
выщелачивания кремния
растворами с массовой
долей NaOH
10 % (1), 20 % (1), 30 %
(1), 40 % (2) и 50 % (3) при 100 °С в координатах уравнения
для самотормозящихся
реакций:
x = ![]() , у =
, у = ![]() ln
ln![]()
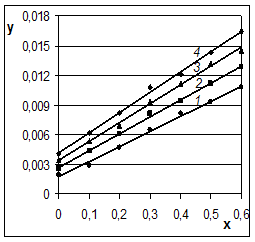
Рис.
5
Результаты
выщелачивания кремния
40%-м NaOH при температурах
80 (1), 100 (2), 115
(3) и 125 °С
(4)
в координатах уравнения
для самотормозящихся
реакций:
x = ![]() , у =
, у = ![]() ln
ln![]()
Из рисунка 4 видно, что экспериментальные точки (они приведены в статье [6]) для растворов с концентрацией гидроксида натрия 10, 20 и 30 % находятся на одной прямой линии, а для растворов с концентрацией 40 и 50 % также находятся на прямых линиях, практически параллельных первой, но смещённых вверх. Следовательно, процесс выщелачивания кремния из железной руды протекает в диффузионной области. При этом повышение концентрации NaOH от 10 до 30 % не изменяет коэффициента диффузии, а при дальнейшем повышении концентрации до 40 и 50 % коэффициент диффузии увеличивается.
Другие соображения вытекают при рассмотрении графиков на рисунке 5. Здесь с повышением температуры увеличивается угол наклона прямых линий, что свидетельствует об увеличении коэффициента b, который имеет смысл коэффициента диффузионного торможения реакции. Увеличение диффузионного торможения можно объяснить тем, что при повышении температуры константы скоростей химических реакций увеличиваются в большей степени, чем коэффициенты диффузии. Поэтому выщелачивание кремния при повышении температуры переходит в более глубокую диффузионную область.
Значения постоянных величин b и M вычислены графическим методом: значение b равно тангенсу угла наклона прямых, значение M равно отрезку на вертикальной оси от начала координат до пересечения с продолжением соответствующей прямой линии графика. Эти значения приведены в таблице ниже.
|
Условия выщелачивания |
Коэффициенты: |
Примечание |
|||
|
Т, °C |
w(NaOH), % |
Ж:Т |
b |
M |
|
|
80 100 113 125 80 100 115 125 150 |
40 40 40 40 40 40 40 40 50 |
10:1 10:1 10:1 10:1 10:1 10:1 10:1 10:1 10:1 |
0,00438 0,00456 0,00467 0,00484 0,00448 0,00481 0,00491 0,00512 0,00529 |
0,0020 0,0020 0,0026 0,0031 0,0005 0,0018 0,0021 0,0026 0,0042 |
Без перемешивания Без перемешивания Без перемешивания Без перемешивания С перемешиванием С перемешиванием С перемешиванием С перемешиванием С перемешиванием |
Из таблицы видно, что при повышении температуры наблюдается небольшое увеличение коэффициента b и заметное (особенно в опытах с перемешиванием) увеличение коэффициента М, которые входят в уравнение для самотормозящихся реакций. Возможно, это свидетельствует об увеличении коэффициента диффузии D, но этого увеличения недостаточно для снятия диффузионного торможения и перевода процесса выщелачивания в кинетическую область. Это заключение подтверждается расчётом энергии активации.
Из-за отсутствия достаточных данных для точного расчета констант скоростей и коэффициентов диффузии было определено приблизительное значение энергии активации процесса выщелачивания, исходя из следующих соображений.
По виду кривых выщелачивания (рис. 1–3) можно предполагать, что после второго часа взаимосвязь между суммарной степенью выщелачивания и продолжительностью процесса может быть описана эмпирическим уравнением:
at = a1 + ![]()
где at – суммарная степень выщелачивания к моменту времени t;
a1 – степень выщелачивания за первый час;
K – постоянная при данной температуре величина.
При вычислении значений К её постоянство в интервале ![]() % наблюдается, начиная с третьего часа
выщелачивания. В опытах с перемешиванием она равна (с–1) 0,042 (80 °C), 0,063 (100 °C), 0,080 (115 °C), 0,097 (125 °C), и 0,128 (140 °C). Эти значения К в координатах уравнения Аррениуcа хорошо укладываются на
прямую линию (рис. 6), по углу наклона которой вычислена энергия активации.
% наблюдается, начиная с третьего часа
выщелачивания. В опытах с перемешиванием она равна (с–1) 0,042 (80 °C), 0,063 (100 °C), 0,080 (115 °C), 0,097 (125 °C), и 0,128 (140 °C). Эти значения К в координатах уравнения Аррениуcа хорошо укладываются на
прямую линию (рис. 6), по углу наклона которой вычислена энергия активации.
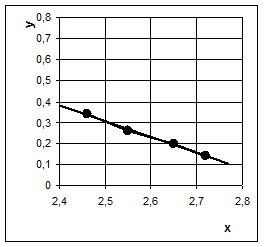
Рис. 6 Опытные данные по низкотемпературному выщелачиванию кремния из Криворожского концентрата при температурах 80–140 °C в координатах уравнения Аррениуса: lnK (y) – 1/T (х)
Величина энергии активации равна 23 кДж/моль, что подтверждает диффузионный характер процесса низкотемпературного выщелачивания при атмосферном давлении.
Выводы
1. Результаты выщелачивания кремния из рядового Криворожского железорудного концентрата, полученные при атмосферном давлении в температурном интервале 80–125 °С, описываются кинетическим уравнением для самотормозящихся реакций.
2. Энергия активации процесса в этом температурном интервале равна 23 кДж/моль, что свидетельствует об ограничении скорости выщелачивания диффузионными процессами.
Рецензенты:Саркисов Ю.С., д.т.н., профессор, заведующий кафедрой химии Томского государственного архитектурно-строительного университета, г. Томск.
Лотов В.А., д.т.н., профессор кафедры силикатов и наноматериалов Томского политехнического университета, г. Томск.
Библиографическая ссылка
Стась Н.Ф. САМОТОРМОЗЯЩИЙСЯ ПРОЦЕСС ВЫЩЕЛАЧИВАНИЯ КРЕМНИЯ ИЗ ЖЕЛЕЗНОЙ РУДЫ // Современные проблемы науки и образования. 2014. № 2. ;URL: https://science-education.ru/ru/article/view?id=12392 (дата обращения: 13.02.2026).



