Введение
Острый перитонит в настоящее время представляет собой наиболее опасное и тяжелое осложнение острых хирургических заболеваний и повреждений органов брюшной полости. Несмотря на то что новые методы интенсивной терапии позволяют достаточно эффективно бороться с патологическим процессом в брюшной полости, летальность при этом остаётся достаточно высокой и варьирует, по данным разных авторов, в зависимости от распространённости патологического процесса, в диапазоне от 9 до 67%, а в ряде случаев приближается к 100% [1; 6; 9].
Крайне тяжёлое состояние больных и летальные исходы при остром перитоните уже в ранние сроки, определяемые порой часами с момента заболевания, обусловлены тяжёлым эндотоксикозом. Развитие эндогенной интоксикации (ЭИ) способствует перенапряжению и в итоге угнетению систем естественной детоксикации, в частности детоксикационной функции печени, что является определяющим в тотальном воздействии токсинов на организм и приводит к развитию полиорганной недостаточности – одной из основных причин смерти [1; 4-6].
Кишечник является одним из первых источников эндотоксинов при остром перитоните. Острое воспаление брюшины приводит к парезу кишечника, нарушению его барьерной функции при прогрессировании патологического процесса и в дальнейшем к развитию энтеральной недостаточности, что вносит весомый вклад в прогрессирование интоксикационного синдрома [7; 8].
Известно, что развитие полиорганной недостаточности при остром перитоните тесно коррелирует с интенсивностью процессов перекисного окисления липидов (ПОЛ), коррекция ее может реализоваться через управление этими процессами [3; 4; 10].
Из большого спектра лекарственных средств, обладающих возможностью устранять нарушения в липидном компоненте биомембран, особого внимания заслуживают те, которые обладают антиоксидантными, мембраностабилизирующими и антигипоксантными свойствами [2-4]. Поскольку в каскаде патологических процессов, приводящих к эндотоксикозу, существенную роль играют мембранодестабилизирующие явления, обусловленные гиперактивацией ПОЛ, то становится очевидным необходимость изучения фармакологической эффективности препаратов метаболического типа действия.
Цель исследования
В условиях эндогенной интоксикации перитонеального происхождения установить фармакологические эффекты производных 3-оксипиридина этоксидола и мексидола по повышению детоксикационной способности организма.
Материалы и методы исследования
Основой работы явились экспериментальные исследования на 34 взрослых беспородных собаках обоего пола массой от 8,7 до 12,4 кг (3 группы) с одобрения локального этического комитета в соответствии с международными правилами обращения с экспериментальными животными (табл. 1). У 8 здоровых животных изучены исследуемые показатели, которые были приняты за норму.
В послеоперационном периоде всем животным проводили инфузионную терапию (внутривенные введения 5%-ного раствора глюкозы и 0,89%-ного раствора хлорида натрия из расчета 50 мл/кг). В опытных группах в послеоперационном периоде терапия дополнялась внутривенными введениями раствора этоксидола (10 мг/кг) или мексидола (10 мг/кг), разведенного в 50,0 мл 0,89%-ного раствора хлорида натрия (доза составила 5% от ЛД50 с учетом видовой особенности экспериментальных животных).
Таблица 1- Методики исследования, используемые в процессе эксперимента
|
Группа |
Модель |
Методы исследования |
|
Норма |
8 здоровых животных |
1. Уровень эндотоксемии в органном и организменном кровотоке оценивали по содержанию молекул средней массы (МСМ) в сыворотке крови. 2. Для характеристики физико-химических свойств альбумина определяли эффективную (ЭКА) и общую (ОКА) концентрацию альбумина в сыворотке крови. 3. Резерв связывания альбумина (РСА) определяли по формуле РСА= ЭКА/ОКА. 4. Индекс токсичности плазмы (ИТ) определяли по формуле ИТ=ОКА/ЭКА-1. 5. Изучали активность процессов ПОЛ в тканевых структурах кишечника и печени по содержанию диеновых и триеновых коньюгатов (ДК и ТК), малонового диальдегида (МДА), индуцированного железом МДА (Fe-МДА). 6. Определяли активность фосфолипазы А2 (ФЛА2) в тканях исследуемых органов. 7. Определяли состояние антиоксидантной системы защиты по активности супероксиддисмутазы (СОД). 8. Полученные цифровые данные обрабатывали методом вариационной статистики с использованием критерия Стьюдента |
|
I – контроль-ная группа |
Острый перитонит на фоне инфузионной терапии |
|
|
II – опытная группа |
Острый перитонит на фоне применения раствора этоксидола (10 мг/кг) |
|
|
III – опытная группа |
Острый перитонит на фоне применения раствора мексидола (10 мг/кг) |
Производитель мексидола ЗАО «ЗиО-Здоровье» ООО «НПК «Фармасофт» (Россия) (форма выпуска: раствор – 2 мл (100 мг этилметилгидроксипиридина сукцинат), этоксидола – ЗАО «Медимэкс» ОАО «Синтез» (Россия) (форма выпуска: раствор – 2 мл (100 мг этилметилгидроксипиридина малат).
В работе применялись методы исследования, позволяющие оценить уровень ЭИ, липопероксидации, антиоксидантной системы, фосфолипазы А2 в крови и тканях исследуемых органов (табл. 1).
Полученные цифровые данные обрабатывали методом вариационной статистики с использованием критерия Стьюдента. Вычисления производили на CPU 1600 MHz Intel Pentium-IV с помощью пакета программ Microsoft Office XP. Использован текстовый процессор Microsoft Word ХР 2003. Динамика показателей отражена на графиках, построенных с использованием программы электронных таблиц Microsoft Excel 2003.
Результаты исследования и их обсуждение
Проведенные исследования показали, что модель острого перитонита была вполне адекватной для решения поставленных задач. В динамике развития патологического процесса отмечалось существенное увеличение в плазме крови содержания токсических продуктов как гидрофильной, так и гидрофобной природы (рис. 1).
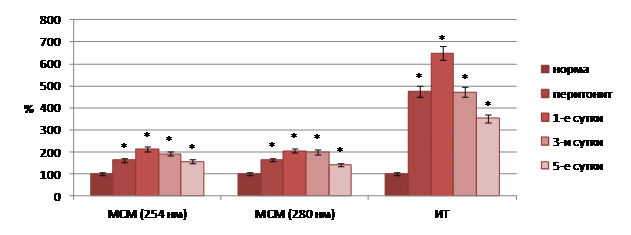
Рис. 1. Показатели эндогенной интоксикации плазмы крови общего кровотока при остром перитоните на фоне стандартной терапии (значения нормы приняты за 100%). Примечание: здесь и далее: * - достоверность отличия от нормы при p<0,001
В ходе проведения экспериментальных исследований при остром перитоните нами установлен факт интенсификации процессов ПОЛ и активации фосфолипазы А2 в динамике патологического процесса в исследуемых тканях кишечника. Так, при остром перитоните содержание первичных и вторичных продуктов ПОЛ в тканях органа существенно возрастало и было на 51,3–149,2% (p<0,05) выше нормы, а активность супероксиддисмутазы на 28,0–64,0% (p<0,05) была ниже нормальных значений (рис. 2).
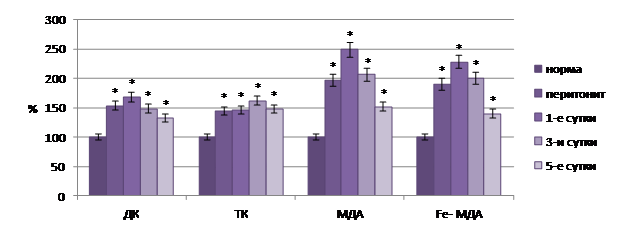 Рис. 2. Динамика молекулярных продуктов
липопереокисления в ткани тонкой кишки при остром перитоните на фоне стандартной терапии
Рис. 2. Динамика молекулярных продуктов
липопереокисления в ткани тонкой кишки при остром перитоните на фоне стандартной терапии
При эндотоксикозе перитонеального генеза дислипидные явления в ткани печени свидетельствуют о системном нарушении липидного метаболизма, что подтверждается быстрой интенсификацией процессов липопереокисления и ферментативной активности в ткани органа при данной патологии. В ткани печени существенно возрастает интенсивность ПОЛ, о чём свидетельствует увеличение уровней его первичных и вторичных продуктов, отмечается интенсификация активности ФЛА2 на фоне снижения активности супероксиддисмутазы более чем в 2 раза (рис. 3).
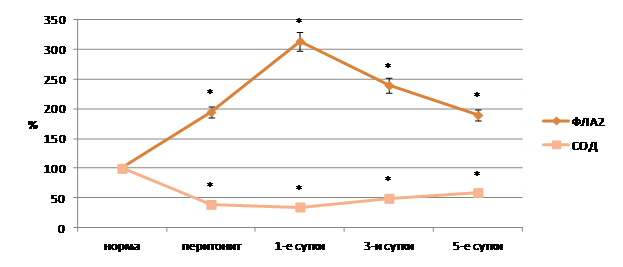
Рис. 3. Показатели активности фосфолипазы А2 и супероксиддисмутазы в тканях печени при остром перитоните на фоне стандартной терапии
Нарушение липидного обмена в печени обусловливает развитие широкого спектра патофизиологических изменений в организме. Характер модификаций в спектре фосфолипидов позволяет с уверенностью констатировать, что в генезе мембранодеструктивных явлений ключевая роль отводится фосфолипазам, каталитическая деятельность которых сопровождается накоплением свободных жирных кислот, лизоформ фосфолипидов и 1,2-диацилглицеролов. Однако высокий уровень метаболической активности органа обеспечивает её липидному компоненту достаточно эффективную защиту. Известно, что при повреждении в печени включаются механизмы, обеспечивающие её быструю регенерацию: мощная антиоксидантная система, способность оставшихся клеток переносить возросшую метаболическую нагрузку, активизация факторов, стимулирующих рост и снижение активности факторов, ингибирующих репарацию, усиление нейрогенной стимуляции клеток печени. При регенеративных процессах в клетках печени происходит изменение метаболизма липидов: в цитозоле возрастает содержание триацилглицеролов, фосфолипидов, холестерола, неэтерифицированных жирных кислот, а в эндоплазматическом ретикулуме и микросомах отмечается рост количества триацилглицеролов и неэтерифицированных жирных кислот. Накопление эфиров холестерола на фоне относительно небольшого прироста свободных жирных кислот позволяет компенсировать избыточное образование продуктов гидролитического расщепления фосфолипидов биомембран [3; 4].
Нарушение липидного метаболизма в печени тесно коррелирует со степенью эндотоксикоза при перитоните. Расстройства в этом компоненте тканевого гомеостаза во многом определяют выраженность печёночной недостаточности [3].
В процессе исследования установлено, что при остром перитоните в тканях кишечника и печени отмечаются существенные изменения липидного спектра на фоне выраженной ЭИ. Высокая концентрация токсинов за счет блокады окислительных ферментативных систем органа вызывает вторичный гепатотоксический эффект.
Таким образом, прогрессирование гомеостатических расстройств при остром перитоните сопряжено с формированием тяжелой ЭИ, развитие которой обусловлено не только накоплением плазменных токсических компонентов, но и вторичным повреждением в условиях эндотоксикоза печени, а также кишечника. Поскольку наиболее важным фактором, провоцирующим негативные проявления со стороны фосфолипидного бислоя мембран клеток, является липопереокисление, то обоснованно использование терапии, обладающей способностью его регулировать, в частности препаратами антиоксидантного типа действия.
В опытных группах проведена сравнительная оценка эффективности по отношению к показателям ЭИ этоксидола с известным производным 3-оксипиридина мексидолом. Доказано, что фармакологическая активность этоксидола дозой 10 мг/кг по повышению детоксикационного статуса организма не уступает таковой у мексидола такой же дозы.
Установлено, что при применении этоксидола при остром перитоните имелся положительный клинический эффект, о чем свидетельствовало отсутствие летальных исходов. Существенная терапевтическая эффективность была подтверждена и при оценке морфологических изменений со стороны органов брюшной полости (интраоперационно или на аутопсии).
Показано, что при использовании этоксидола при остром перитоните по сравнению с данными соответствующей группы контроля в плазме крови наблюдалось снижение содержания МСМ (λ=254 нм и λ=280 нм) на 32,4–50,0 и 25,0–52,8% (р<0,05) соответственно. ОКА и ЭКА в плазме крови экспериментальных животных была выше группы контроля соответственно на 8,9–10,1% (p<0,05) и 11,2–16,3% (p<0,05), ИТ был ниже данных контроля на 21,2–75,8% (p<0,05). РСА был выше данных контроля на 9,6–12,3% (p<0,05) (рис. 4).
На фоне применения мексидола уровень токсических продуктов в плазме крови также существенно снижался. Содержание МСМ уменьшалось на 35,3–44,1% (р<0,05), ЭКА была выше данных контроля на 14,6–16,3% (p<0,05), ИТ плазмы – на 18,2–69,7% (p<0,05).

Рис. 4. Некоторые показатели эндогенной интоксикации в плазме крови общего кровотока при остром перитоните на фоне терапии этоксидолом
Исследование влияния этоксидола на выраженность липопереокисления и активность фосфолипазы А2 в тканях кишечника показало, что использование препарата в терапии острого перитонита способствовало уменьшению в исследуемых тканях интенсивности процессов ПОЛ и фосфолипазной активности: содержание ДК было ниже данных группы контроля на 31,0–43,1% (p<0,05), МДА – на 72,5–98,8% (p<0,05), активность фосфолипазы А2 – ниже на 66,2–106,2% (p<0,05), СОД – выше на 9,1–27,3% (p<0,05).
Аналогичные фармакодинамические эффекты отмечены и у мексидола. При его применении в условиях острого перитонита содержание ДК в тканях кишечника было ниже контроля на 34,7–43,8% (p<0,05), МДА – на 35,3–99,7% (p<0,05), активность ФЛА2 – на 66,9–105,4% (p<0,05), СОД выше контроля на 9,6–26,1% (p<0,05) (рис. 5).
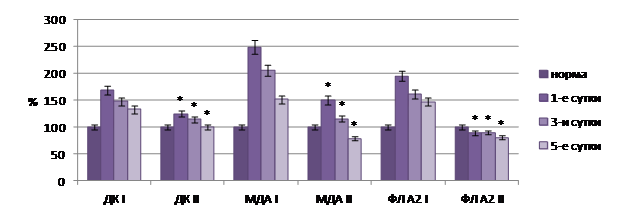
Рис. 5. Показатели перекисного окисления липидов в тканях кишечника на фоне применения мексидола в комплексной терапии острого перитонита
Использование этоксидола в терапии острого перитонита приводило к уменьшению в тканях печени содержания ДК на 43,2–51,4% (p<0,05), МДА – на 25,3–32,1% (p<0,05). При этом активность ФЛА2 падала на 17,9–48,4% (p<0,05), активность СОД повышалась на 7,5–15,1% (p<0,05).
На фоне применения мексидола уровень ДК по сравнению с контролем в тканях печени уменьшался на 40,5–48,7%, МДА – на 24,7–31,7% (p<0,05), активность СОД повышалась на 7,4–15,3% (p<0,05), активность фосфолипазы А2 падала на 21,8–52,6% (p<0,05).
В заключение необходимо отметить, что использование антиоксиданта этоксидола при остром перитоните обоснованно. Включение данного нового производного 3-оксипиридина в терапию экспериментального перитонита приводит к уменьшению ЭИ, что обусловлено его способностью повышать барьерную функцию кишечника и детоксикационную способность печени. Отметим, что одним из механизмов детоксикационного действия производных 3-оксипиридина этоксидола и мексидола является их способность уменьшать в тканевых структурах кишечника и печени интенсивность процессов ПОЛ и фосфолипазную активность, обусловливая их мембраностабилизирующий эффект.
Выводы
1. При остром экспериментальном перитоните применение нового производного 3-оксипиридина этоксидола дозой 10 мг/кг приводит к уменьшению эндогенной интоксикации, что обусловлено его способностью повышать барьерную функцию кишечника и детоксикационную способность печени.
2. Фармакологическая активность этоксидола дозой 10 мг/кг по повышению детоксикационного статуса организма при остром перитоните не уступает таковой у мексидола такой же дозы.
3. Одним из механизмов детоксикационного действия производных 3-оксипиридина этоксидола и мексидола при остром перитоните является их способность уменьшать в тканевых структурах кишечника и печени явления оксидативного стресса, тем самым проявлять мембраностабилизирующее действие.
Рецензенты:Смолькина А.В., д.м.н., профессор кафедры госпитальной хирургии медицинского факультета им. Т.З. Биктимирова ФГБОУ ВПО «Ульяновский государственный университет», г. Ульяновск.
Рубцов О.Ю., д.м.н., профессор кафедры факультетской хирургии ФГБОУ ВПО «Мордовский государственный университет им. Н.П. Огарёва», г. Саранск.
Библиографическая ссылка
Власов А.П., Гашимова С.К., Абрамова С.В., Полозова Э.И., Турыгина С.А., Месиков О.И. АНТИОКСИДАНТЫ В ПОВЫШЕНИИ ДЕТОКСИКАЦИОННОЙ СПОСОБНОСТИ ОРГАНИЗМА // Современные проблемы науки и образования. 2014. № 2. ;URL: https://science-education.ru/ru/article/view?id=12390 (дата обращения: 14.01.2026).



