Современные подходы к гепатопротекции, и в первую очередь фармакологической коррекции токсических поражений печени, базируются на представлениях о роли эссенциальных фосфолипидов (ЭФЛ) и полиненасыщенных жирных кислот (ПНЖК) в метаболических и структурных трансформациях гепатоцитов. Защитное действие ЭФЛ связано с участием в восстановлении клеточных мембран гепатоцитов, которые на 2/3 состоят из фосфолипидов. Кроме структурной функции ЭФЛ участвуют в процессах дифференцировки клеток, молекулярного транспорта, стимулируют активность ферментных систем гепатоцитов, обладают антиоксидантным действием, оказывают антифибротический эффект, повышая активность коллагеназы и замедляя синтез коллагена [4; 10].
Несомненный интерес представляют гепатопротекторы, содержащие ПНЖК, которые получают из растительного сырья и морских организмов. Особое внимание уделяется роли ПНЖК в метаболизме липидов, поддержании жидкостности клеточных мембран, богатых длинноцепочными полиеновыми кислотами. ПНЖК, являясь эссенциальными факторами пищи, обладают разнообразной биологической активностью, участвуют в адаптации организма к окружающей среде, оказывают сложный интегральный эффект, обуславливающий их незаменимость для большинства живых организмов [8].
Эффекты широко известных препаратов на основе фосфолипидов и триацилглицеридов остаются предметом многочисленных исследований. В то же время активно ведется поиск новых веществ природного происхождения, содержащих в своем составе ПНЖК и другие биологические соединения и комплексы, нормализующие метаболические процессы в печени и восстанавливающие структуру мембран гепатоцитов [6; 9].
Лекарственные средства - гепатопротекторы содержат различные действующие вещества на основе расторопши пятнистой, артишока, маакии амурской, солянки холмовой. Ряд гепатотропных биодобавок содержат плоды фенхеля, цветы бессмертника, листья крапивы, масло семян тыквы. На основе ЭФЛ, получаемых из сои, изготавливаются фармпрепараты «Эссенциале», «Эссенциале форте», «Эссливер форте», «Фосфоглив». Один из главных компонентов препарата «Фосфоглив» – фосфатидилхолин, являясь основным структурным элементом клеточных и внутриклеточных мембран, способен восстанавливать их при повреждении. Фосфатидилхолин предотвращает потерю гепатоцитами ферментов, нормализует белковый и липидный обмены, ингибирует формирование соединительной ткани, снижая риск развития фиброза и цирроза печени, восстанавливает ее детоксикационную функцию [2]. Другим действующим началом «Фосфоглива» является тринатриевая соль глицирризиновой кислоты, обладающая противовирусной активностью за счет индукции образования в организме интерферонов, увеличения активности клеток-киллеров, активации фагоцитоза. Глициррат обладает антиоксидантным свойством, оказывает гепатопротекторное действие, способствуя стабилизации мембран, потенцирует действие эндогенных глюкокортикоидов, оказывает противовоспалительное и противоаллергическое действие при поражениях печени. Таким образом, лекарственные средства − гепатопротекторы представлены на фармацевтическом рынке узким спектром действующих веществ. В отечественной фармации имеется дефицит препаратов на основе растительных масел с установленным гепатопротекторным действием, хотя среди известных продуктов растительного происхождения имеются растительные масла, изучение свойств и механизмов действия которых представляется перспективным, поскольку они значительно различаются друг от друга по содержанию жирных кислот, жирорастворимых витаминов, фосфолипидов и других компонентов, способных оказывать гепатопротекторное действие. Поиск потенциальных гепатопротекторов растительного происхождения, ставший объектом данного исследования, в значительной мере основывается на анализе существующих в литературе сведений о высокой биологической активности и лечебной эффективности использования в медицине ряда липофильных продуктов из плодов черного и грецкого орехов, а также семян льна. Льняное масло издавна используется в традиционной медицине для профилактики и лечения самых разных заболеваний благодаря положительному влиянию на органы пищеварительной системы при гастритах, колитах, запорах, нарушениях функции печени. Льняное масло содержит витамины А, В1, Е, К и, самое главное, имеет уникальный жирнокислотный состав.
Что касается черного, или американского, ореха, то это растение обладает уникальными лечебными свойствами. В народной медицине североамериканского континента используют экстракты листьев, кожуры и ядра черного ореха. В листьях и ядре черного ореха содержатся полифенольные вещества нафтохиноновой группы – юглон, флавоноиды, гликозиды, алкалоид югландин, в большом количестве каротин, витамин С, органические кислоты. Черный орех обладает мощным антиоксидантным действием благодаря большому количеству витамина С (в орехе его в 8 раз больше, чем в черной смородине, и в 50 раз больше, чем в цитрусовых). В России выпускается гомеопатическое средство на основе экстракта плодов черного ореха эликсир «Нуксен» в качестве иммуностимулятора и адаптогена. Биологические эффекты масла черного ореха ранее практически не исследовались.
О грецком орехе и о масле грецкого ореха в современной литературе сведений намного больше. Грецкий орех относится к тому же роду, что и черный орех. Масло грецкого ореха содержит много линолевой, линоленовой, а также пальмитиновую, лауриновую, миристиновую, арахидоновую и стеариновую жирные кислоты. В ядре ореха содержится до 15% белка и почти два десятка свободных аминокислот, провитамин А, витамины Р, РР, К, С, В6, В1, Е, а также ценные минеральные вещества: магний, цинк, селен, йод, кобальт, медь, фосфор, железо, калий, кальций и др. Витамин Е в орехах содержится в необычной форме – в виде g-токоферола, что предотвращает проблемы с сердцем, иногда возникающие под влиянием a-токоферола. Высокое содержание в грецком орехе уникальной группы антиоксидантов снижает риск развития хронического окислительного стресса и возникновения на этом фоне различных заболеваний. Исследователи из Американского химического общества, проводившие исследования 9 наиболее известных видов съедобных орехов под руководством профессора Дж. Винсона, утверждают, что грецкий орех – лучший источник антиоксидантов и веществ, нейтрализующих токсины, из всех, что придумала и воплотила на планете природа. Основным продуктом, получаемым из ядра грецкого ореха, является масло грецкого ореха, нашедшее широкое применение как в диетологии, так и для профилактики и в комплексной терапии заболеваний печени, в том числе для восстановления морфофункционального статуса органа после перенесенных гепатитов.
Для изучения гепатотропных эффектов растительных продуктов в условиях экспериментального ТПП были отобраны липофильные вещества с потенциальными гепатопротекторными свойствами: масло черного ореха, масло грецкого ореха, льняное масло, эффекты которых сопоставляли с гепатотропными эффектами фармпрепарата «Фосфоглив».
В экспериментах было использовано 200 белых крыс-самцов с массой тела 170-220 грамм. Животные были одного возраста, содержались в стандартных условиях университетского вивариума. Использование животных в эксперименте производилось с соблюдением норм и правил, регламентированных законодательством Российской Федерации и международными рекомендациями Европейской конвенции о защите позвоночных животных, используемых для экспериментов в научных или иных целях [1986]. Моделирование токсического поражения печени (ТПП) проводили путем подкожного введения крысам 50%-ного масляного раствора четыреххлористого углерода (0,5 мл/100 г массы тела один раз в сутки в течение трех суток). Животным контрольной группы вводили аликвоту физиологического раствора по той же схеме. Подопытные животные были разделены на группы. Первая группа (I) – контрольная (50 крыс). Вторая группа − животные с моделированием ТПП, выведенные из эксперимента на 7-е сутки (25 крыс). Третья группа − животные с моделированием ТПП, выведенные из эксперимента на 30-е сутки (25 крыс). Четвертая группа (IV) − животные с моделированнием ТПП, получавшие масло черного ореха (n = 25 крыс). Пятая группа (V) – животные с моделированием ТПП, получавшие масло грецкого ореха (25 крыс). Шестая группа (VI) – животные с моделированием ТПП, получавшие препарат «Фосфоглив» (n = 25 крыс). Седьмая группа (VII) – животные с моделированием ТПП, получавшие льняное масло (n = 25 крыс).
Исследуемые растительные продукты вводили внутрижелудочно в количестве 0,2 мл/сут. в течение 27 дней. Лиофилизированный фармпрепарат «Фосфоглив» вводили с помощью зонда в утренние часы до основного кормления животных по 0,1 мл/кг массы тела животного 2 раза в сутки. Часть животных контрольной группы и групп с моделированием ТПП выводилась из эксперимента на 7-е сутки, а остальные – на 30-е сутки. Все биохимические и начальный этап морфологических исследований были выполнены в день забора крови и ткани печени. Функциональное состояние печени характеризовали по показателям активности аспартатаминотрансферазы (АСТ), аланинаминотрансферазы (АЛТ), щелочной фосфатазы (ЩФ), g-глутамилтранспептидазы (g-ГТП), содержания общего и прямого билирубина в сыворотке крови подопытных крыс. Активность АЛТ и АСТ в сыворотке крови определяли унифицированным методом Райтмана – Френкеля, а активность ЩФ и g-ГТП определяли унифицированными колориметрическими методами; концентрацию в сыворотке крови крыс общего и прямого билирубина определяли методом Ендрассика – Грофа [5].
Для гистологического исследования кусочки ткани печени фиксировали в 10%-ном растворе нейтрального формалина на 0,1 М фосфатном буфере при рН 7,2–7,4, обезвоживали проводкой через ряд растворов изопропанола восходящей крепости, с последующей заливкой в парафин. Из полученных блоков готовили срезы толщиной 3 мкм, которые для приготовления гистологических препаратов окрашивали гематоксилином и эозином [3].
Статистическую обработку экспериментального материала проводили методами вариационной статистики [1] с использованием пакетов статистических программ Microsoft Excel 2010 и STATISTIKA 6.0 for Windows. Достоверным считали различие сравниваемых показателей при p < 0,05, то есть когда вероятность различия больше 95%.
Результаты исследований
У подопытных крыс с моделированием ТПП были зафиксированы очень выраженные изменения биохимических показателей морфофункционального состояния печени (табл. 1). Наблюдалось существенное увеличение трансаминаз уже на 7-е сутки эксперимента. Увеличение активности АСТ произошло примерно в 3,7 раза (р<0,05), а активность АЛТ увеличилась еще сильнее – в 6,2 раза (р<0,05) по сравнению с данными контрольной группы крыс. Коэффициент де Ритиса, отражающий соотношение активностей АСТ/АЛТ, в данной группе крыс составил (0,60±0,01), что более чем на 40% ниже значения этого коэффициента в контрольной группе крыс. Активность γ-ГТП у животных II группы – возросла в 8,3 раза, а активность ЩФ сыворотки крови изменилась существенно меньше, превысив данные, полученные в контрольной группе крыс, в 1,2 раза (р<0,05). На 30-е сутки эксперимента у животных III опытной группы показатели активности АСТ, АЛТ, γ-ГТП и ЩФ имели тенденцию к снижению, по сравнению с такими же показателями на 7-й день эксперимента, однако активность всех названных энзимов была достоверно выше данных контрольной группы крыс. Активность АСТ у животных III группы была ниже значений этого же показателя во II группе на 25,7% (р<0,05), но при этом превысила значения, полученные в контрольной группе в 2,7 раза (р<0,05).
Таблица 1
Биохимические показатели морфофункционального состояния печени при моделировании ее токсического поражения, вызванного введением тетрахлорметана (М±m)
|
Исследуемый показатель |
Группы животных |
||
|
I (контрольная), n=25 |
II (7 суток от начала эксперимента), n=25 |
III (30 суток от начала эксперимента), n=25 |
|
|
Аспартатаминотрансфераза (АСТ), U/л |
8,78±0,27 |
32,37±0,39* |
24,06±0,68* |
|
Аланинаминотрансфераза (АЛТ), U/л |
8,62±0,25 |
53,62±0,50* |
41,19±0,44* |
|
Коэффициент де Ритиса – соотношение активностей (АСТ/АЛТ) |
1,02±0,01 |
0,60±0,01* |
0,59±0,02* |
|
g-глутамилтранспептидаза (γ-ГТП), U/л |
16,60±0,48 |
137,36±1,85* |
108,67±1,02* |
|
Щелочная фосфатаза (ЩФ), U/л |
87,51±0,49 |
102,22±0,72* |
91,21±0,46* |
|
Общий билирубин, мкМ |
9,15±0,14 |
20,80±0,25* |
17,78±0,23* |
|
Прямой билирубин, мкМ |
2,89±0,13 |
16,34±0,27* |
11,69±0,19* |
|
Непрямой билирубин, мкМ |
6,26±0,11 |
6,05±0,40* |
6,09±0,27* |
Примечание: * - р<0,05 в сравнении с контролем.
Содержание АЛТ в сыворотке крови крыс на 30-е сутки наблюдений было меньше на 23,2% (р<0,05) по сравнению с показателями на 7-й день исследования, но оставалось в 4,8 раза (р<0,05) больше этого показателя у животных контрольной группы. У крыс III группы активность γ-ГТП и ЩФ была ниже на 20,9% (р<0,05) и 10,8% (р<0,05) соответствующих значений II группы, но тем не менее существенно превышала значения активности γ-ГТП и ЩФ в контрольной группе животных.
Исследование одного из ключевых показателей пигментного обмена – билирубина крови, достаточно информативного в отношении функционального состояния печени, позволило зафиксировать достоверное увеличение содержания этого соединения, продуцируемого гепатоцитами в крови, у крыс с ТПП. Содержание общего билирубина в сыворотке крови крыс II группы на 7-е сутки эксперимента превысило в 2,3 раза (р<0,05) данный показатель в контрольной группе животных за счет его прямой фракции. Концентрация конъюгированного билирубина в 5,7 раза (р<0,05) превысила его содержание в крови контрольных животных. Сколько-нибудь значимого изменения уровня непрямого билирубина у животных III группы в сравнении с контрольной группой не отмечено. В крови крыс III группы концентрация общего билирубина на 30-е сутки эксперимента уменьшилась на 14,5% (р<0,05) по сравнению с его уровнем на 7-е сутки наблюдения. Содержание прямого билирубина при этом снизилось у крыс III группы на 28,8% (р<0,05) по сравнению с данными, полученными во второй группе. Однако и содержание общего билирубина, и содержание прямого билирубина в крови III группы животных оставалось существенно большим, чем соответствующие показатели у крыс I (контрольной) группы. Так, уровень общего билирубина сыворотки крови крыс на 30-е сутки наблюдения превышал контрольные данные в 1,9 раза (р<0,05), а содержание прямого билирубина – в 4,0 раза (р<0,05).
Результаты изучения активности ряда ферментов у крыс с моделированием ТПП в разные сроки наблюдения позволяют утверждать, что зафиксированное повышение активности трансаминаз в сыворотке крови свидетельствует о повреждении мембран гепатоцитов, повышении их проницаемости, а также гибели клеток печени CCl4, которое сопровождается выходом внутриклеточных субстанций в кровь и лимфу. О преимущественном повреждении внешних мембран клеток печени тетрахлорметаном свидетельствует значительное увеличение активности цитоплазматического энзима – АЛТ, по сравнению с изменением активности АСТ, имеющего митохондриально-цитоплазматическую локализацию. На развитие массивного некроза гепатоцитов, возникающего под воздействием на организм подопытных животных СCl4, указывает увеличение активности γ-ГТП и ЩФ в их крови. Повышение концентрации билирубина, преимущественно за счет его прямой фракции, на фоне высокой активности ЩФ и γ-ГТП дает основания для утверждения, что у подопытных крыс имело место не только формирование синдрома цитолиза, но и развитие синдрома внутрипеченочного холестаза.
Выявленные изменения биохимических показателей морфофункционального состояния гепатоцитов при экспериментальном ТПП были верифицированы данными гистологического исследования ткани печени крыс.
Морфологическая картина ткани печени крыс контрольной группы по данным гистологического исследования в целом соответствовала критериям нормы. Гистологическое исследование ткани крыс с интоксикацией CCl4 показало существенные отличия в структуре органа экспериментальных животных этой группы по сравнению с контролем (рис. 1). Так, на 7-е сутки эксперимента на микропрепаратах были множественные проявления нарушения структуры ткани печени: дискомплексация печеночных балок, очаговые некрозы, кариолизис (В) и кариопикноз гепатоцитов (А), жировая дистрофия клеток печени (Б). Наблюдалась картина микрососудистых изменений: микроциркуляторные стазы, отек стенок кровеносных сосудов, острая венозная гиперемия междольковых капилляров, эритродиапедез, периваскулярные инфильтраты из полиморфных лейкоцитов, набухание и десквамация эндотелия сосудов, местный гемосидероз.
А 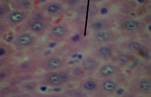 Б
Б 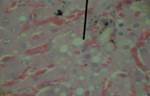 В
В 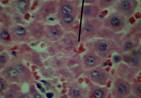
Рисунок 1. Микроскопическая картина печени крыс, подвергнутых интоксикации ССl4 (7-е сутки эксперимента).
Примечание: под указкой: А - кариопикноз гепатоцитов; Б - жировая дистрофия гепатоцитов и местный гемосидероз; В - дискомплексация печеночных балок, очаговые некрозы, кариолизис. Окраска гематоксилином и эозином, х300, иммерсия.
На 30-е сутки эксперимента после введения крысам CCl4 патоморфологические изменения микроструктуры печени оставались неоднородными и характеризовались преобладанием реактивных процессов, которые происходили в основном из интерстициальной соединительной ткани (рис. 2).
А 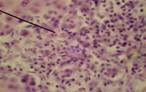 Б
Б 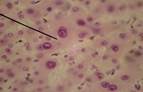 В
В 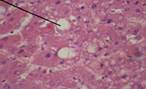
Рисунок 2. Микроскопическая картина ткани печени крыс с моделированием токсического поражения ССl4 (30-е сутки эксперимента).
Примечание: А - очаговые пролифераты из молодых соединительнотканных клеток, на месте атрофированных гепатоцитов; Б - регенерационная гипертрофия гепатоцитов рядом с очагом развивающейся соединительной ткани; В - дискомплексация печеночных балок жировая дистрофия гепатоцитов. Окраска гематоксилином и эозином, х300, иммерсия.
Патоморфологическая картина ткани печени характеризовалась менее выраженными нарушениями гемодинамики, проявлявшимися в виде хронической венозной гиперемии по сравнению с 7-ми сутками дезинтеграцией гепатоцитов в печеночных балках, преобладанием процессов хронического альтеративного воспаления, преимущественно в виде гидропической и жировой дистрофии и атрофии гепатоцитов (рис. 2 А, В), а также бурой и цианотической индурации и цирроза ткани органа. В эти же сроки эксперимента в ткани печени животных с ТПП патоморфологические изменения характеризовались регенерационной гипертрофией гепатоцитов (рис. 2Б), лимфоцитарной и гистиоцитарной инфильтрацией ткани органа, образованием вторичных (ложных) желчных протоков, пролиферацией грануляционной соединительной ткани. Таким образом, у животных с ТПП, вызванным введением CCl4, на протяжении эксперимента наблюдаются выраженные изменения морфологической структуры ткани печени.
При гистологическом исследовании ткани печени крыс с интоксикацией CCl4, получавших масла льна, черного или грецкого орехов (рис. 3), было выявлено следующее: структура долек была в значительной мере восстановлена и хорошо выражена, печеночные балки имели характерное радиальное расположение. В отдельных участках сохранялась гиперемия междольковых капилляров, периваскулярные полиморфноклеточные инфильтраты. Структура желчных протоков практически полностью восстановилась. В отдельных гепатоцитах выявлялся лизис и пикноз ядер, зернистая дистрофия. Гистологическая картина ткани печени в группе крыс, получавших препарат «Фосфоглив», на фоне ТПП на 30-е сутки наблюдения представляла собой хорошо выраженную структуру печеночных долек. Кровеносные сосуды, желчные протоки и подавляющая часть гепатоцитов патоморфологических изменений не имели. В немногих отдельных печеночных балках отмечали признаки жировой дистрофии и кариолизис гепатоцитов.
А 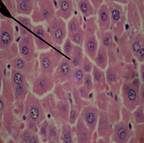 Б
Б 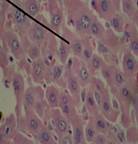 В
В 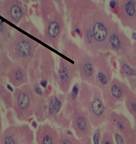 Г
Г 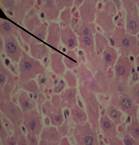
Рисунок 3. Микроскопическая картина печени крыс с интоксикацией тетрахлорметаном, получавших масло черного (А), грецкого (Б) орехов, льняное масло (В) и препарат «Фосфоглив» (Г) (30-е сутки эксперимента).
Примечание: указка микроскопа установлена на восстановленные оболочные структуры ткани органа. Окраска гематоксилином и эозином, х400, иммерсия.
Таким образом, введение в организм подопытных крыс исследуемых веществ способствовало восстановлению нормальной морфологической структуры печени, что свидетельствует о наличии у них гепатопротективных свойств. Однако на основании лишь исследования морфологических перестроек ткани печени сложно оценить выраженность гепатопротективных свойств исследуемых веществ.
В этой связи было проведено исследование влияния растительных масел и препарата «Фосфоглив» на параметры биохимических маркеров функционального состояния печени у крыс с моделированием ТПП (табл. 2).
Таблица 2
Влияние исследуемых растительных масел и препарата «Фосфоглив» на активность ферментов-маркеров морфофункционального состояния гепатоцитов в сыворотке крови крыс с интоксикацией CCl4 (30-е сутки эксперимента, М±m)
|
Группы крыс (n = 25 в каждой группе) |
Исследуемый показатель |
||||
|
АСТ, U/л |
АЛТ, U/л |
Коэффициент де Ритиса |
γ-ГТП, U/л |
ЩФ, U/л |
|
|
I (контрольная) |
8,78±0,27 |
8,62±0,25 |
1,02±0,01 |
16,60±0,48 |
87,51±0,49 |
|
III (группа сравнения) |
24,06±0,68 |
41,19±0,44 |
0,59±0,02 |
108,67±1,02 |
91,21±0,46 |
|
IV (введение масла черного ореха) |
16,35±0,52*;● |
32,75±0,48*;● |
0,5±0,04*;● |
63,74±1,24*;● |
89,63 ±0,52*,● |
|
V (введение масла грецкого ореха) |
17,43±0,52*;● |
35,55±0,48*;● |
0,49±0,02*;● |
65,44±1,26*;● |
91,67±0,51*;● |
|
VI (введение препарата «Фосфоглив») |
12,87±0,61*;● |
28,47±0,42*;● |
0,45±0,02*;● |
54,85±1,11*;● |
89,78±0,47*;● |
|
VII (введение льняного масла) |
14,76±0,56*;● |
30,81±0,48*;● |
0,48±0,02*;● |
61,22±1,1*;● |
90,12±0,5*;● |
Примечание: * - р<0,05 в сравнении с контролем; ● - р<0,05 в сравнении с III группой.
Введение в организм крыс с ТПП масла черного ореха сопровождалось снижением активности АСТ на 32,0% (р<0,05), АЛТ – на 20,5% (р<0,05), γ-ГТП – на 41,3% (р<0,05) по сравнению с данными у животных с ТПП, не получавших исследуемые вещества. У крыс с интоксикацией CCl4, получавших масло грецкого ореха, активность АСТ уменьшилась на 27,6% (р<0,05), АЛТ – на 13,7% (р<0,05), γ-ГТП – на 39,8% (р<0,05) по сравнению с аналогичными показателями III группы крыс. Значения активности АСТ в эти сроки исследования превысили показатель контрольной группы крыс в 2 раза, а показатель АЛТ – в 4,1 раза. В крови животных, получавших льняное масло либо препарат «Фосфоглив» также наблюдалось достоверное снижение активности АСТ, АЛТ и γ-ГТП по сравнению с данными III группы крыс. Несмотря на достоверное уменьшение гиперферментемии, обнаруженной в группах животных, получавших масло черного и грецкого орехов, а также масло льна, на 30-е сутки эксперимента, активность АСТ, АЛТ и γ-ГТП не достигала их уровней в крови контрольной группы крыс.
У крыс всех групп, получавших исследуемые вещества, наблюдалось снижение содержания в крови общего билирубина преимущественно за счет его прямой фракции. У животных, получавших масло черного ореха, содержание общего билирубина было ниже показателей III подопытной группы на 19,3% (р<0,05), а в сыворотке крови крыс, которым вводили масло грецкого ореха, - на 15,9% (р<0,05). При введении крысам льняного масла концентрация общего билирубина в сравнении с аналогичным показателем III группы животных оказалась меньше на 28,8% (р<0,05). Введение животным VI группы препарата «Фосфоглив» уменьшило содержание общего билирубина по сравнению с крысами, не получавшими препарата, на 36,2% (р<0,05). Результаты исследования маркеров функционального состояния печени позволили сформировать сравнительный ряд изучаемых веществ по показателям выраженности гепатопротекторных свойств в следующем порядке: «Фосфоглив» > льняное масло > масло черного ореха > масло грецкого ореха.
Таким образом, можно констатировать, что масла льна, черного и грецкого орехов, а также препарат «Фосфоглив» обладают существенными гепатопротекторными свойствами, способствуя уменьшению проявлений токсических, цитолитических и холестатических эффектов CCl4 у подопытных крыс.
Рецензенты:
Павлюченко И.И., д.м.н., профессор, зав. кафедрой клинической иммунологии, аллергологии и лабораторной диагностики ФПК и ППС ГБОУ ВПО «КубГМУ» Минздрава России, г.Краснодар.
Голубцов В.И., д.м.н., профессор, зав. кафедрой биологии с курсом медицинской генетики ГБОУ ВПО «КубГМУ» Минздрава России, г. Краснодар.
Библиографическая ссылка
Есауленко Е.Е. СРАВНИТЕЛЬНАЯ ОЦЕНКА ГЕПАТОПРОТЕКТОРНЫХ СВОЙСТВ ФАРМПРЕПАРАТА «ФОСФОГЛИВ», ЛЬНЯНОГО МАСЛА И МАСЕЛ ИЗ ПЛОДОВ ГРЕЦКОГО И ЧЕРНОГО ОРЕХОВ // Современные проблемы науки и образования. 2014. № 2. ;URL: https://science-education.ru/ru/article/view?id=12311 (дата обращения: 07.01.2026).



