Введение
В 2004 году НИИ питания РАМН были проведены исследования ежедневного рациона питания и на этой основе были утверждены рекомендуемые уровни потребления пищевых и биологически активных веществ [4]. В качестве одного из альтернативных источников полифенольных соединений, в том числе флаван-3-олов (катехинов) (катехин, эпикатехин, галлокатехин, эпигаллокатехин) или янтарной кислоты предложено использовать крыжовник отклоненный (Grossulariareclinata (L) Mill.).
С этой целью нами были отобраны три сорта, наиболее распространённых на Северном Кавказе, а именно – «Московский красный», «Юбилейный ярко-жёлтый» и «Огни Краснодара без шипов». Сырьё собрано в период плодоношения в июле 2011 г.
Установлено содержание антиоксидантов в спиртовых и водно-спиртовых, водных извлечениях надземной части. В извлечении из листьев крыжовника отклоненного сорт «Московский красный», полученного спиртом этиловым 40 %, содержание антиоксидантов оказалось максимальным и составило в пересчете на кверцетин и на галловую кислоту (1,715 ± 0,021 мг/г и 1,101 ± 0,023 мг/г соответственно). Эти данные явились обоснованием для выбора спирта этилового 40 % в качестве оптимального экстрагента при получении извлечения, содержащего максимальное количество антиоксидантов [1].
Поскольку именно эта фракция характеризуется максимальным содержанием количества антиоксидантов, то она была выбрана для дальнейшего изучения качественного и количественного состава фенольных соединений методом ВЭЖХ. Впервые установлено наличие витексина, изоветиксина, хлорогеновой и цикоревой, феруловой кислот. В экстракте крыжовника обнаружено 23 вещества, из которых идентифицировано 13 соединений полифенольной природы. Они представлены главным образом флавоноидами, кумаринами и фенолкарбоновыми кислотами.
Проведено количественное определение основных групп БАВ. Установлено, что по содержанию элементов количественно преобладают калий (3,0 %), кальций (0.3 %), магний (0,5 %) и фосфор (1,0 %); содержание пигментов в листьях крыжовника (хлорофилла содержится 14,0 мг/% ± 0,07, каротиноидов - 2,7 мг/% ± 0,13); полисахариды листьев крыжовника представлены водорастворимыми полисахаридами (0,4 %), пектиновыми веществами (10,4 %), гемицеллюлозой А (9,6 %) и гемицеллюлозой Б (4,8 %). Из листьев крыжовника отклоненного выделены полисахариды и изучены некоторые физико-химические свойства пектинов: определена средняя молекулярная масса (у стеблей – 19007 г/моль, листьев – 16849 г/моль, ягод - 10071 г/моль); поверхностная активность.
Выявлена высокая комплексообразующая способность ПВ из листьев, ягод и стеблей крыжовника отклоненного по отношению к ионам Pb2+ [1,3]. Степень извлечения ионов свинца пектином, полученным из листьев крыжовника отклоненного, составляет 56,3 % (373 мг-ион/г), что значительно выше, чем ПВ из ягод – 39,6 % (262,7 мг-ион/г). Важно заметить, что сорбционная активность из стеблей крыжовника значительно превышает 67,7 % (555,0 мг-ион/г).
Целью настоящей работы явилось исследование аминокислотного состава листьев крыжовника отклоненного.
Материал и методика
В качестве объекта исследования был выбран наиболее распространённый на Северном Кавказе сорт «Московский красный». Сырьё собрано в период плодоношения в июле 2011 г.
Для определения свободных аминокислот: 50,0 г (точная навеска) сырья исчерпывающе экстрагировали смесью хлороформ-бензол (1:1) в аппарате Соксклета (в течение 28 часов). После удаления растворителя сырье количественно переносили в круглодонную колбу, добавляли 300 мл горячей воды (80–90˚ С) и кипятили с обратным холодильником в течение 1 часа. Данную операцию проводили трехкратно, используя каждый раз свежий экстрагент. Объединенные извлечения упаривали до сиропообразной консистенции и добавляли пятикратный объем метанола для осаждения высокомолекулярных соединений. Осадок центрифугировали, и полученный фильтрат упаривали досуха [2,5,7].
12 мг порошка растворяли в 2,2 мл натрий-цитратного раствора и вводили в колонку аминокислотного анализатора АА-33. Качественный состав аминокислот в образце определяли по времени удерживания. В качестве стандарта использовали стандартную смесь, состоящую из 18 аминокислот.
Идентификацию проводили по времени удерживания методом тестеров, а количественный расчет содержания аминокислот – по площади пика методом внутреннего стандарта [2,6].
Формула расчета:
1) ![]() , (1)
, (1)
где:
С – содержание аминокислот в образце сырья, г/кг; Сст – содержание аминокислот в стандарте, г/100мл; S – площадь пика определяемой аминокислоты, мм2; Sст – площадь пика определяемой аминокислоты при анализе стандарта, мм2; а – масса навески сырья, взятой на анализ, г.
Идентификация свободных аминокислот. Предварительно содержание свободных аминокислот в листьях крыжовника отклоненного проводили методом ТСХ с использованием стандартных образцов индивидуальных соединений, в качестве неподвижной фазы хроматографических пластин «Kiselgel» размером 15х20 см, в качестве подвижной фазы смесь растворителей: н-бутанол- ледяная уксусная кислота – вода (80:40:40). Смесь растворителей помещали в стеклянную камеру для хроматографии, которую насыщали в течение 2-х часов.
В качестве исследуемого раствора использовали раствор экстракта в разведенной хлористоводородной кислоте. Для этого к 0,100 г экстракта прибавляли по 5 мл разведенной хлористоводородной кислоты, перемешивали (исследуемый раствор).
В качестве растворов сравнения использовали 0,05 % растворы рабочих стандартных образцов аминокислот: аргинин, аспарагиновая кислота, глицин,серин, глутаминовая кислота, треонин, валин, метионин, триптофан, фенилаланин, аланин, тирозина, пролина, лейцина, изолейцин, лизин, гистидина, серина.
Для приготовления рабочих стандартных образцов 0,05 (точные массы) соответствующих аминокислот помещали в мерные колбы объемом 100 мл, прибавляли по 50 мл воды дистиллированной, перемешивали до растворения в ультразвуковой бане при температуре 50 °C и доводили до метки тем же растворителем.
На линию стартахроматографической пластины наносили по 20 мкл исследуемых растворов и по 5 мкл рабочих стандартных образцов аминокислот. Длина пробега растворителей 15 см. Хроматограмму высушивали при комнатной температуре в вытяжном шкафу до полного удаления растворителей и опрыскивали 0.2 % раствором нингидрина в 95 % этаноле (1,0 г нингидрина,2,5 г ацетата кадмия, 10 мл уксусной кислоты ледяной растовряют в 500 мл спирта этилового) и нагревали в сушильном шкафу при температуре 100–105 градусов в течение 5 минут. На хроматограммах в исследуемых растворах после проявления 0,2 % раствором нингидрина обнаружены окрашенные зоны.
Для определения суммы аминокислот в экстракте была использована методика, основанная на реакции взаимодействия аминокислот с раствором нингидрина с последующим спектрофотометрированием полученного окрашенного комплекса при длине волны около 570 нм. В ходе эксперимента нами был уточнен максимум поглощения окрашенного комплекса глютаминовой кислоты с нингидрином и водного извлечения из экстракта (рисунок 1). Комплекс и раствор для исследования получали по нижеприведенной методике. Согласно полученным данным комплекс глутаминовой кислоты и нингидрина имеет максимум поглощения при длине волны 568±2 нм, а комплекс водного извлечения с нингидрином имеет максимум поглощения при длине волны 568,5 ±2нм. Поэтому в наших исследованиях мы использовали длину волны 568 нм.
Для исследования около 0,0500 (точная навеска) экстракта помещали в мерную колбу вместимостью 250 мл. Прибавляли 150 мл воды очищенной и перемешивали до растворения с использованием ультразвуковой бани. Охлаждали, объем доводили до метки водой очищенной, перемешивали и извлечение фильтровали через обеззоленный фильтр (исследуемый раствор).
Около 0,0500 г (точная навеска) кислоты глютаминовой (ВФС 42-2722-96) помещают в мерную колбу вместимостью 100 мл, растворяют в 20–30 мл воды и доводят раствор водой до метки (РСО).
2 мл исследуемого раствора помещали в мерную колбу вместимостью 50 мл, прибавляли 1 мл 0,25 % раствора натрия карбоната, 2 мл спиртового раствора нингидрина и нагревали 10 минут на кипящей водяной бане. После охлаждения раствор доводили водой до метки. Параллельно в мерную колбу вместимостью 50 мл помещали 2 мл раствора РСО кислоты глютаминовой, и далее поступали, как указано выше. Оптическую плотность полученных растворов измеряли на спектрофотометре при длине волны 568 нм в кювете с толщиной слоя жидкости 10 мм относительно воды. Содержание суммы аминокислот в сырье в % Х, в пересчёте на кислоту глютаминовую кислоту рассчитывали по формуле:
![]() ; (2)
; (2)
Где D* – оптическая плотность испытуемого раствора, D – оптическая плотность РСО глютаминовой кислоты; М – масса РСО глютаминовой кислоты в граммах; m-масса экстракта в г; W – потеря массы при высушивании экстракта в %.
Результаты проведенных испытаний приведены в таблицах 1, 2.
Результаты и их обсуждение
В исследуемом экстракте предварительно методом ТСХ обнаружено 5 окрашенных зон, из которых удается идентифицировать глицин, глутаминовую кислоту, метионин и тирозин. Испытание проводилось в нескольких системах растворителей: н-пропанол: вода(70:30); этанол 96 %: аммиакконц.(70:30); н-бутанол-уксусная кислота конц. – вода (80:40:40). Во всех системах зоны идентичны. Наилучшее разделение получено в системе н-бутанол—уксусная кислота—вода (80:40:40), данные по которому приведены в таблице.
Таблица 1. Результаты хроматографического исследования аминокислотного состава экстракта крыжовника методом хроматографии в тонком слое сорбента в системе
н-бутанол—уксусная кислота—вода (80:40:40)
|
Образец |
Кол-во окраш. зон |
№ зоны |
Значения Rf около |
Идентифицировано |
|
Экстракт крыжовника отклоненного |
5 |
1 2 3 4 5 |
0,35(розовая) 0,40(фиолетовая) 0,48(розовая) 0,60(розовая) 0,69(розовая) |
Глицин Неидентифицированно Глутаминовая кислота Метионин тирозин |
Далее содержание суммы аминокислот в полученной фракции определяли на аминокислотном анализаторе АА-33 [2,5], что представлено ниже.
Таблица 2. Содержание свободных аминокислот
|
№ |
Аминокислоты |
Крыжовник отклоненный |
|
С, г/% |
||
|
1 |
Аспарагиновая кислота |
0,77 |
|
2 |
Треонин |
0,65 |
|
3 |
Серин |
0,39 |
|
4 |
Глутаминовая кислота |
1,98 |
|
5 |
Глицин |
0,91 |
|
6 |
Аланин |
0,62 |
|
7 |
Валин |
1,07 |
|
8 |
Метионин |
1,38 |
|
9 |
Изолейцин |
0,27 |
|
10 |
Лейцин |
0,47 |
|
11 |
Тирозин |
1,55 |
|
12 |
Фенилаланин |
0,51 |
|
13 |
Гистидин |
0,14 |
|
14 |
Лизин |
0,42 |
|
15 |
Аргинин |
1,01 |
|
|
Всего: |
12,14 |
Как видно из представленных данных, экстракт из листьев крыжовника отклоненного содержит 15 аминокислот, в том числе 7 незаменимых. В наибольшем количестве в сумме присутствуют глутаминовая кислота, тирозин, глицин и метионин.
Разработана методика спектрофотометрического определения суммы аминокислот по реакции с нингидрином. Установлено содержание аминокислот в экстркте из листьев крыжовника, которое составляет 16,20 ±0,69 % (в пересчете на глутаминовую кислоту).
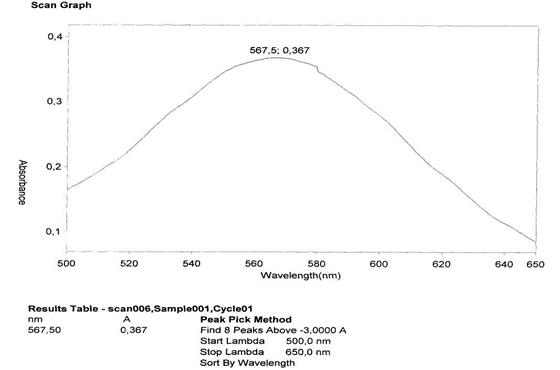
Рисунок 1. Комплекс водного раствора экстракта крыжовника отклоненного с раствором нингидрина
Выводы:
- Впервые на аминокислотном анализаторе АА-33 исследован качественный и количественный состав аминокислот в листьях крыжовника отклоненного.
- Обнаружено 15 свободных аминокислот, в том числе 7 незаменимых (валин, метионин, изолейцин, лейцин, гистидин, триптофан, фенилаланин); в значительном количестве (от общей суммы аминокислот) содержатся глутаминовая кислота, тирозин, глицин и метионин.
- Разработана методика спектрофотометрического определения суммы аминокислот по реакции с нингидрином. Установлено содержание аминокислот в листьях крыжовника, которое составляет 16,20 % (в пересчете на глутаминовую кислоту).
Рецензенты:
Кодониди И.П., д.фарм.н., доцент кафедры органической химии, Пятигорский медико-фармацевтический институт – филиал ГБОУ ВПО ВолгГМУ Минздрава России, г. Пятигорск.
Компанцев В.А., д.фарм.н., профессор кафедры неорганической химии, Пятигорский медико-фармацевтический институт-филиал ГБОУ ВПО ВолгГМУ Минздрава России, г. Пятигорск.
Библиографическая ссылка
Аджиахметова С.Л. СРАВНИТЕЛЬНЫЙ АНАЛИЗ АМИНОКИСЛОТНОГО СОСТАВА ЛИСТЬЕВ КРЫЖОВНИКА ОТКЛОНЕННОГО (GROSSULARIARECLINATA (L) MILL.) // Современные проблемы науки и образования. 2014. № 1. ;URL: https://science-education.ru/ru/article/view?id=12146 (дата обращения: 26.02.2026).



