Введение
Ранее было показано, что ароилпировиноградные кислоты (АПК) и их эфиры вступают в реакцию азосочетания с солями арилдиазония по активированной метиленовой группе, образуя их 3-арилгидразонопроизводные [3, 6]. Литературные данные об участии амидов ароилпировиноградных кислот в реакциях азосочетания с солями диазония ограничиваются двумя примерами [5]. Также описан метод получения 3-арилгидразонов-4-арил-2,4-диоксобутирамидов действием ариламинов на 3-ароил-1-фенил-4,5-пиразолдионы [5, 4]. В ряду ранее синтезированных гидразоноамидов анальгетическая активность не изучалась.
Химическая часть
С целью дальнейшего исследования химического поведения амидов АПК в реакции с солями диазония, особенностей строения, а также для поиска новых биологически активных веществ нами изучено их взаимодействие с хлоридом фенилдиазония. В результате реакции азосочетания амидов(1а-ж) с хлоридом фенилдиазония в диоксане в присутствии ацетата натрия были выделены N-замещенные 4-арил-2,4-диоксо-3-(2-фенилгидразоно)бутанамиды (2а-и).
Схема
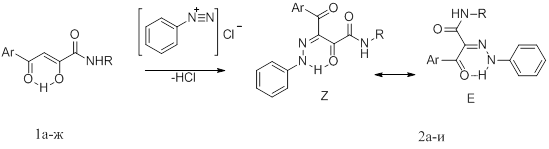
Ar = C6H5 (1а,2а), 4-СН3С6Н4 (1б,2е), 4-СН3ОС6Н4 (1в,2б), 4-С2Н5С6Н4 (1г,2в,2ж),4-BrС6Н4 (1д,2з), 4-FC6H4 (1е,2г), 4-ClС6Н4 (1ж,2д,2и); R = С6Н5(СН2)2 (2а-д), 2,6-(СН3)2С6Н3 (2ж-и)
Соединения (2а-и) представляют собой желтые или оранжевые кристаллические вещества, растворимые в диметилсульфоксиде, диметилформамиде, ацетоне, трудно растворимые в изопропиловом спирте, ацетонитриле, не растворимые в воде и гексане.
В ИК-спектрах соединений 2, снятых в пасте вазелинового масла, наблюдаются полосы поглощения валентных колебаний NH группы амидного фрагмента в области 3221-3360 см-1, амидного карбонила в области 1664-1692 см-1, кетонных карбонильных групп в области 1544-1620 см-1. Валентные колебания группы NH гидразонного фрагмента проявляются в низкочастотной области 3172см-1(2б), 3183 см-1(2з) или отсутствуют вследствие образования ВВС с кетонными карбонилами, что соответствует литературным данным о строении близких по структуре гидразоноамидов [4].
В спектрах ПМР соединений (2б,е,ж,з,и), кроме сигналов протонов ароматических ядер и связанных с ними заместителей, наблюдаются по два сигнала протона гидразонной группы в области 11.79-13.34 и 13.18-13.75 м.д., при этом суммарная интенсивность соответствует одному протону. Такой характер сигналов свидетельствует о существовании этих соединений в растворах в виде смеси Z и Е изомеров, что не противоречит литературным данным о строении близких по структуре гидразоноамидов [4].
Присутствие в спектрах ЯМР 1Н соединений (2а,в,г,д) одного набора сигналов свидетельствует об их существовании в виде одного из изомеров.
В масс-спектре соединения (2б) имеются пики молекулярного и фрагментных ионов со следующими значениями m/z (I, %): 430 (5.0) [M+1]+, 309 (100,0) [M-C6H5CH2CH2NH]+, 281 (50,0) [M-C6H5CH2CH2NHCO]+, 253 (4,0) [4-CH3OC6H4COC=N–NHC6H5]+, 135 (18,0) [4-CH3OC6H4CO]+. Такой характер фрагментации хорошо согласуется со структурой гидразоноамидов АПК 2.
Экспериментальная часть
ИК-спектры записаны на приборах Specord М-80, ФСМ-1201 в вазелиновой пасте. Спектры ЯМР 1Н получены на приборах Varian-MERCURYplus 300 (300.05 МГц), TeslaBS-567A(100 МГц) в DMSO-d6 и CDCl3, внутренний стандарт – ГМДС. Масс-спектры соединений сняты на масс-спектрометре серии MicrOTOF-Q II фирмы BrukerDaltonics (Бремен, Германия), оснащённым электроспрей источником ионизации, шестипортовым краном и устройством прямого ввода kdScientific (скорость потока 180 мкл/час). Химическую чистоту соединений и протекание реакций контролировали методом ТСХ на пластинках «Silufol 254 UV» или «Sorbfil» в системе эфир-бензол-ацетон (10:9:1), пятна детектировали парами йода.
N-замещенные 4-арил-2,4-диоксо-3-(2-фенилгидразоно)бутанамиды (2а-и). К раствору 0,005 моля соответствующего амида АПК (1) в 100 мл диоксана при перемешивании и охлаждении по каплям добавили раствор соли фенилдиазония, полученного из 0.005 моль анилина, 0.005 моль нитрита натрия, 0.7 мл концентрированной хлороводородной кислоты и 4 мл воды. Добавили 2.0 г ацетата натрия и продолжили перемешивание до полного выпадения осадка. Выпавший осадок отфильтровали, высушили и перекристаллизовали из спирта или ацетонитрила.
N-фенетил-4-фенил-2,4-диоксо-3-(2-фенилгидразоно)бутанамид (2а)
Выход 1.97 г (63%), Т. пл.= 173-175 °С (ацетонитрил - пропанол-2). C24H21N3O3. ИК спектр, n, см-1: 3344 (NH), 1692 (С=О), 1588,1564 (COхел, С=С, С=N). Спектр ЯМР 1Н, ДМСО-d6, δ, м.д: 2.26-3.52 гр. с (4Н, СН2–СН2), 7.00 – 7.74 м (16H, 3С6Н5, NH), 9.57 с (1H, NH), 12.86 с (1H, NH).
N-фенетил-4-(4-метоксифенил)-2,4-диоксо-3-(2-фенилгидразоно)бутанамид (2б). Выход 1.43 г (67%), Т. пл.= 141-143 °С (ацетонитрил - пропанол-2). C25H23N3O4. ИК спектр, n, см-1: 3322 (NH), 3172 (NH), 1692, 1675 (С=О), 1610, 1585 (COхел, С=С, С=N).Спектр ЯМР 1Н, CDCl3, δ, м.д: 2.65-3.69 гр. с (4Н, СН2–СН2), 3.79 с (3Н, ОСН3), 3.88 с (3Н, ОСН3), 6.87 – 8.05 м (15H, 2С6Н5, С6Н4, NH), 9,09 с (1H, NH), 13.06 с (1H, NH), 13.47 с (1H, NH).Масс-спектр, m/z (Iотн., %): 430 (5.0) [M+1]+, 309 (100,0) [M-C6H5CH2CH2NH]+, 281 (50,0) [M-C6H5CH2CH2NHCO]+, 253 (4,0) [4-CH3OC6H4COC=N–NHC6H5]+, 135 (18,0) [4-CH3OC6H4CO]+.
N-фенетил-4-(4-этилфенил)-2,4-диоксо-3-(2-фенилгидразоно)бутанамид (2в). Выход 1.28 г (60%), Т. пл.= 169-170 °С (ацетонитрил - пропанол-2).C26H25N3O3. ИК спектр, n, см-1:3360 (NH), 1692 (С=О), 1600, 1560 (COхел, С=С, С=N).Спектр ЯМР 1Н, ДМСО-d6, δ, м.д: 1.21 т(3Н, СН2СН3), 2.35-3.52 гр. с (6Н, СН2–СН2,СН2СН3), 7.01 – 7.69 м (15H, 2С6Н5, С6Н4, NH), 9.54 с (1H, NH), 12.87 с (1H, NH).
N-фенетил-4-(4-фторфенил)-2,4-диоксо-3-(2-фенилгидразоно)бутанамид (2г). Выход 1.27 г (61%), Т. пл.= 185-187 °С (пропанол-2).C24H20FN3O3. ИК спектр, n, см-1: 3328 (NH), 1688 (С=О), 1600, 1544 (COхел, С=С, С=N). Спектр ЯМР 1Н, ДМСО-d6, δ, м.д: 2.37-3.52 гр. с (4Н, СН2–СН2), 7.03 – 7.77 м (15H, 2С6Н5, С6Н4, NH), 9,62 с (1H, NH), 12.84 с (1H, NH).
N-фенетил-4-(4-хлорфенил)-2,4-диоксо-3-(2-фенилгидразоно)бутанамид (2д). Выход 1.41 г (65%), Т. пл.= 184-185 °С(ацетонитрил - пропанол-2).C24H20ClN3O3. ИК спектр, n, см-1: 3328 (NH), 1688 (С=О), 1616, 1548 (COхел, С=С, С=N).Спектр ЯМР 1Н, ДМСО-d6, δ, м.д: 2.36-3.53 гр. с (4Н, СН2–СН2), 7.03 – 7.80 м (15H, 2С6Н5, С6Н4, NH), 9,66 с (1H, NH), 12.84 с (1H, NH).
N-(2,6-диметилфенил)-4-(4-метилфенил)-2,4-диоксо-3-(2-фенилгидразоно)бутанамид (2е). Выход 1.92 г (93%), Т. пл.= 185-186 °С (толуол). C25H23N3O3. ИК спектр, n, см-1: 3282 (NH), 1684, 1635 (С=О), 1602 (COхел, С=С, С=N). Спектр ЯМР 1Н, ДМСО-d6, δ, м.д: 2.24 с (3Н, СН3), 2.27 с (3Н, СН3), 2.44 с (3Н, СН3), 7.08 – 7.88 м (12H, С6Н5, С6Н4, С6Н3), 10,07 с (1H, NH), 10.16 с (1H, NH), 11.97 с (1H, NH), 13.35 с (1H, NH).
N-(2,6-диметилфенил)-4-(4-этилфенил)-2,4-диоксо-3-(2-фенилгидразоно)бутанамид (2ж). Выход 1.81 г (85%), Т. пл.= 161-163 °С (толуол).C26H25N3O3. ИК спектр, n, см-1: 3232 (NH),3096 (NH), 1664, 1620 (COхел, С=С, С=N). Спектр ЯМР 1Н, ДМСО-d6, δ, м.д: 1.24 т (3Н, СН2СН3), 2.21 с (3Н, СН3), 2.26 с (3Н, СН3), 2.74 кв (2Н, СН2СН3), 6.99 – 7.84 м (12H, С6Н5, С6Н4, С6Н3), 9,96 с (1H, NH), 10,05 с (1H, NH), 11,79 с (1H, NH), 13.18 с (1H, NH).
N-(2,6-диметилфенил)-4-(4-бромфенил)-2,4-диоксо-3-(2-фенилгидразоно)бутанамид(2з). Выход 2.27 г (95%), Т. пл.= 215-217 °С (толуол). C24H20BrN3O3. ИК спектр, n, см-1: 3221 (NH), 3183 (NH), 1665, 1644 (С=О), 1587 (COхел, С=С, С=N). Спектр ЯМР 1Н, ДМСО-d6, δ, м.д: 2.23 с (3Н, СН3), 2.27 с (3Н, СН3), 7.04 – 7.90 м (12H, С6Н5, С6Н4, С6Н3), 10,06 с (1H, NH), 10,16 с (1H, NH), 12,26 с (1H, NH), 13.40 с (1H, NH).
N-(2,6-диметилфенил)-4-(4-хлорфенил)-2,4-диоксо-3-(2-фенилгидразоно)бутанамид (2и). Выход 2.08 г (96%), Т. пл.= 211-213 °С(толуол).C24H20ClN3O3. ИК спектр, n, см-1: 3227 (NH), 1667, 1642 (С=О), 1595 (COхел, С=С, С=N).Спектр ЯМР 1Н, CDCl3, δ, м.д: 2.15 с (3Н, СН3), 2.27 с (3Н, СН3), 6.98 – 7.90 м (13H, С6Н5, С6Н4, С6Н3, NH), 13,34 с (1H, NH), 13.75 уш. с (1H, NH).
Биологическая часть
Оценку анальгетических свойств гидразоноамидов 2 изучали на беспородных мышах массой 18-22 г. методом «уксусных корчей» [2]. Исследуемые соединения и препарат сравнения (метамизол натрия) вводили в дозе 25 мг/кг внутрибрюшинно в виде взвеси в 2% крахмальной слизи за 30 мин до внутрибрюшинного введения 0,75% раствора уксусной кислоты (0,1 мл/10 г массы тела). В течение последующих 15 мин. после инъекции подсчитывали количество корчей для каждого животного. Анальгетический эффект оценивали по уменьшению количества корчей в процентах к контролю. Каждое соединение исследовали на 6 животных. Животным контрольной группы вводили только 2% крахмальную слизь.
Статистическую обработку экспериментального материала проводили с использованием t критерия Стьюдента Эффект считали достоверным при р<0,05 [1].
Таблица
Анальгетическая активность синтезированных соединений
|
№ п/п |
Шифр Соединения |
Доза, мг/кг |
«Уксусные корчи» |
||
|
Количество корчей |
% , к контролю |
Активность, % |
|||
|
1 |
Контроль 2% крахм. Слизь |
|
25,2±2,32 |
100 |
- |
|
2 |
Метамизол натрия |
25 |
10,6±1,38 |
42,6 |
57,9 |
|
3 |
2а |
25 |
14,6±1,26* |
57,94 |
42,06* |
|
4 |
2б |
25 |
18,3± 1,32 |
72,62 |
27,38 |
|
5 |
2в |
25 |
16,0±1,36 |
63,49 |
36,51 |
|
6 |
2г |
25 |
19,8±1,21 |
78,57 |
21,43 |
|
7 |
2д |
25 |
18,6±1,27 |
73,81 |
26,19 |
|
8 |
2е |
25 |
13,2±1,08* |
52,38 |
47,62* |
|
9 |
2ж |
25 |
17,8±1,52 |
70,63 |
29,37 |
|
10 |
2з |
25 |
13,8±1,53* |
54,76 |
45,24* |
|
11 |
2и |
25 |
19,6±1,22 |
77,78 |
22,22 |
Примечание: *- достоверность различий по сравнению с контролем р <0,05
Анализ экспериментальных данных (табл.) показывает, что среди испытанных соединений выраженную анальгетическую активность проявили гидразоноамиды(2а, 2е, 2з), которые в дозе 25 мг/кг вызывали у животных уменьшение количества уксусных корчей на 42,06%, 47,62 %¸ 45,24% соответственно при p < 0,05.
Среди производных гидразоноамидов АПК анальгетическая активность обнаружена впервые. Таким образом, проведенные исследования показали, что дальнейший поиск новых, более активных, анальгетиков среди гидразоноамидов ароилпировиноградных кислот считается целесообразным.
Рецензенты:
Сыропятов Б.Я., д.м.н., профессор, зав. кафедрой физиологии и патологии Пермской государственной фармацевтической академии, г. Пермь.
Михайловский А. Г., д.фарм.н., доцент, профессор, кафедры общей и органической химии Пермской государственной фармацевтической академии, г. Пермь.
Библиографическая ссылка
Чернов И.Н., Буканова Е.В., Махмудов Р.Р., Шумикова И.Н., Игидов Н.М., Чащина С.В. СИНТЕЗ И АНАЛЬГЕТИЧЕСКАЯ АКТИВНОСТЬ N-ЗАМЕЩЕННЫХ 4-АРИЛ-2,4-ДИОКСО-3-(2-ФЕНИЛГИДРАЗОНО)БУТАНАМИДОВ // Современные проблемы науки и образования. 2014. № 1. ;URL: https://science-education.ru/ru/article/view?id=11962 (дата обращения: 26.02.2026).



