Введение
В Российской Федерации и странах Европейского союза запрещено использование рактопамина (4-(3-[(2-гидрокси-2-(4-гидроксифенил)этил-амино]бутилфенол), относящегося к бета-агонистам, в качестве кормовой добавки для повышения продуктивности животноводства из-за негативного воздействия остаточных содержаний этого препарата на здоровье потребителей [4]. Однако рактопамин разрешен для применения на последней стадии откорма свиней, коров и птицы в некоторых странах, импортирующих в РФ мясо и изделия из него, в качестве стимулятора роста и жиросжигающего средства, что способствует получению постного мяса. Потребление β-агонистов с пищей может вызвать отравление, провоцировать тахикардию, нарушение сердечного ритма, головные боли, мышечные спазмы, повышение артериального давления [6].
Для определения β-агонистов используются инструментальные физико-химические методы анализа, такие как высокоэффективная жидкостная хроматография или газовая хроматография с масс-спектрометрическим детектором (ВЭЖХ-МС, ГХ-МС), характеризующиеся низким пределом обнаружения и высокой прецизионностью. Однако эти методы требуют использования дорогостоящего оборудования, нуждающегося в высококвалифицированном обслуживании, что повышает стоимость и сложность анализа [3, 9, 10]. Методы иммуноферментного анализа позволяют с высокой чувствительностью и селективностью выявлять присутствие рактопамина в моче, сыворотке крови, мясе и кормах, характеризуются невысокой воспроизводимостью [7, 8].
В последнее время появились публикации, посвященные описанию оптических и электрохимических иммуносенсорных систем, предназначенных для экспрессного определения следовых концентраций рактопамина в пищевых продуктах [5]. Однако высокочувствительные пьезокварцевые гравиметрические сенсоры для определения рактопамина и других β-агонистов ранее не применялись. Пьезокварцевые иммуносенсоры положительно зарекомендовали себя для определения ряда низко- и высокомолекулярных соединений [1, 2]. Высокая чувствительность и селективность определения достигаются уникальным сочетанием физического преобразователя, в качестве которого выступает пьезокварцевый резонатор АТ-среза и природой рецепторных молекул, иммобилизованных на поверхности его электродов, в качестве которых наиболее часто используются антитела или антигены.
Цель настоящего исследования – изучение условий формирования распознающего слоя пьезокварцевого иммуносенсора на основе тиолов и силанов для высокочувствительного определения рактопамина в жидких средах.
Материалы и методы исследования
В работе были использованы следующие химические биореагенты: рактопамина гидрохлорид («Abcam», Великобритания), моноклональные антитела к рактопамину, бычий сывороточный альбумин – BSA («Sigma – Aldrich», США); органические растворители – диметилформамид (ДМФА), ацетон («Quimica», Испания), этанол, 96 %, хлороформ («Реахим», Россия); неорганические реактивы – соляная (ρ = 1,198 г/см3) кислота, хлорид, гидрофосфат, тетраборат и азид натрия; хлорид калия, дигидрофосфат и тиоционат калия; сульфат аммония («Реахим», Россия).
Для формирования распознающего слоя применяли; γ-аминопропилтриэтоксисилан - APTS («Reаnal», Венгрия); 2-амино-3-меркаптопропионовую кислоту, 11-меркапто-1-ундеканол, 2-меркаптоэтиламин («Sigma», США); в качестве кросс-реагентов - глутаровый альдегид - GA («Reanal», Венгрия), 1-этил-3-(3-диметиламинопропилкарбодиимид (EDAC), цианурхлорид (CC) («Sigma- Aldrich», США).
Рабочие растворы антител готовили путем разбавления препарата физиологическим фосфатным буферным раствором (PBS, рН 7,2), содержащим (г/л): NaCl (8,0); KCl (0,2); Na2HPO4∙12H2O (2,9); КH2PO4 (0,2).
Физическим преобразователем служил пьезокварцевый резонатор AT-среза с собственной частотой колебаний 10 МГц с электродами диаметром 10 мм (ЗАО «ЭТНА», Россия). Аналитический сигнал гравиметрического пьезокварцевого иммуносенсора (ΔF) измеряли на установке, описанной ранее [9].
Синтез конъюгатов рактопамина с BSA осуществляли методом активированных эфиров: к 5 мл раствора BSA (2 мг/мл) добавляли 5 мл раствора рактопамина (7 мг/мл), приготовленного на фосфатном буфере. Далее в течение 30 мин при непрерывном перемешивании к реакционной смеси по каплям добавляли раствор СС (2 мг/мл) в диметилформамиде с концентрацией 3 мг/мл. Выдерживали смесь при 25оС 2 часа и при 40С 12 часов при постоянном перемешивании. Очищали полученные конъюгаты от несвязавшихся молекул рактопамина методом диализа в течение суток против дистиллированной воды.
Иммобилизацию гаптен-белковых конъюгатов осуществляли на предварительно сформированную следующими способами подложку.
Способ 1. При помощи микрошприца на поверхность золотого электрода сенсора последовательно наносили 0.8 мкл APTS (высушивали при 80°С в сушильном шкафу в течение 20 мин), 5 мкл GA (2,5 %-ный раствор в бидистиллированной воде), затем 5 мкл раствора гаптен-белкового конъюгата. Сенсор помещали во влажную камеру (герметичный контейнер, в котором относительная влажность воздуха, определяемая с помощью психрометра, равна 99-100%) и выдерживали 12 ч при 4°С.
Способ 2. На поверхность сенсора наносили 5 мкл 11-меркапто-1-ундеканола и выдерживали 30 мин при комнатной температуре, далее наносили 5 мкл GA (2,5%-ный раствор в бидистиллированной воде), выдерживали 12 ч при 4оС, промывали раствором PBS.
Способ 3. На поверхность сенсора наносили 8 мкл 2-меркаптоэтиламина и выдерживали 30 мин при комнатной температуре. Активировали поверхность с помощью 5 мкл GA (2,5%-ный раствор в бидистиллированной воде) и выдерживали 12 ч при 4оС, промывали раствором буфера.
Способ 4. На золотые электроды сенсора наносили 1 мкл 2-амино-3-меркаптопропионовой кислоты (0,1%-ный раствор в этиловом спирте) и выдерживали 8 ч при температуре 22-23°C. Затем поверхность электрода сенсора промывали этиловым спиртом и добавляли по 5 мкл EDAC (2 %-ный раствор в ацетонитриле), выдерживали 20 мин при температуре 22-23°C и 12 ч при + 4°С, промывали раствором PBS.
Результаты работы и их обсуждение
Аналитическим сигналом гравиметрического пьезокварцевого иммуносенсора служит уменьшение частоты колебаний резонатора (∆ F) при увеличении массы рецепторного слоя за счет взаимодействия антител с рактопамином, иммобилизованного в виде белкового конъюгата на поверхности его электрода. Поверхностная концентрация антигенных детерминант, их доступность для связывания с антителами, устойчивость рецепторного слоя к регенерации существенно влияют на метрологические характеристики определения рапктопамина, а также на возможность многократного использования иммунореагентов. Оценка способов иммобилизации конъюгатов рактопамина осуществлялась с учетом массы биослоя ∆m (мкг), определяемой по уравнению 1,23∙∆f (∙∆f – разность частот колебания сенсора до и после иммобилизации), числу устойчивых циклов измерений N (аналитический сигнал не должен изменяться более чем на 5%), концентрационной чувствительности (А, Гц∙мл∙мкг-1), рассчитанной через отношение ∆ F к концентрации аналита в пробе (табл.1).
Таблица 1. Сравнительная характеристика способов формирования рецепторного слоя пьезокварцевого сенсора
|
Способ иммобилизации |
∆m |
А |
N |
|
1 |
27,85 |
475 |
30 |
|
2 |
27,69 |
474 |
25 |
|
3 |
22,76 |
323 |
22 |
|
4 |
13,69 |
168 |
10 |
Применение для получения подложки γ-аминопропилтриэтоксисилана (способ 1, рис. 1) обеспечивает прочную связь с поверхностью золотого электрода сенсора (N = 30), а использование в качестве бифункционального реагента глутарового альдегида способствует формированию гибкого, протяженного линкерного мостика, облегчающего связывание аналита с антителом, что подтверждается значением концентрационной чувствительности А.
При применении тиолов линейного строения (2-амино-3-меркаптопропионовая кислота, 11-меркапто-1-ундеканол, 2-меркаптоэтиламин) происходит формирование наноструктурированного самоорганизованного монослоя за счет связывания атома серы с поверхностью золотого электрода и поперечной сшивки, практически параллельно ориентированных друг относительно друга молекул тиолов. Аналитический сигнал и значение А выше для биослоя на основе 11-меркапто-1-ундеканола (474 Гц∙мл∙мкг-1), что может быть связано с более высокой массой ∆m, плотностью самоорганизованного слоя и концентрацией доступных антигенных детерминант после иммобилизации гаптен-белкового конъюгата. Несмотря на то что 2-амино-3-меркаптопропионовая кислота (способ 4) образует сверхсшитое и плотное покрытие, минимальные значения А свидетельствуют о недостаточной концентрации функциональных групп на поверхности подложки для связывания с биомолекулами.
Достоинством покрытий на основе γ-аминопропилтриэтоксисилана и 11-меркапто-1-ундеканола является устойчивость при соприкосновении с воздухом, водными и спиртовыми растворами в течение нескольких месяцев.
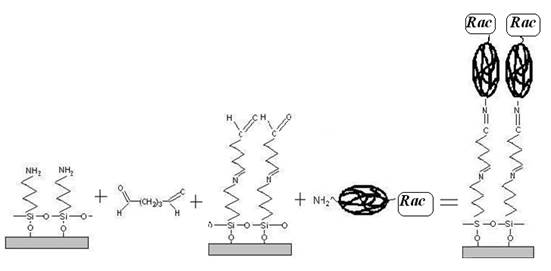
Рис. 1. Схема формирования распознающего слоя на основе γ-аминопропилтриэтоксисилана
С применением метода Скетчарда рассчитана константа аффинности антител (Каф = 1,02∙10-10 М-1), свидетельствующая о высоком сродстве и специфичности иммунореагентов.
Определение рактопамина осуществляли в конкурентном формате анализа: к пробе, содержащей рактопамин, добавляли фиксированное количество антител, соответствующее 50%-ному связыванию, и выдерживали в течение 2-3 мин. до завершения реакции образования гомогенного комплекса рактопамина с антителами. Затем пробу приводили в поток раствора носителя и регистрировали аналитический сигнал при взаимодействии несвязавшихся антител с рактопамин-белковым конъюгатом на поверхности электрода сенсора. Применение концентрации антител, соответствующей 50%-ному связыванию, позволяет достичь оптимального баланса между активными центрами на поверхности сенсора и концентрацией не связавшихся в гомогенный комплекс антител. Концентрация специфичных антител к рактопамину, соответствующая 50 % связыванию, составляла 2,7 мкг/мл. Аналитический сигнал сенсора обратно пропорционален концентрации рактопамина в анализируемой пробе.
Сопоставлены значения аналитических откликов сенсоров с рецепторным слоем, сформированным способами 1-4 (рис. 2). Более высокие значения ∆F зарегистрированы для способов 1 и 2 во всей области исследованных концентраций рактопамина в пробе.
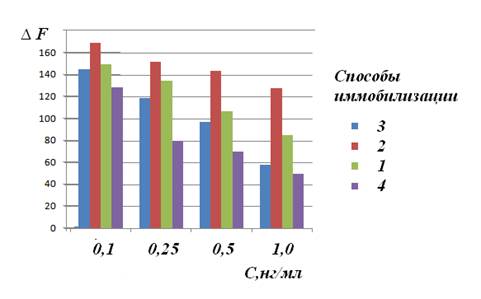
Рис. 2. Зависимость аналитического сигнала сенсора от концентрации рактопамина в пробе для различных способов формирования рецепторного слоя
В диапазоне 0,1-1,0 нг/мл отмечена линейная взаимосвязь между ∆F и концентрацией рактопамина в пробе для способов 1,2, коэффициент корреляции составляет 0,97 и 0,96 соответственно; предел обнаружения рактопамина – 0,05 нг/мл. Иммуносенсор может быть использован многократно после его регенерации 0,05 mM раствором KCNS, сохраняющим целостность биорецепторного слоя при достаточно быстром разрушении иммунного комплекса.
Заключение
Проведенное исследование выявило возможность использования пьезокварцевого иммуносенсора для высокочувствительного определения рактопамина в жидких пробах. Сравнительный анализ способов формирования рецепторного слоя сенсора показал, что предварительное получение подложки на основе γ-аминопропилтриэтоксисилана и 11-меркапто-1-ундеканола, на поверхности которой с помощью глутарового альдегида иммобилизованы конъюгаты рактопамина с BSA, позволяет осуществлять определение следовых концентраций рактопамина в пробе.
Работа выполнена при поддержке гранта РФФИ (грант №13-03-97505 «Селективность и эффективность молекулярного распознавания и определения гормонов и бэта-агонистов с помощью пьезокварцевого иммуно- и биомиметического сенсора»)
Рецензенты:
Дмитриенко С.Г., д.х.н., профессор, ФГБОУ ВПО «Московский государственный университет имени М.В. Ломоносова», химический факультет, г. Москва.
Оскотская Э.Р., д.х.н., профессор, зав. кафедрой химии, ФГБОУ ВПО «Орловский государственный университет», г. Орел.
Библиографическая ссылка
Васильев С.В., Попова М.В., Фарафонова О.В., Карасева Н.А., Ермолаева Т.Н. ФОРМИРОВАНИЕ РЕЦЕПТОРНОГО СЛОЯ ПЬЕЗОКВАРЦЕВОГО ИММУНОСЕНСОРА ДЛЯ ОПРЕДЕЛЕНИЯ СЛЕДОВЫХ КОНЦЕНТРАЦИЙ РАКТОПАМИНА // Современные проблемы науки и образования. 2014. № 1. ;URL: https://science-education.ru/ru/article/view?id=11917 (дата обращения: 11.02.2026).



