Для производства силикатных изделий автоклавного твердения, в том числе ячеистых, наряду с известью, обычно используют кварцевый песок [3, 4]. В Российской Федерации есть опыт применения взамен последнего полевошпатовых песков, хотя и отмечается, что они менее активно реагируют с известью, чем кварц.
Полевые шпаты, как известно, состоят из 3-х минералов: альбита NaAlSi3O8, микроклина KAlSi3O8 и ортоклаза СаAl2Si2O8 в различных количественных соотношениях, поэтому представляет интерес ранжирование этих минералов по гидратационной активности. Этот вопрос был исследован ранее путем определения растворимости кварца, альбита и микроклина в щелочной среде с рН = 12,8. При этом был сделан вывод, что кварц значительно активнее полевых шпатов, далее следует альбит и микроклин с небольшой разницей [1]. Ортоклаз в указанной работе не был исследован.
Представляет также интерес исследование активности β-CaSiO3 и стекла волластонитового состава как важнейших компонентов доменных, электротермофосфорных шлаков и некоторых зол.
Авторы исследовали этот вопрос с применением химической термодинамики.
Ее применение для ранжирования активности различных соединений требует отдельного рассмотрения. Нередко предпочтительность образования тех или иных соединений оценивают по величине свободной энергии ∆Gр реакции. Этот способ может быть использован лишь применительно к однотипным реакциям и их продуктам. Если же сравниваемые соединения содержат различное число атомов, то при прочих равных условиях, чем больше сумма а + b в соединениях АаBb, тем больше ∆Gр [7].
В связи с этим для реакций в водной среде авторы для оценки сравнительной гидратационной активности соединений (в данном случае SiO2 и силикатов) предлагают использовать величину активности ионов кремнекислоты в растворе.
Рассмотрим начальную стадию гидратации кремнеземных компонентов в автоклаве, в щелочной среде гидроксида кальция, исходя из общепринятого представления, что на самой начальной стадии реакции происходит присоединение гидроксильных групп к диоксиду кремния и силикатам, содержащим полимерные кремнекислородные анионы. При этом образуются мономерные или слабо полимеризованные (ди- и тримерные) анионы, которые легко реагируют с гидроксидом кальция в растворе, образуя гидросиликаты кальция.
Так как образование ди- и тримеров ортокремневой кислоты не сопровождается значительными термодинамическими эффектами, кроме того, для них нет надежных справочных данных по ∆G0473, ограничимся рассмотрением стадии образования мономера Н2SiO42-.
Исходные данные берем из [2, 5, 6]. Ниже излагаются результаты расчетов.
1. Смесь кварца с гидроксидом кальция.
![]()
Принимаем по [5], в ккал/моль :
![]() ;
; ![]()
![]() .
.
Тогда ∆Gр = -1,8 ккал/моль; lg Kp = 0.83;
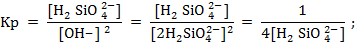
![]()
Отсюда получим![]()
![]() = 3,7∙10-2 моль/л = 2229 мг/л SiO2.
= 3,7∙10-2 моль/л = 2229 мг/л SiO2.
По данным [1], при 175 °С концентрация SiO2 в системе кварц – Са(ОН)2 составляет 2250 мг/л.
С учетом того, что в нашем расчете температура среды выше на 25 °С, а полученный результат – это активность (не концентрация) кремнекислоты, результат расчета можно считать удовлетворительным, так как при столь малых концентрациях ионов коэффициенты их активностей не намного ниже 1.
Рассчитаем рН среды.
![]()
![]()
2. Рассчитаем активность ионов кальция для основных минералов полевых шпатов.
Для альбита NaAlSi3O8 принимаем [5]:![]()
![]()
![]()
![]()
![]()
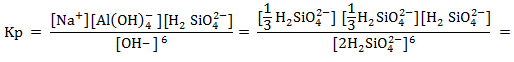
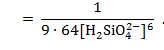
![]()
![]()
![]()
![]()
![]()
3. Для микроклина KAlSi3O8 принимаем ![]()
![]()
![]()
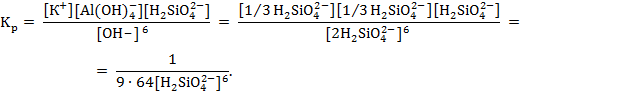
![]()
![]()
![]()
![]()
![]()
![]()
4. Для анортита – кальциевого полевого шпата – CaO∙Al2O3∙2 SiO2 принимаем ![]()
Схема реакции для начальной стадии гидратации этого минерала имеет вид:
![]()
Изменение свободной энергии при этой реакции:
![]()
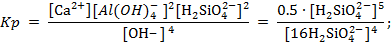
![]()
![]() 10-2
10-2![]() SiO2
SiO2![]()
![]()
![]() 10-2
10-2![]() 10-2
10-2![]()
![]()
Приведенные выше расчеты дают величины активности ионов кремневых кислот и алюминия, тогда как литературные данные, например [1], выражают растворимость этих ионов, определенную методами аналитической химии, поэтому расчетные данные по β-кварцу, альбиту и микроклину несколько отличаются от справочных. По кремнекислоте и ионам щелочей результаты термодинамических расчетов довольно близки к данным [1], а по оксиду алюминия последние в 2,5 раза выше рассчитанных нами. Причина этого неясна. Не исключено, что это результат несовершенства методов определения Al, разработанных более 40 лет тому назад.
В заключение рассмотрим щелочную активацию волластонита – важнейшего компонента доменных гранулированных и электротермофосфорных шлаков. Особенно велико содержание волластонита в виде стекла и кристаллической фазы в шлаках металлургических заводов, расположенных в европейской части России.
![]()
Схема реакции: ![]() Н2О
Н2О ![]() Са2+
Са2+![]() ;
;
![]()
![]()
![]() Са2+
Са2+![]() 2
2![]()
![]()
![]() SiO2
SiO2![]()
![]()
Для CaSiO3 (стекло): ![]()
![]()
![]()
![]()
![]()
![]() 10-2
10-2![]() SiO2
SiO2![]()
![]() 10-2
10-2![]() 10-2
10-2![]()
Так как в данном случае при гидратации волластонита гидроксильные группы практически не участвуют в химической реакции, рН среды близок к 12,5–12,8, характерному для насыщенного раствора Са(ОН)2.
Результаты расчетов показывают, что кристаллический волластонит очень слабо реагирует с водой даже при 200 °С. Наши эксперименты показали, что при 250 °С водная суспензия тонкомолотого волластонита с Sуд. = 300 м2/кг при В/Т = 0,4 не схватывается и не твердеет.
В то же время стеклообразный волластонит при 175 – 200 °С обладает высокой гидратационной активностью. Гранулированные шлаки волластонитового состава используются в качестве самостоятельных вяжущих при температуре выше 150–160 °С, а со щелочным активатором – при 25–90 °С.
Особенность шлаков волластонитового состава как сырья для производства силикатных материалов автоклавного твердения состоит в том, что при их запарке в щелочной среде в принципе возможен прямой синтез тоберморита и ксонотлита, а не двухступенчатый, с промежуточным образованием двухосновного гидросиликата кальция C2SH(A), как это происходит в системе кварц – Са(ОН)2 в автоклаве.
Не исключено, что при этом может образоваться более совершенная структура твердения гидросиликатной связки силикатных изделий автоклавного твердения.
Изложенное дает основание проранжировать силикатные компоненты в порядке уменьшения их способности активироваться в щелочной среде при температуре 190–200 °С: волластонит стеклообразный > кварц > микроклин > альбит > анортит > β – волластонит.
Рецензенты:
Евтушенко Е.И., д.т.н., профессор, проректор по науке, зав. кафедрой Технологии стекла и керамики ФГБОУ ВПО «Белгородский государственный технологический университет им. В.Г. Шухова», г. Белгород.
Борисов И.Н., д.т.н., профессор, зав. кафедрой Технологии цемента и композиционных материалов ФГБОУ ВПО «Белгородский государственный технологический университет им. В.Г. Шухова», г. Белгород.
Библиографическая ссылка
Кафтаева М.В., Рахимбаев И.Ш., Шарапов О.Н. ТЕРМОДИНАМИЧЕСКИЙ РАСЧЕТ СРАВНИТЕЛЬНОЙ ГИДРАТАЦИОННОЙ АКТИВНОСТИ СИЛИКАТНЫХ КОМПОНЕНТОВ ГАЗОБЕТОНОВ АВТОКЛАВНОГО ТВЕРДЕНИЯ // Современные проблемы науки и образования. 2014. № 1. ;URL: https://science-education.ru/ru/article/view?id=11593 (дата обращения: 28.01.2026).



