Периодические крупномасштабные вспышки массового размножения лесных насекомых-фитофагов с высоким биотическим потенциалом наносят значительный эколого-экономический ущерб лесным биоценозам. Несмотря на большое количество публикаций по этой проблеме, многие важные аспекты взаимоотношений в системе: «дерево-насекомые» до настоящего времени остаются недостаточно изученными. К их числу относится и проблема изучения биохимических механизмов энтоморезистентности древесных растений, так как именно уровни конститутивной и индуцированной энтоморезистентности детерминируют как степень дефолиации древостоев, так и предотвращение повторной дефолиации крон [1].
В системе взаимоотношений «дерево – насекомые» биохимический состав кормового субстрата (хвои и листьев) имеет исключительно важное значение. Это обусловлено тем, что многие вторичные метаболиты в хвое и листьях растений в значительной степени детерминируют параметры энтоморезистентности кормового субстрата [2,6,8,11,18,20,21,23-25]. Установлено, что протективными свойствами против насекомых обладают аллелохимики из всех классов вторичных метаболитов: терпеноиды, фенолы, алкалоиды [2,6,8,11,18,20,21,23,24].
Для лиственных древесных растений наибольшее значение в энтоморезистентности имеют фенольные соединения [11]. Включение механизмов индуцированной энтоморезистентности (как быстрой, так и замедленной) вызывает у насекомых-фитофагов быстрое снижение выживаемости популяции за счет высокой смертности, снижение плодовитости и скорости онтогенеза [2,4,8,11,18,20,21,23,24]. Многие исследования показали, что в листьях кормовых растений после дефолиации насекомыми-фитофагами повышается количество фенолов и других веществ с «антибиотическими» свойствами [2,7,20,21,23].
Одним из ключевых факторов активации механизмов вспышки массового размножения лесных насекомых-филлофагов является воздействие абиотического стресса (засух) на потенциально низкорезистентные древостои, изменяющее кормовую ценность хвои и листьев и параметры антифидантной активности. Это направление остается менее изученным. Результаты исследований очень противоречивы. Так, ряд авторов сообщает о снижении содержания фенольных соединений в листьях березы повислой под действием засухи [3], ивы [16], о снижении содержания фенолгликозидов у осины при воздействии засухи [22], о снижении содержания фенольных соединений в хвое сосны при засухе [25], другие – об увеличении содержания фенолгликозидов в листьях Populus nigra при воздействии засухи [10], возрастании содержания терпенов и алкалоидов [17,19]. Не сложилось однозначного мнения и о влиянии засухи на скорость роста насекомых, выживаемость, плодовитость и плотность популяции. Ряд исследователей не обнаружили заметного влияния этого фактора на перечисленные параметры популяций насекомых [15], другие выявили положительное воздействие засухи на насекомых [19]. Hall et all обнаружили снижение роста гусениц непарного шелкопряда при засухе [10]. В связи с этим нельзя исключить определенную видоспецифичность реакции как разных видов древесных растений на засуху [10], так и разных видов насекомых. Имеются, также, предположения о разных защитных функциях различных фенольных соединениях. Так, по мнению ряда исследователей, фенолгликозиды и алкалоиды осуществляют защитные функции листьев от повреждения насекомыми (за счет антифидантных свойств) [7,12,13]. Флавоноиды и фенольные кислоты осуществляют антиоксидантную защиту клеток листьев [9,16]. Задачей данного исследования было изучение с помощью ВЭЖХ воздействия фактора абиотического стресса (весенне-летних засух) на состав и содержание фенольных соединений в листьях березы повислой в потенциально низкорезистентных насаждениях (в очагах) и высокорезистентных (вне зоны вспышек), ослабленных антропогенными факторами в условиях лесостепи Зауралья.
Материалы и методы
Для хроматографического анализа проводился сбор листьев березы повислой из очагов массового размножения непарного шелкопряда на пробных площадях с ежегодно регистрируемым процентом дефолиации крон и за границей очагов, где отсутствовала дефолиация. Взятие каждой пробы осуществлялось от нескольких деревьев. Затем пробы смешивались для получения средней пробы. Район очагов массового размножения находится в Каменск-Уральском р-не Свердловской обл. Пробная площадь № 1 и 2 располагалась в березняках вблизи пос. «Покровское», № 3 – вблизи пос. «Кисловское». Контрольные пробы взяты в березняках вблизи пос. Храмцово, растущих в сходных лесорастительных условиях.
Сразу после сбора листья березы высушивали при комнатной температуре, затем размалывали. После этого навеску с 2 г. размолотых листьев смешивали с 20 мл 95% этанола. Экстракцию фенольных соединений из листьев березы проводили в обратном холодильнике на водяной бане в течение 30 мин при кипении раствора. После этого суспензию центрифугировали при 10000 g в течение 10 мин. Хроматографический анализ проводили на жидкостном хроматографе Scimadzu LC-20 со спектрофотометрическим УФ детектором. Детектирование элюента осуществляли одновременно на двух полосах поглощения: 254 и 360 нм на хроматографической колонке PerfectSil Target ODS-3 5мкм с обращенной фазой, размерами 250 х 4,6 мм.
Градиентное элюирование проводилось в диапазоне 10–50 % со скоростью 1 мл в мин при температуре 40 0 С. Элюент А – ацетонитрил – 0,05 М фосфатный буферный раствор (рН=3,0); элюент В – ацетонитрил-вода (9:1). Продолжительность хроматографического анализа – 45 мин при 400 С. Из них от 0 до 30 мин проводилось градиентное элюирование в диапазоне 10- 50%, затем в течение 15 мин при концентрации 50 %. Для идентификации фенольных соединений использовали вещества-свидетели фирмы: Fluka, Sigma, Aldrich: кверцетин, изокверцетин, кафтаровая к-та, гиперозид, галловая к-та, гидрохинон, рутин, кофейная к-та, феруловая к-та, аскорбиновая к-та, 3-кофеоилхинная к-та, 4-кофеоилхинная к-та, 5-кофеоилхинная к-та, кемпферол, мирицетин.
Результаты
Хроматографический анализ (ВЭЖХ) фенольных соединений из листьев березы повислой из затухших очагов массового размножения непарного шелкопряда и за их границами выявил 51-54 различных соединения (рис. 1). Из общего количества фракций нами идентифицировано 13 фенольных соединений. Список идентифицированных нами фенольных соединений представлен в табл. 1. По химическому составу это были флавоноиды, фенолкарбоновые и гидроксикоричные кислоты.
Нами проведен как тотальный сравнительный количественный попарный анализ всех выявленных при хроматографии пиков, так и анализ идентифицированных нами фенольных соединений. Тотальный попарный сравнительный анализ образцов из затухших очагов с максимальной дефолиацией и контрольных древостоев (за границами очагов) убедительно продемонстрировал, что эти образцы значительно отличались между собой.
В целом нами было идентифицировано три типа реакции: нейтральная (отсутствие количественных изменений в составе идентичных пиков), возрастание содержания соединения в составе фракции и его снижение (рис. 2).
Как показали результаты тотального сравнительного изучения хроматограмм, в образцах из затухших очагов с максимальной дефолиацией (очаг: «Покровское 1») наблюдается значительное доминирование фракций с заметным снижением содержания соединений в пике (67,5%), по сравнению с контролем (рис. 2). При этом обращает внимание значительный уровень изменения содержания этих соединений. Нередко он достигал 70-120%, по сравнению с контролем. Возрастание содержания фенольных соединений выявлено лишь у 10% пиков. Нейтральная реакция, отсутствие каких-либо количественных изменений, наблюдалась у 22,5% (рис. 2).
Тотальный попарный сравнительный анализ образцов из группы №2 (очаг: «Покровское 2») затухших очагов и контрольных древостоев (за границами очагов) убедительно продемонстрировал, что эти образцы, как и в предыдущем варианте, значительно отличались между собой. В составе хроматограмм из очагов, так же, как и в предыдущем варианте, наблюдается преобладание фракций, содержание фенольных соединений в которых снижается, по сравнению с контролем (58,7%) (рис. 2). При этом степень снижения варьирует, в пределах 30-65%, т.е. довольно значительна. У 7% наблюдается нейтральная реакция, у 34,3% содержание этих соединений возрастает. Тотальный попарный сравнительный анализ образцов из участка № 3 (очаг: «Кисловское») и контрольных древостоев убедительно продемонстрировал, что эти образцы, как и в предыдущих вариантах, значительно отличались между собой.
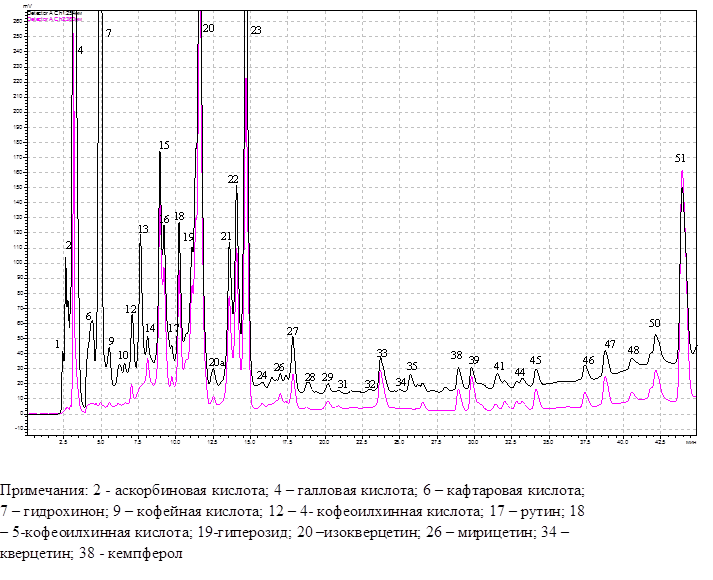
Рис. 1. ВЭЖХ экстракта из листьев березы повислой из очагов непарного шелкопряда
В образцах из очагов также наблюдается доминирование фракций с заметным снижением содержания соединений в пике (62,9%) (рис. 2). Количество фракций с возрастанием содержания фенолов не превышало 29,3%. Нейтральная реакция наблюдалась у 7,8% хроматографических пиков. При этом обращает внимание значительный уровень изменения содержания этих соединений.
Следует отметить, что, в отличие от древостоев в пробах №1-2 в насаждениях участка № 3 (очаг: «Кисловское») уже в течение последних 6 лет, отсутствовала средняя и сильная дефолиация, а наблюдалась лишь 0–10 %-ная дефолиация крон. Кроме того, в березняках этого участка отсутствовало и резкое колебание заселенности березы кладками непарного шелкопряда, как это было характерно для двух предыдущих участков, а средняя заселенность кладками была значительно ниже (в год взятия проб), чем в двух остальных участках. В то же время в этих древостоях в предыдущие годы (Колтунов, 2006) наблюдалась вспышка массового размножения с сильной дефолиацией крон.
Сравнительный анализ характера изменений содержания фенольных соединений в трех затухших локальных очагах убедительно демонстрирует их близкое сходство и явное доминирование тенденций к снижению содержания этих соединений, по сравнению с контролем.
Примерно такой же спектр тенденций выявлен нами и при сравнительном попарном анализе идентифицированных фенольных соединений. Но распределение по характеру изменений заметно различались (табл. 1). Выявлено, что количество идентифицированных фенольных соединений, содержание которых снижается (в год засухи) было одинаковым с соединениями, содержание которых возрастает (табл. 1).
Как показали результаты, в древостоях которые ранее периодически подвергались средней и сильной дефолиации (ПП1), содержание ряда фенольных соединений в листьях березы оказалось достоверно ниже, чем в контрольных древостоях (без дефолиации) (табл. 1). Это галловая кислота, кверцетин, изокверцетин, кафтаровая кислота, мирицетин, а также аскорбиновая кислота. Содержание ряда других фенольных соединений в листьях ранее дефолиированных древостоев, наоборот, заметно возрастало. Это рутин, кофейная кислота, гидрохинон; гиперозид, 5-кофеоилхинная кислота, 4-кофеоилхинная кислота.
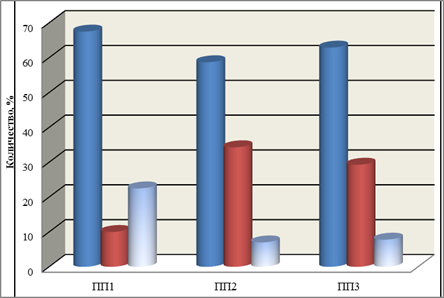
Рис. 2. Влияние фактора абиотического стресса (весенне-летней засухи) на изменение содержания фенольных соединений при тотальном попарном анализе пиков хроматограмм из затухших очагов, по сравнению с контролем (без дефолиации). По вертикали: изменение содержания фенольных соединений в пробе (в % по отношению к контролю). Слева-направо:1. снижение, 2.-возрастание, 3-отсутствие изменений.ПП1-листья березы из очага: «Покровское 1»; ПП2- листья березы из очага: «Покровское 2»; ПП3 - листья березы из очага «Кисловское».
Таблица 1. Влияние фактора абиотического стресса (весенне-летней засухи) на содержание фенольных соединений в листьях березы повислой
|
Наименование соединения |
Изменение содержания соединения (в % по отношению к контролю) |
||
|
|
ПП №1 |
ПП №2 |
ПП №3 |
|
Кверцетин |
-61,80±5,62 |
-47,80±3,82 |
-25,00±2,70 |
|
Кафтаровая к-та |
-26,06±2,36 |
-15,06±1,61 |
+40,12±5,31 |
|
Гиперозид |
+17,06±1,87 |
+37,06±4,27 |
+232,87±26,18 |
|
Галловая к-та |
-71,14±6,91 |
-34,84±4,12 |
-69,98±7,11 |
|
Кемпферол |
0,00 |
0,00 |
+16,19±2,14 |
|
Изокверцетин |
-91,13±11,42 |
-68,29±8,12 |
-91,59±10,33 |
|
Рутин |
+27,49±1,84 |
+136,9±11,92 |
+122,42±13,10 |
|
Кофейная к-та |
+13,85±1,12 |
+55,12±4,95 |
+24,46±2,64 |
|
Аскорбиновая к-та |
-34,25±2,46 |
-18,43±1,64 |
-41,55±5,22 |
|
Гидрохинон |
+74,36±6,11 |
+54,19±5,29 |
-31,45±2,75 |
|
Мирицетин |
-55,23±6,41 |
-71,51±6,94 |
-62,90±7,31 |
|
4- кофеоилхинная к-та |
+64,29±4,19 |
-32,54±2,77 |
-12,66±1,42 |
|
5- кофеоилхинная к-та |
+68,30±7,71 |
+26,65±2,24 |
+100,10±12,36 |
Содержание ряда идентифицированных нами фенольных соединений в листьях березы из очагов «Покровское 2» также оказалось достоверно ниже, чем в контрольных древостоях (без дефолиации), (табл. 1). Их количество было выше, за счет 4-КФК, в остальном их состав идентичен предыдущему варианту. Количество и состав фенольных соединений, содержание которых заметно возрастало было таким же, как и в предыдущем варианте, исключая 4-КФК. Как показали результаты, содержание ряда фенольных соединений в листьях березы из затухших очагов вблизи пос. «Кисловское» также оказалось достоверно ниже, чем в контрольных древостоях (без дефолиации), (табл. 1). Это галловая кислота, кверцетин, изокверцетин, 4-кофеоилхинная кислота, мирицетин, гидрохинон, а также аскорбиновая кислота. Содержание ряда других фенольных соединений в листьях ранее дефолиированных древостоев, наоборот, заметно возрастало. Это рутин, кофейная кислота, гиперозид, кафтаровая кислота, 5-кофеоилхинная кислота, кемпферол (табл. 1). Во всех трех вариантах характер реакции на стресс одинаковых соединений, за единичным исключением, был идентичным.
Столь явно выраженное тотальное снижение содержания ряда фенольных соединений в листьях березы повислой в затухших очагах массового размножения, в отличие от тенденций в березняках за границами очагов (предположительно имеющих высокий уровень энтоморезистентности) мы связываем с воздействием фактора абиотического стресса (летней засухи) в июне (ГТК-0,51), августе 2013 г. (ГТК-0,49) и заметными различиями в уровне реакции на фактор абиотического стресса между потенциально низкорезистентными березняками (из затухших очагов) и высокорезистентными (за границами очагов), что было обнаружено нами ранее [5,14].
Сравнительный анализ спектра идентифицированных фенольных соединений, реагирующих идентично, показывает на близкое сходство реакций в обоих группах древостоев из затухших очагов. Это, в свою очередь, может быть подтверждением того, что и основная причина столь сходного характера реакции и спектра соединений, реагирующих идентично, может быть одинаковой. Это более значительная реакция на локальный фактор абиотического стресса (локальную засуху) древостоев с потенциально низкой энтоморезистентностью.
Сравнительный анализ результатов, полученный нами ранее [6] и в настоящее время отчетливо демонстрирует разнонаправленность реакций фенольных соединений в листьях березы в ответ на воздействие фактора индуцированной энтоморезистентности (слабая дефолиация крон березы) и фактора абиотического стресса (летней засухи 2013 г). Так, если воздействие фактора индуцированной энтоморезистентности сопровождается заметной активацией интенсивности синтеза большей части фенольных соединений, то воздействие фактора абиотического стресса, наоборот, вызывает, в основном, заметное ингибирование их синтеза. При этом заметно, что часть идентифицированных нами фенольных соединений активно участвует и в реализации функции индуцированной энтоморезистентности, и реализации ответной реакции на воздействие фактора абиотического стресса (засухи), вызывая ингибирование синтеза этих соединений в листьях березы.
Как известно [3], механическое повреждение листьев (дефолиация) сопровождается активизацией синтеза флавоноидов, выполняющих защитную и антиоксидантную функции. Можно предполагать, что именно с этим механизмом связано увеличение содержания флавоноидов в листьях в слабодефолиируемых березняках [6]. Учитывая то, что поедание листьев ранее дефолиированных деревьев вызывает у непарного шелкопряда снижение выживаемости, можно предполагать, что, по крайней мере, часть фенольных соединений в листьях березы после дефолиации обладает антифидантной активностью. Поэтому ингибирование синтеза фенольных соединений после воздействия фактора абиотического стресса (засухи), выявленное нами, часть из которых, вероятно, также обладает хорошо выраженным антифидантным эффектом, сопровождается улучшением их кормовых параметров и резким ростом выживаемости популяции насекомых при питании кормовым субстратом [5]. Факт ингибирования синтеза фенольных соединений в листьях после воздействия абиотического стресса (засухи), подтверждается и другими авторами [3,22].Совершенно очевидно, что механизм воздействия засух не исчерпывается возможным ингибированием синтеза ряда фенольных соединений с антифидантным эффектом на насекомых. Наиболее вероятно, что абиотический стресс оказывает комплексное воздействие, как за счет более благоприятной температуры для развития насекомых, так и за счет повышения качества кормового субстрата (возрастания содержания углеводов, белков в листьях). Мы предполагаем, что в этом комплексном механизме важная роль может принадлежать и механизму стрессового ингибирования синтеза фенольных соединений с антифидантными свойствами.
Получены экспериментальные доказательства, о том, что березовые насаждения в затухших очагах имеют потенциально низкий уровень энтоморезистентности, вследствие чего их уровень реакции на фактор абиотического стресса (засуху) (ингибирование синтеза фенольных соединений) значительно выше, чем в березняках за пределами границ очагов массового размножения непарного шелкопряда, которые произрастают в сходных лесорастительных условиях. Другим важным результатом, полученным в результате исследований, является, то, что определенная часть из идентифицированных нами фенольных соединений активно участвует и в реализации индуцированной дефолиацией энтоморезистентности и в реализации реакции на фактор абиотического стресса. Но характер их реакции значительно различается.
Проект выполнен при финансовой поддержке РФФИ (грант № 13-04-96063) и Правительства Свердловской области
Рецензенты:
Усольцев В.А., д.с.-х.н., профессор, профессор Уральского государственного лесотехнического университета, г. Екатеринбург.
Менщиков С.Л., д.с-х.н., заведующий лабораторией экологии техногенных растительных сообществ ФГБУН Российской Ботанический сад Академии наук, г. Екатеринбург.
Библиографическая ссылка
Колтунов Е.В., Хамидуллина М.И. ВЛИЯНИЕ АБИОТИЧЕСКОГО СТРЕССА (ЗАСУХИ) НА СОДЕРЖАНИЕ ФЕНОЛЬНЫХ СОЕДИНЕНИЙ В ЛИСТЬЯХ БЕРЕЗЫ ПОВИСЛОЙ (BETULA PENDULA ROTH.) ИЗ ОЧАГОВ НЕПАРНОГО ШЕЛКОПРЯДА (LYMANTRIA DISPAR L.) // Современные проблемы науки и образования. 2014. № 1. ;URL: https://science-education.ru/ru/article/view?id=11567 (дата обращения: 11.02.2026).



