Использование кристаллов гидроксиапатита («Радиесс») в дерматологической практике не могло не привлечь к нему широкого, а по результатам эстетической медицины вполне заслуженного внимания [9, 12, 15]. При этом используемые в косметологии кристаллы можно расценить как природные, поскольку они входят в состав зубов и костного скелета и в качестве биоматериала не вызывают эффекта отторжения [5]. Одной из основных особенностей этого филлера является активация процесса коллагеногенеза, который меняет морфологический статус дермы в зоне инъекции. Несмотря на ряд достаточно интересных работ [4, 5, 10], механизм такого ответа до конца остается не изученным.
Целью настоящего исследования является изучение динамики морфологических изменений, происходящих в зоне инъекции препарата «Радиесс» в эксперименте, а также оценка статуса микробицидной системы нейтрофильных лейкоцитов крови на его введение.
Материал и методы. Для изучения морфологических изменений в зоне инъекции препарата «Радиесс» поставлены серии экспериментов in vivo. Объектом исследования послужили беспородные крысы-самцы весом 200-250 г. (24 особи). Препарат вводили интрадермально в объеме 0,05 мл в заднюю часть шеи (холку) всем экспериментальным животным одновременно. Оценку результатов проводили через 2, 4, 6 , 8 и 16 недель. Группе интактных животных (фоновый контроль) вводили стерильный физиологический раствор в той же дозе. Для морфологического изучения использовали кусочки кожи с заделкой материала в парафин. Окраску срезов проводили гематоксилином и эозином по Вейгерту и Вангизону [11]. Для оценки иммунологической реакции на введение препарата изучен микробицидный статус нейтрофильных лейкоцитов периферической крови крыс с определением уровня неферментных катионных белков (КБ) по В.Е. Пигаревскому [3] и активности миелопероксидазы (МП) по Sato (модификация) [2]. Изображения микросфер в формате TIF получали с цифровой камеры для микроскопии DCM 310. Анализ полученных изображений проводили с помощью компьютерной программы Scion Image фирмы Scion Corparation, сертифицированной в 2000 году National Institute of Heals (USA). Все цифровые данные подвергались статистической обработке с использованием программы Microsoft Excel.
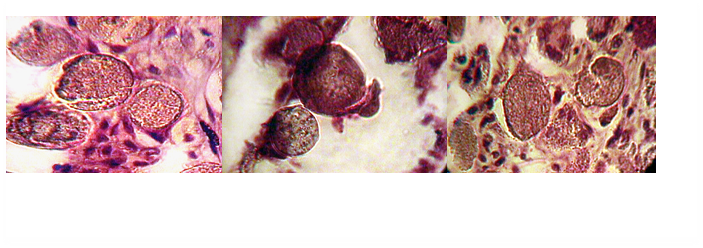
Результаты и обсуждение. Изучение микропрепаратов в объёме стандартизированных морфологических тестов показало, что спустя две недели после инъекции «Радиесс» в микропрепаратах четко типируются участки, заполненные микросферами, соединительная ткань вокруг зоны введения филлера растянута, коллагеновые волокна местами разорваны. У отдельных животных в зоне вокруг инъекции можно увидеть большое количество мелких кровеносных сосудов, заполненных эритроцитами (явление стаза). К концу 2 недели на поверхности единичных микросфер появляются плоские клетки, они располагаются на одной из сторон и напоминают собой маленькие базофильно окрашенные «шапочки». Спустя 4 недели конгломераты, сформированные микросферами, сохраняются, однако между ними появляются относительно короткие, тонкие оксифильно окрашенные фибриллы коллагена. Здесь же выявлено появление большого количества уплощенных базофильно окрашенных фибробластов. Лишь у одного из экспериментальных животных в срок, соответствующий 4 неделям, вокруг группы микросфер видны заполненные эритроцитами кровеносные капилляры, в этих участках видна лейкоцитарная инфильтрация, местами встречаются плазматические клетки (Рис.1).
На 8-й неделе эксперимента в препарате сохраняется достаточно много микросфер, но отчетливо видно, что они собраны в группы, насчитывающие 5-6 микросфер, и окружены веретеновидными клетками, окрашенными базофильно, вероятно, это фибробласты. На поверхности микросфер отчетливо видны уплощенные клетки, они распластаны по поверхности микросфер. Местами удается типировать, что эти клетки уже содержат многочисленные ядра, не исключено, что это макрофаги, трансформированные в остеокласты (Рис.2).
На 16-й неделе микросферы располагаются также группами, но число их гранул в составе этих групп снижено. Контуры большинства микросфер четкие, на поверхности их сохраняются остеокласты. Другие микросферы окружены темным диффузным ободком, часть материала становится рыхлой с зонами просветления, что свидетельствует об их фрагментации. Между микросферами, а также на отдельных участках зоны инъекции, отчетливо видны оксифильно окрашенные, собранные в пучки, фибриллярные волокна, они достаточно тонкие, а между ними типируются клетки округлой формы с четко структурированными ядрами (Рис.3).



При морфометрии микросфер оказалось, что их диаметр, начиная с 4 недели наблюдения, в среднем составляет 23+0,61мкм. С пролонгированием срока наблюдения до 8 недель происходит размывание границ микросфер, они уплощаются, а средний диаметр их увеличивается до 25+0,61 мкм. К концу 16 недели размер микросфер в среднем составляет 27+ 0,67. При этом на всех сроках наблюдения различия статистически достоверны ( р< 0,01). Изучение средней оптической плотности микросфер в зоне инъекции показало, что в срок, соответствующий 2 неделям, средняя оптическая плотность составляет 76,1+1,12. Спустя 4 недели средний показатель соответствует 79,2+ 1,8, а к концу 8 недели возрастает до 84,47+ 1,55, с тем чтобы резко снизиться спустя 16 недель от начала эксперимента. К этому периоду средняя оптическая плотность большинства микросфер составляет 73,8 + 1,16, обнаруживая статистически достоверное различие по отношению к 8-ой неделе эксперимента.
Результаты изучения микробицидного статуса нейтрофильных лейкоцитов, показали, что на 4 неделе эксперимента активность миелопероксидазы (МП) нейтрофильных лейкоцитов составляет в среднем 2,17+0,012 при коэффициенте вариации, равном 9,38%. При этом уровень неферментных катионных белков (КБ) был равен 2,28+ 0,08, а коэффициент вариации – 11,40%. Сравнение полученных результатов с данными контроля – (2,23+0,09) и (2,31+0,17) указывают на отсутствие статистически значимых различий, (P>0,05). Эти результаты нашли подтверждение и в случае изучения местного иммунного ответа в зоне инъекции препарата «Радиесс» на мазках-отпечатках. Так, оказалось, что единичные нейтрофильные лейкоциты, выявляемые в поле зрения, отличаются одинаковым с контролем уровнем содержания катионного белка и активностью миелопероксидазы.
Обсуждение. Результаты изучения кристаллов гидроксиапатита в качестве препарата волюмизации подтвердило его биосовместимость, отсутствие некрозов и тканевой дегенерации [7, 14, 15]. Особое значение придается его способности активизировать процесс коллагеногенеза внутри макропористых микросфер или вокруг них при микропористой структуре [4, 8]. Механизмы активации этого процесса в литературе дискутируются [4, 8]. Проведенное нами исследование показало, что интрадермальное введение кристаллов гидроксиапатита действительно приводит к изменению морфологического статуса дермы. Так, спустя 2 недели после инъекции вокруг кристаллов сохраняются разорванные коллагеновые волокна и явления геморрагического стаза. При этом на поверхности отдельных микросфер типируются молодые макрофаги, а в зоне вокруг микросфер появляются фибробласты. Не исключено, что описанные изменения отражают первую фазу реакции дермы на введение биоматериала. Исследованиями, проведенными Coleman K. et аll [5] в эксперименте, также показано, что инъекция препарата «Радиесс» не приводит к формированию капсулы, а интрадермальное введение его вызывает более активный неоколлагенез, чем субдермальное. С пролонгированием срока наблюдения за зоной инъекции кристаллов гидроксиапатита оказалось, что вокруг фибробластов начинают появляться тонкие короткие оксифильно окрашенные волокна, последние располагаются неупорядоченно, но эффект капсулирования здесь отсутствует. Местами видно, что фибриллы собираются в плотные пучки. Макрофаги, расположившиеся в первые две недели на поверхности микросфер, приобретают большое число ядер и теперь напоминают клетки остеокласты. Несмотря на то, что они плотно контактируют с микросферами, эффект герметизации полости резорбции здесь отсутствует и процесс деминерализации, присущий истинным остеокластам, не происходит. Считают, что в основе разрушения кристаллов гидроксиапатита, скорее всего, лежит процесс ферментативного остеолизиса, а не фагоцитоза [9]. При этом утилизация фосфатных ионов и их метаболизм протекают по типу регулируемого гомеостаза [13]. Что касается размеров микросфер, инъецированных в зону дермы, то нами выявлены изменения этого параметра, а также определена динамика оптической плотности. При этом между ними существует обратная коррелятивная связь: размеры кристаллов в срок наблюдения до 18 недель увеличиваются за счет их декомпактизации, а величина оптической плотности, напротив, снижается. По данным Lemperle et all [9], уменьшение размеров кристаллов регистрируется в период от 3-х до 9 месяцев. При этом часть микросфер деформируется и фрагментируется. Проведенное исследование позволяет представить следующую динамику морфологического статуса компонентов дермы на введение препарата «Радиесс»:
1. В первые 2 недели – увеличение числа фибробластов и появление в зоне инъекции макрофагов.
2. На 4 неделе – трансформация макрофагов в остеокласты и начало синтеза коллагена фибробластами.
3. Увеличение размеров микросфер в течение первых 16 недель наблюдения и снижение их оптической плотности.
4.Сохранение микробицидного статуса нейтрофильных лейкоцитов на всех сроках эксперимента.
Рецензенты:
Алексанянц Г.Д., д.м.н., профессор, проректор по научно- исследовательской работе ФГБОУ ВПО КГУФКСТ, г. Краснодар.
Павлюченко И.И., д.м.н., профессор, декан фармацевтического факультета ГБОУ ВПО КубГМУ Минздрава России, г. Краснодар.
Библиографическая ссылка
Могильная Г.М., Фомичева Е.В. ДИНАМИКА МОРФОЛОГИЧЕСКОГО СТАТУСА ДЕРМЫ В ОТВЕТ НА ВВЕДЕНИЕ КРИСТАЛЛОВ ГИДРОКСИАПАТИТА // Современные проблемы науки и образования. 2013. № 6. ;URL: https://science-education.ru/ru/article/view?id=11087 (дата обращения: 03.03.2026).



