Введение
Силикагели, модифицированные амфолитами, находят применение как сорбенты, содержащие кислотные и основные функциональные группы [3]. Традиционно распространенным способом получения устойчивой модифицированной поверхности является «прививка» функциональных групп [5]. Привитые аминокислоты, аминофосфоновые кислоты служат перспективными сорбентами ионов щелочно-земельных и переходных металлов. Координационными центрами при адсорбции служат как аминогруппы [5; 6], так и фосфоновые группы [7]. Метод «прививки» достаточно сложен, требует подбора дорогих кремнийорганических модификаторов поверхности и использования реакций органического синтеза. Альтернативным изложенному выше способу получения является включение молекул амфолитов в кремнекислородный каркас силикагеля на стадии его получения. Конденсация молекул кремневых кислот и образование кремнекислородного каркаса геля вокруг молекул модификатора позволяют нековалентно иммобилизовать их [9]. Исследование закономерностей и механизмов адсорбции ионов металлов сорбентом с иммобилизованным амфолитом требует предварительного изучения протолитических свойств его функциональных групп.
В данной работе методами термического анализа и потенциометрического титрования при разной ионной силе были исследованы температурная устойчивость и протолитические свойства карбоксильных групп и аминогрупп аминокислот лейцина пролина и тирозина, иммобилизованных в силикагелях. Ранее подобные исследования не проводились.
Материалы и методы исследования
Силикагели получали по золь-гель методу в кислой среде. Молярное соотношение тетраэтоксисилана, воды и соляной кислоты в исходной смеси для гидролиза составило 1:15:0,35 соответственно [11]. В качестве гомогенизирующего агента использовали этиловый спирт. Процесс получения силикагеля включал в себя нагревание исходной смеси в течение трех часов при 50 ºС с последующим гелеобразованием и сушкой до постоянной массы в течение 2–3 суток при температуре 100 ºС. Полученные образцы измельчали и просеивали через сито с размером ячеек 0,1 мм.
Для иммобилизации в матрице силикагелей были выбраны аминокислоты лейцин, пролин и тирозин (рис. 1).
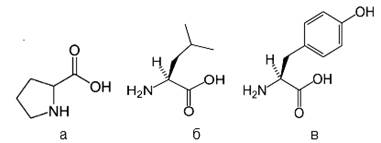
Рис. 1. Формулы использованных в работе аминокислот:
а – пролин; б – лейцин; в – тирозин
Размер молекул выбранных аминокислот позволяет предположить их фиксацию в порах синтезируемого силикагеля. Другим обоснованием выбора служило наличие в молекулах аминокислот различных по строению радикалов (алифатический, ароматический и гетероциклический). Кремнеземы, модифицированные аминокислотами, получали аналогично описанным выше, за исключением того, что в смесь для гидролиза вместо воды вносили водные растворы аминокислот. Концентрацию аминокислот подбирали таким образом, чтобы их содержание в готовом силикагеле составило приближенно 0,3 ммоль/г. Термический анализ с целью выявления устойчивости к нагреванию, а также некоторых структурных особенностей сорбентов проводили с использованием комплексного термического анализатора Q – 1500 (Венгрия). Скорость нагрева до температуры 1000 ºС – 10 ºC/мин. В качестве образца сравнения при регистрации кривых ДТА использовали оксид алюминия, прокаленный при температуре 1000 ºС до постоянной массы. Кривые комплексного термического анализа каждого образца фиксировались три раза с последующим усреднением данных.
Содержание общего углерода в полученных образцах определялось путем сжигания навески в токе кислорода при температуре 1000 ºС с последующим волюмометрическим определением объема углекислого газа.
Для определения констант ионизации аминокислот в растворе и в матрице силикагелей применяли потенциометрическое титрование 0,05 М растворами соляной кислоты (х. ч.) и гидроксида калия (х. ч.) при различных значениях ионной силы I. Гидроксид калия очищали от примесей карбонатов по методике, изложенной в [1]. Стандартизацию раствора соляной кислоты осуществляли по тетраборату натрия, гидроксида калия – по соляной кислоте. Регистрацию рН осуществляли с точностью до третьего знака после запятой с применением иономера «Эксперт 001» российского производства. Индикаторный электрод – стеклянный (ЭСЛ-430-07СР), электрод сравнения – хлорсеребряный (ЭВЛ 1М).
Полученные экспериментальные кривые титрования обрабатывали с применением программы CLINP 2.1 (авторы: Холин Ю.В., Мерный С.А., Коняев Д.С.). Программа открыта для свободного использования и доступна по адресу http://klsp.kharkov.ua/kholin/clinp.html. Алгоритм работы программы основан на расчете теоретических значений измеряемого параметра в каждой точке экспериментальной кривой из заданной оператором величины константы равновесия по методу Ньютона или Гаусса - Ньютона. Сходимость экспериментальных и теоретических величин измеряемого параметра достигается путем последовательных итераций с изменением исходных констант равновесия на заданную величину. Результатом расчета является такое значение константы равновесия, при котором сходимость экспериментальных и теоретических точек кривой удовлетворяет определенным статистическим критериям [8]. Кривые зависимости констант ионизации от ионной силы обрабатывали с применением модели Питцера.
Результаты эксперимента и их обсуждение
На рис. 2 показаны результаты комплексного термического анализа исследуемых силикагелей. Кривые ТГ, ДТГ и ДТА силикагеля, полученного в отсутствии аминокислот, имеют характерную структуру. Удаление физически связанной воды заканчивается при температуре около 200 ºС, после чего следует разрушение поверхностных силанольных групп. Аппроксимация линии ДТА средствами пакета Origin Pro 2.1 показала, что она наиболее удачно описывается двумя кривыми Гаусса с максимумами при 120 и 190 ºС. Первый пик соответствует удалению с поверхности физически сорбированной воды. Второй имеет большую по сравнению с первым ширину основания и меньшую высоту и соответствует разложению силанольных групп.
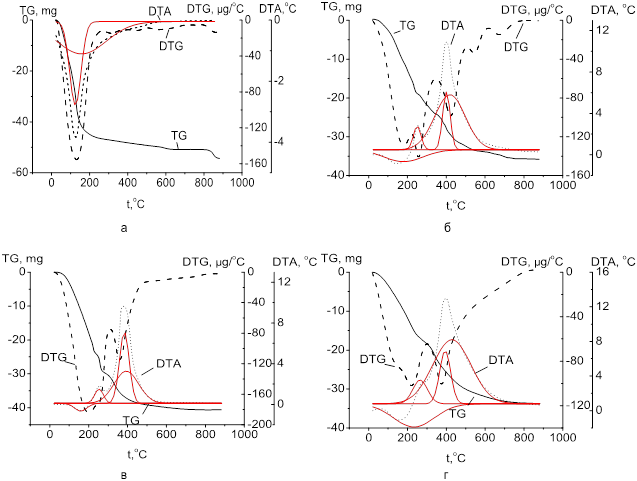
Рис. 2. Термограммы немодифицированного силикагеля (а), силикагеля с иммобилизованными лейцином (б), пролином (в), тирозином (г). Кривые Гаусса, аппроксимирующие линии ДТА, обозначены красной линией.
Анализ термограмм модифицированных силикагелей позволяет сделать вывод об устойчивости введенных в кремнекислородный каркас аминокислот до температуры около 180 ºС. Наиболее точно линии ДТА и ДТГ аппроксимируются четырьмя кривыми Гаусса. На рис. 2 показаны такие кривые для линий ДТА. Максимумы кривых соответствуют следующим температурам: 150, 255, 400 и 430 ºС – для силикагеля, модифицированного лейцином; 160, 250, 380, 395 ºС – пролином; 170, 260, 390 и 425 ºС – тирозином. Первый эндотермический эффект на каждой термограмме относится к удалению физически связанной воды. Остальные пики, указывающие на протекание экзотермических процессов, возможно, следует отнести к реакциям конденсации, дезаминирования аминокислот и окислению полученных продуктов [10]. Эндотермических процессов сублимации не наблюдается, что дает основание предполагать удерживание аминокислот в матрице силикагелей. «Вычитание» кривых ТГ модифицированных и не модифицированных силикагелей позволило определить примерное содержание аминокислот в образцах, которое составило: лейцин – 0,29 ммоль/г, пролин – 0,31 ммоль/г, тирозин – 0,30 ммоль/г. Эти величины согласуются с данными, полученными методом определения общего углерода. Вид термограмм, а также величины концентрации аминокислот указывают на достаточную прочность удерживания их молекул.
Типичный вид кривой титрования аминокислоты лейцина в водном растворе представлен на рис. 3. На графике выделяются две буферные зоны, которые соответствуют равновесным процессам взаимодействия карбоксильных и аминогрупп лейцина с соляной кислотой (ионы водорода) и гидроксидом калия (гидроксид-ионы). Описанные процессы схематически представлены на рис. 3. Кривая титрования содержит 2 скачка.
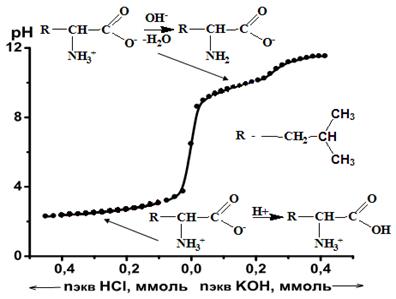
Рис. 3. Типичная кривая титрования аминокислоты на примере лейцина
Величины кажущихся констант ионизации групп аминокислот, рассчитанные обработкой кривых титрования программой CLINP 2.1, при разной ионной силе раствора приведены на рис. 4. На каждой из кривых выделяется участок, близкий к прямой, при низких значениях ионной силы. После чего при увеличении ионной силы величина константы резко меняется. Это связано с увеличением силы взаимодействий растворенное вещество - растворитель и растворенное вещество - растворенное вещество в системе. Такие типы зависимостей от концентрации солевого фона принято описывать с применением модели Питцера. Основной постулат модели заключается в том, что на коэффициент активности растворенного вещества влияет не только концентрация ионов в системе, но и различные взаимодействия дальнего и ближнего порядка. Уравнение связи концентрационной константы с термодинамической, по теории Питцера, выглядит следующим образом [13]:
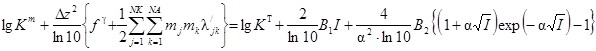 . (10)
. (10)
В данном уравнении ![]() - логарифм концентрационной константы,
- логарифм концентрационной константы, ![]() - логарифм термодинамической константы равновесия.
- логарифм термодинамической константы равновесия.
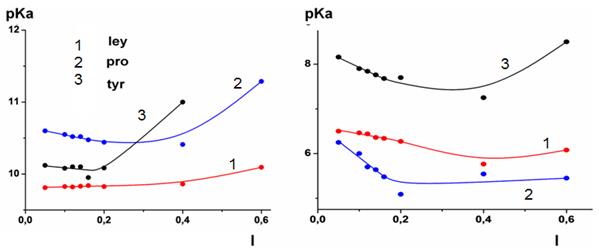
Рис. 4. Зависимости кажущихся констант ионизации аминокислот от ионной силы (точки – эксперимент, линии – аппроксимация по модели Питцера)
Путем аппроксимации зависимостей, изображенных на рис. 4, уравнением Питцера и дальнейшей экстраполяцией полученных кривых на ось ординат получили значения констант равновесия при нулевой ионной силе или термодинамических констант равновесия.
Показатели данных констант ионизации представлены в таблице 1. Достаточное сходство полученных нами величин для растворов аминокислот с литературными данными позволяет говорить об адекватности примененной методики.
Величины pKa1, соответствующие ионизации карбоксильных групп, мало изменяются при введении аминокислот в матрицу силикагелей. Это легко объясняется отсутствием взаимодействия между карбоксильными и слабокислыми силанольными группами силикагелей.
Таблица 1
Константы ионизации при ионной силе, равной 0
|
|
Аминокислота |
pKa1 |
pKa2 |
pKa3 |
|
Литературные данные |
Лейцин [2] |
2,33 |
9,74 |
|
|
Пролин [12] |
1,95 |
10,64 |
|
|
|
Тирозин [12] |
2,24 |
9,04 |
10,1 |
|
|
Раствор аминокислоты |
Лейцин |
2,30±0,02 |
9,82±0,03 |
|
|
Пролин |
2,01±0,02 |
10,65±0,05 |
|
|
|
Тирозин |
1,99±0,03 |
9,61±0,07 |
10,15±0,03 |
|
|
Иммобилизованная аминокислота |
Лейцин |
2,21±0,06 |
6,61±0,08 |
|
|
Пролин |
2,29±0,04 |
6,84±0,07 |
|
|
|
Тирозин |
2,36±0,05 |
6,73±0,08 |
8,35±0,10 |
|
|
Силикагель |
6,75±0,07 |
|
|
|
Показатели pKa2 соответствуют депротонированию групп –NH3+, а их изменение для аминокислот указывает на изменение силы группировок –NH2 как оснований при иммобилизации аминокислот в силикагеле. Величины pKa2 иммобилизованных аминокислот приближенно на 3 порядка меньше, чем для их водных растворов. Это связано с известным эффектом водородного взаимодействия аминогрупп с силанольными группами силикагелей. В результате такого взаимодействия продуктом депротонирования ионов –NH3+ являются не свободные аминогруппы, а их ассоциаты с силанольным покровом кремнеземов. Водородным взаимодействием силанольных групп и свободных электронных пар кислорода фенольной группы также объясняется уменьшение константы ионизации тирозина pKa3 [4].
Заключение
Полученные в работе результаты позволяют сделать вывод о достаточно прочной фиксации аминокислот в матрице силикагелей при их модификации в процессе синтеза. Силанольное покрытие силикагелей и, возможно, характер их пористости оказывают влияние на активность функциональных групп иммобилизованных аминокислот в кислотно-основных взаимодействиях. Межмолекулярные взаимодействия аминогрупп с силанольными могут оказать влияние как на прочность соединений иммобилизованных аминокислот с металлами, так и на механизм сорбционного взаимодействия, что требует дальнейшего исследования.
Рецензенты:
Бухтояров О.И., д.х.н., профессор, советник при ректорате Федерального государственного бюджетного образовательного учреждения «Курганский государственный университет», г.Курган.
Шуняев К.Ю., д.х.н., заведующий лабораторией аналитической химии Института металлургии Уральского отделения РАН, г. Екатеринбург.
Библиографическая ссылка
Шаров А.В., Филистеев О.В., Воронцов Б.С. ТЕРМИЧЕСКАЯ СТАБИЛЬНОСТЬ И ПРОТОЛИТИЧЕСКИЕ СВОЙСТВА СИЛИКАГЕЛЕЙ, МОДИФИЦИРОВАННЫХ НЕКОТОРЫМИ АМИНОКИСЛОТАМИ // Современные проблемы науки и образования. 2013. № 6. ;URL: https://science-education.ru/ru/article/view?id=10975 (дата обращения: 03.03.2026).



