Введение
Генетически кодируемые флуоресцентные зонды на основе GFP-подобных белков в последнее десятилетие стали одним из основных инструментов, используемых при исследовании живых систем. Свою популярность они приобрели, прежде всего, за счёт того, что флуоресцентные свойства белок приобретает в ходе посттрансляционных модификаций, происходящих автокаталитически внутри молекулы белка [4]. То есть спектральные свойства задаются исключительно аминокислотной последовательностью, и для формирования флюорофора не нужно присутствие простетических групп. Ген GFP (Green Fluorescent Protein, зеленый флуоресцентный белок) был клонирован в 1992 г. При помощи мутагенеза на основе GFP удалось получить ряд белков с суммарной эмиссией от голубого до желтого цвета (440–539 нм) [7]. Открытие GFP-подобных белков из коралловых полипов класса Anthozoa в 1999 г. позволило существенно расширить палитру флуоресцентных белков (ФБ). Данные белки имеют степень гомологии с GFP около 26-30%, а один из клонированных белков – DsRed имел яркую флуоресценцию в красной области спектра (583 нм). Сейчас число открытых природных GFP‑подобных белков расширилось до нескольких десятков [1]. В настоящее время они применяются в биотехнологии для решения широкого спектра задач – от слежения за генной экспрессией до исследований взаимодействий белков с использованием метода флуоресцентного резонансного переноса энергии (fluorescent resonance energy transfer, FRET) [8]. Особое значение имеют белки, способные флуоресцировать в дальнекрасной и инфракрасной области спектра (650–900 нм). Данное свойство позволяет преодолеть клеточную автофлуоресценцию, а также нивелировать рассеяние и поглощение света живыми тканями, что, в свою очередь, позволяет визуализировать молекулярные процессы в масштабе целого организма.
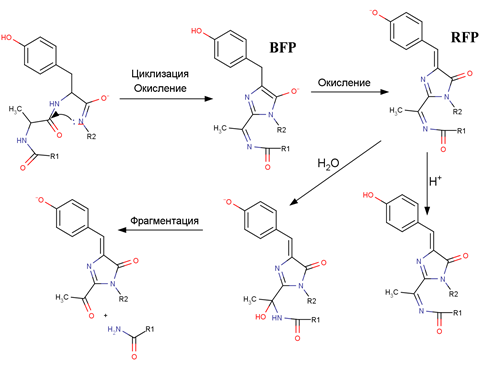
Рис. 1. Схема образования хромофора красных GFP-подобных белков (RFP, Red Fluorescent Protein) и его дальнейших модификаций (протонирования, гидролиза и фрагментации) согласно [6] и [3].
Структура хромобелка cgCP
Среди GFP-подобных белков выделяют отдельную группу хромобелков — это белки, которые не имеют собственной флуоресценции, однако характеризуются интенсивным поглощением в области спектра, характерной для дальне-красных белков (максимум эмиссии больше 600 нм). Ранее было показано, что хромобелки при помощи мутагенеза с небольшим числом аминокислотных замен можно превратить во флуоресцентные белки [2]. Одним из важных параметров, характеризующих GFP-подобные белки, является скорость синтеза хромофора (часто говорят о скорости созревания белка в целом, так как синтез хромофора является заключительной посттрансляционной модификацией, в результате которой белок приобретает окраску). Хромобелок из кораллового полипа Condylactis gigantea (cgCP) является одним из самых быстросозревающих белков, поглощающих в диапазоне выше 570 нм, при этом он не образует побочных продуктов (недозрелых форм, содержащих GFP-хромофор, либо протонированный хромофор, рис. 1).
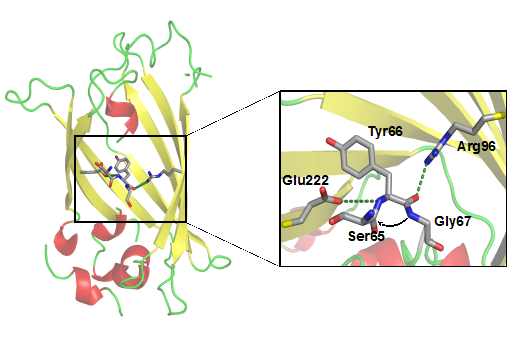
Рис. 2. Расположение формирующегося хромофора внутри β-бочки GFP, а также каталитические аминокислотные остатки Arg96 и Glu222.
Для наглядности часть β-бочки не показана.
Очевидно, что в образовании хромофора участвуют аминокислотные остатки из его ближайшего окружения. Некоторые из них выполняют каталитическую роль [4] (рис. 2). Чтобы выяснить, какие аминокислотные остатки в окружении хромофора cgCP отвечают за ускоренное созревание хромофора, нами была рассчитана пространственная структура белка. Для расчета структуры использовался программный комплекс, моделирующий пространственную структуру методом гомологичного моделирования и использующий программу MODELLER [5]. В качестве шаблона был использован близкий гомолог cgCP – хромобелок из Heteractis crispa (hcCP), кристаллическая структура которого известна. Хромофор был включен в последовательность белка в виде гетерогруппы. Программа переносила хромофор в созданную модель без модификаций как жёсткое тело. На заключительной стадии моделирования структура оптимизировалась при помощи методов сопряжённого градиента и имитации отжига с молекулярной динамикой.
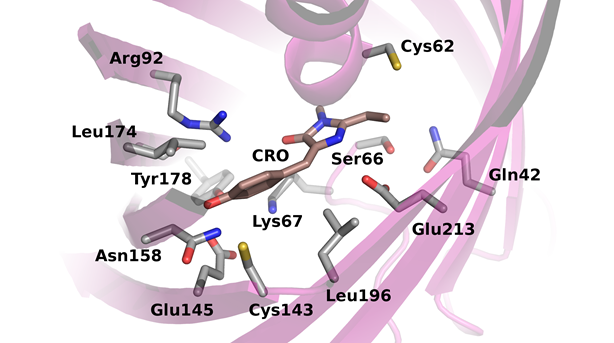
Рис. 3. Ближайшее аминокислотное окружение хромофора в cgCP.
Хромофор выделен розовым цветом.
Согласно полученной модели белок, как и другие его гомологи, имеет упаковку β-бочки с хромофором, расположенным в середине. Ключевые аминокислотные остатки расположены в тех же позициях, что и в других GFP-подобных белках. Ближайшее аминокислотное окружение хромофора очень похоже у большинства красных флуоресцентных и хромобелков, cgCP в этом плане не сильно отличается от других гомологов. В частности, в ближайшем окружении хромофора находятся характерные остатки Arg92, Glu213, Ser66, Lys67, Tyr178, Glu145 (рис. 3). Однако некоторые отличия, которые могут влиять на протекание реакций синтеза хромофора, всё же имеются. Так в 62-й позиции находится остаток Cys, который в красных белках часто заменен на Phe. Наличие Cys62 в cgCP может придавать дополнительную стерическую свободу в ходе реакции циклизации (рис. 1), а также при последующих реакциях. На подвижность хромофора значительное влияние оказывают аминокислотные остатки вблизи фенольной группы. Так, известно, что остатки 143, 158 и 196 определяют цис-транс конформационное состояние хромофора. CgCP содержит в данных позициях Cys, Asn и Leu соответственно (рис. 3). Особое внимание обращают на себя остатки Cys143, Leu196 и Leu174. Эти остатки в других «красных» белках часто замещены на более объемные Asn, His и Phe соответственно. Таким образом, со стороны фенольного кольца хромофора в cgCP также возможна большая подвижность формирующегося хромофора. Высокая скорость созревания cgCP, в этом ключе, может быть связана с большей конформационной подвижностью формирующегося хромофора.
Другим интересным отличием cgCP от гомологов является наличие аланинового аминокислотного остатка в первой хромофоробразующей позиции (Ala63), что также может приводить к увеличению его подвижности. Для проверки влияния Ala63 на созревание белка были получены мутантные варианты cgCP с заменой Ala63 на другие аминокислотные остатки. Введение мутации в белок проводили методом сайт-направленного мутагенеза с амплификацией целой плазмиды ДНК-полимеразой Pfu на праймерах, содержащих необходимые мутации. В качестве матричной ДНК использовалась плазмида pQE-30, несущая ген белка cgCP. Для того чтобы избавиться от матричной плазмиды, по окончании реакции продукт обрабатывали эндонуклеазой рестрикции Dpn I, проявляющей специфичность к метилированной ДНК. Синтезированная в ходе реакции плазмидная ДНК, содержащая мутантный ген, не метилирована и поэтому не подвергалась расщеплению Dpn I, в отличие от матричной плазмиды, выделенной из E. coli. Затем полученной мутагенезной смесью трансформировали суперкомпетентные клетки XL-I Blue. В ходе последующего скрининга было обнаружено, что колонии, содержащие плазмиду с исходным или мутантным вариантом гена, различались по окраске, что существенно упрощало селекцию. Так, клоны, экспрессирующие мутантный белок, были окрашены менее интенсивно, по-видимому, за счёт более медленного созревания хромофора. Из отобранных клонов нарабатывали плазмидную ДНК, которую затем проверяли секвенированием на наличие вводимой мутации и сохранность остальной части гена. Биосинтез белка проводили в штамме E. coli JM-109, пригодном как для генно-инженерных задач, так и для экспрессии генов. Выделение и очистку cgCP и его мутантных вариантов проводили с использованием металл-хелатной хроматографии на Ni-NTA агарозе.
В первую очередь нами была введена замена Ala63Gln, так как именно глутаминовый аминокислотный остаток наиболее часто встречается в хромобелках и красных флуоресцентных белках [1]. Данная мутация за счет увеличения размера боковой цепи 63-го остатка должна приводить к уменьшению подвижности формирующегося хромофора. В полученном мутантном белке происходило формирование «красного» хромофора с максимумом поглощения при 576 нм, однако присутствовала значительная часть белка с незрелым хромофором (вероятно, GFP-типа, максимум поглощения 520 нм). Чтобы более детально проанализировать роль 63-го остатка на выход зрелого белка, были получены и другие мутантные варианты cgCP. В частности, получены белки с заменой Ala63Asn, Ala63His и Ala63Gly. Аминокислотный остаток Asn отличается от Gln уменьшением боковой цепи на одну метиленовую группу; His, наоборот, является более объемным; а в Gly боковая цепь вообще отсутствует. Анализ спектральных свойств полученных вариантов показал, что все замены оказывают отрицательное воздействие на выход «красного» хромофора. Причем в белке cgCP с заменой Ala63His образовывалось не более 10% полностью созревшей формы. Таким образом, увеличение объема бокового заместителя действительно может уменьшать выход зрелой формы белка. Однако обращает на себя внимание уменьшение выхода «красного» хромофора и в случае мутанта cgCP Ala63Gly. Уменьшение объема бокового заместителя первого хромофоробразующего остатка также привело к падению выхода конечной формы. В результате можно заключить, что на формирование хромофора значительное влияние, вероятно, оказывает точное расположение хромофоробразующей последовательности в каталитическом центре. То есть, помимо необходимой конформационной подвижности, важно также присутствие некоторых стерических ограничений, задающих точное расположение субстратных аминокислотных остатков в каталитическом центре.
В заключение с применением метода гомологичного моделирования в работе была получена пространственная структура хромобелка cgCP. С опорой на данные моделирования было проанализировано аминокислотное окружение хромофора cgCP. Сравнение с другими гомологами показало, что хромофор cgCP может быть конформационно более свободен, что, в свою очередь, может объяснить его высокую скорость созревания.
Работа выполнена при финансовой поддержке Министерства образования и науки Российской Федерации, соглашение № 8234.
Рецензенты:
Шуваева Т.М., д.х.н., в.н.с., Федеральное государственное бюджетное учреждение науки «Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова Российской академии наук», г. Москва.
Шахпаронов М.И., д.х.н., руководитель группы, Федеральное государственное бюджетное учреждение науки «Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова Российской академии наук», г. Москва.
Библиографическая ссылка
Гарковенко А.В., Пахомов А.А. МОДЕЛИРОВАНИЕ ПРОСТРАНСТВЕННОЙ СТРУКТУРЫ ХРОМОБЕЛКА ИЗ CONDYLACTIS GIGANTEA // Современные проблемы науки и образования. 2013. № 5. ;URL: https://science-education.ru/ru/article/view?id=10709 (дата обращения: 22.02.2026).



