Выполнена валидация ВЭЖХ-методики качественного и количественного анализа метронидазола, лидокаина гидрохлорида, преднизолона в составе экспериментального препарата «Премелтоп». Исследования проведены на жидкостном хроматографе LC-20 фирмы «SHIMADZU» (Япония) с УФ-детектором, с последующей компьютерной обработкой результатов исследования с использованием программы «LCsolution version 1.4». Неподвижная фаза – хроматографическая колонка 4,6×150 мм PerfectChrom C-18, размер частиц 5 нм («MZ-Analysentechnik», Германия). Подвижная фаза – А: трифторуксусной кислоты раствор 0,1%, Б: ацетонитрил 100%. Градиентное элюирование – изменение концентрации элюента Б от 10% до 80%, продолжительность анализа – 12 мин. Разработанная методика может быть использована для оценки качества экспериментального препарата «Премелтоп», порошка для приготовления суспензии для приема внутрь, так как экспериментальным путем установлены параметры линейности (R2 = 0,9991; 0,9996; 0,9992), диапазона применения (от 50 до 150%), прецизионности в условиях повторяемости (RSD=1,61%; 1,67%; 1,75%), правильности (![]() =101,41±1,10%; 100,90±1,00%; 100,12±0,95%) для метронидазола, лидокаина гидрохлорида, преднизолона соответственно, которые не превышают рекомендуемых значений.
=101,41±1,10%; 100,90±1,00%; 100,12±0,95%) для метронидазола, лидокаина гидрохлорида, преднизолона соответственно, которые не превышают рекомендуемых значений.
Введение
Местная терапия ожога пищевода способствует быстрому заживлению ожоговой поверхности и профилактике развития рубцовых деформаций и является составной частью комплексного лечения. Сотрудниками кафедр фармацевтической технологии и детской хирургии АГМУ предложены составы для местной терапии химических ожогов пищевода с учетом этапности развития патологического процесса. Для увеличения срока годности запатентованные составы получены в форме «сухих суспензий» - однородных смесей лекарственных веществ со стабилизаторами, к которым добавляют необходимое количество растворителя непосредственно перед применением. Экспериментальный препарат в форме порошка для приготовления суспензии для приема внутрь в фазу воспаления получил название «Премелтоп» [1,3].
При подготовке нормативной документации (ФСП, регламенты) необходимо разработать методики анализа лекарственных веществ, входящих в состав препарата и провести их валидационную оценку. Согласно современным рекомендациям ICH и ведущих фармакопей методика количественного определения должна быть валидирована по основным характеристикам, таким как специфичность (specificity), линейность (linearity), правильность, или истинность (accuracy, or trueness), прецизионность (precision) [5,6,7,8].
Цель данной работы – изучение комплекса валидационных характеристик ВЭЖХ- методики качественного и количественного анализа экспериментального препарата «Премелтоп».
Материалы и методы исследования
Объект исследования – порошок для приготовления суспензий для приема внутрь: «Премелтоп» по 5,65 г (в 100,0 готовой к применению суспензии: метронидазола (ФС 42-0257-07) 0,75; преднизолона (ФС 42-2780-91) 0,05; лидокаина гидрохлорида (ФС 42-0251-07) 0,1; регенкура (ФС 42-3395-97) 4,0; ароматизатора, идентичного натуральному 0,5, натрия сахарината (ФС 42-1826-82) Е 954 0,24) для применения в фазу воспаления.
Исследования проводили на жидкостном хроматографе LC-20 фирмы «SHIMADZU» (Япония) с УФ-детектором, с последующей компьютерной обработкой результатов исследования с использованием программы «LCsolution version 1.4». Неподвижная фаза – хроматографическая колонка 4,6×150 мм PerfectChrom C-18, размер частиц 5 нм («MZ-Analysentechnik», Германия). Подвижная фаза – А: трифторуксусной кислоты (ТФУК) раствор 0,1%, Б: ацетонитрил 100%. Температура колонки – 35 °С, скорость подачи элюента – 100 мкл/мин, объем пробы – 20 мкл, градиентное элюирование – изменение концентрации элюента Б от 10% до 80%, продолжительность анализа – 12 мин.
Методика. Около 0,15 (точная навеска) порошка помещали в мерную колбу вместимостью 25 мл и обрабатывали смесью ацетонитрил - вода очищенная в соотношении (1:9), перемешивали в течение 5 минут, доводили объем раствора до метки тем же растворителем. Центрифугировали в течение 10 минут и фильтровали через бумажный фильтр. Полученный фильтрат вводили в колонку хроматографа как анализируемую пробу. Для приготовления элюентов использовали ацетонитрил для хроматографии «Сорт 1» («Криохром», Россия), ТФУК марки «ч.д.а» («ВЕКТРОН») и воду очищенную, полученную на установке для получения воды аналитического качества «УПВА-5».
Результаты исследования и их обсуждение
Важное значение при разработке методики хроматографического исследования имеет выбор элюентов и условий хроматографирования. При выборе элюентов учитывали характер анализируемых соединений и их способность растворятся в амфифильных растворителях. В качестве одного из элюентов подвижной фазы был выбран ацетонитрил, который широко применяется в анализе фармацевтических препаратов, а также обладает высокой элюирующей силой, низкой вязкостью, доступностью, отсутствием токсического действия. Вторым элюентом была выбрана трифторуксусная кислота (ТФУК), которая является наиболее распространенным элюентом в ВЭЖХ-анализе, т.к. легко удаляется из элюентов упариванием, УФ-прозрачна в области коротких длин волн. При выборе подвижных фаз и времени элюирования также учитывали тот факт, что исследуемая смесь содержит вещества, сильно различающиеся по сорбционным свойствам и, следовательно, для их разделения требуются подвижные фазы с различной элюирующей силой. В связи с чем, было выбрано градиентное элюирование [4].
Специфичность методики (specificity). Анализ хроматограммы фильтрата препарата «Премелтоп» (рис.1) показал, что пики определяемых веществ хорошо разделены между собой и не накладываются на пики примесей из растворителя, на пики вспомогательных веществ и основы лекарственной формы (плацебо).
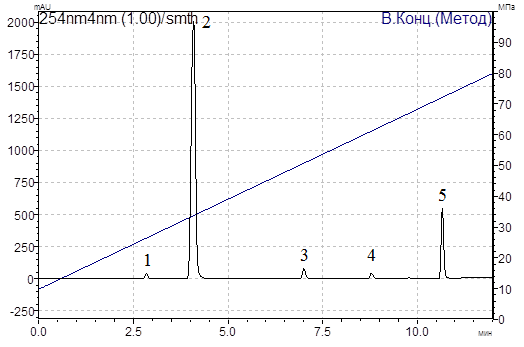
Рис. 1. Хроматограмма фильтрата состава «Премелтоп»,
(1, 3 – вспомогательные вещества (2,83 и 7,00 мин), 2 – метронидазол (4,09 мин), 4 – лидокаина гидрохлорид (8,78 мин), 5 – преднизолон (10,66 мин))
Таблица 1
Времена удерживания и спектральные отношения компонентов препарата «Премелтоп»
|
Компоненты |
Проба |
Стандарт |
Стандартное отклонение, % |
||
|
Время удерживания, мин |
А254 / А220 |
Время удерживания, мин |
А254 / А220 |
||
|
Метронидазол |
4,09 |
0,496 |
4,11 |
0,496 |
0,014 |
|
Лидокаина г/хл |
8,78 |
0,060 |
8,78 |
0,060 |
0 |
|
Преднизолон |
10,66 |
1,971 |
10,65 |
1,971 |
0,007 |
Согласно данным табл. 1 спектральные отношения анализируемых веществ идентичны соответствующим спектральным отношениям веществ стандарта. Временя удерживания анализируемых веществ, не существенно отличается от времени удерживания соответствующих веществ стандарта и не превышает 0,5% – нормы, указанной в технической документации прибора.
Пригодность хроматографической системы характеризовалась несколькими параметрами: сходимость инжекций (n=6), эффективность колонки (N ≥ 1000) 1499 т.т. для метронидазола, 6801 т.т. для лидокаина гидрохлорида и 2692 т.т. для преднизолона; коэффициенты ассиметрии пиков (Т ≤ 2,0) для метронидазола - 1,86, для лидокаина гидрохлорида – 1,54, для преднизолона – 1,27; коэффициент разделения пиков ( Rs > 2,0) для метронидазола не менее 6, для лидокаина гидрохлорида не менее 10, для преднизолона не менее 9,47. величина относительного стандартного отклонения площади пика (RSD ≤ 2,0 %) для метронидазола 1,76%, для лидокаина гидрохлорида 1,97%, для преднизолона 1,81%. Полученные результаты позволяют оценить пригодность хроматографической системы по основным показателям и сделать заключение о том, что данная хроматографическая система может быть использована для анализа экспериментального препарата «Премелтоп».
y = 429130x + 6938200
R2 = 0,9991
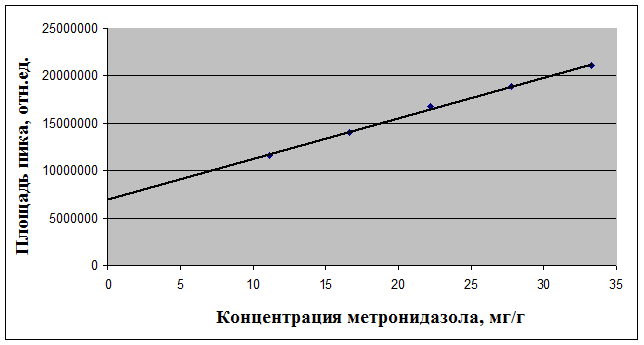
Рис. 2. Линейность методики определения метронидазола
Линейность методики оценивали на 5 уровнях концентрации от теоретического содержания лекарственных веществ, т. е. готовили растворы стандартных веществ в концентрациях 50, 75, 100, 125 и 150% от номинального значения. Затем измеряли аналитический сигнал (площадь пика) для проб с различными концентрациями определяемого вещества. Критерием линейности является коэффициент корреляции, величина которого должна быть не ниже 0,999. Полученные результаты представлены на рис. 2,3,4.
y = 71294,56x + 7077,38
R2 = 0,9996
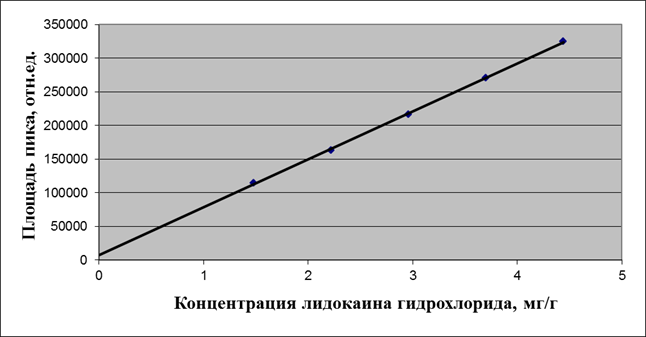
Рис. 3. Линейность методики определения лидокаина гидрохлорида
y = 1683190x + 60850,08
R2 = 0,9992
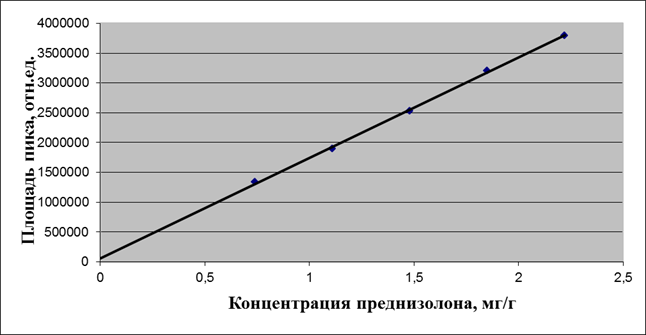
Рис. 4. Линейность методики определения преднизолона
Таким образом, зависимость величины аналитического сигнала (отклика) от количества определяемого вещества в пробе в диапазоне концентраций от 50 до 150% от номинального значения носит линейный характер, коэффициент корреляции для всех определяемых веществ соответствует рекомендуемым значениям.
Прецизионность в условиях повторяемости. Обычно при разработке оригинальной методики определяются повторяемость (сходимость) результатов, получаемых при ее использовании. Повторяемость методики определяли на одном анализируемом образце в 6 повторностях. Критерий приемлемости выражался величиной относительного стандартного отклонения, которое не должно превышать 2,0%.
Таблица 2
Определение повторяемости разработанной методики
|
Повторность |
Концентрация вещества в 1,0 г порошка для суспензий, мг |
||
|
Метронидазол |
Лидокаина гидрохлорид |
Преднизолон |
|
|
1 |
129,65 |
16,63 |
8,53 |
|
2 |
127,31 |
17,10 |
8,48 |
|
3 |
130,17 |
16,72 |
8,54 |
|
4 |
131,63 |
17,34 |
8,81 |
|
5 |
133,38 |
17,26 |
8,81 |
|
6 |
129,09 |
17,12 |
8,73 |
|
Среднее значение |
130,21 |
17,03 |
8,65 |
|
RSD ≤ 2,0% |
1,61 |
1,67 |
1,75 |
Из данных, представленных в табл. 2, видно, что относительное стандартное отклонение не превышает 2,0 %, это свидетельствует о прецинзионности методики в условиях повторяемости.
Правильность методики устанавливали по результатам анализа лекарственных форм с содержанием действующих веществ 50, 80, 100 и 120% от номинального. Критерием приемлемости является средний процент восстановления при использовании растворов заданных концентраций, скорректированных на 100%, и его средняя величина должна находиться в пределах 100±5% (Табл. 3).
Таблица 3
Определение правильности методики
|
Метронидазол |
Лидокаина гидрохлорид |
Преднизолон |
||||||
|
содержание, мг в 1г порошка |
Ошибка, % |
содержание, мг в 1г порошка |
Ошибка, % |
содержание, мг в 1г порошка |
Ошибка, % |
|||
|
Ожидаемое |
Полученное |
Ожидаемое |
Полученное |
Ожидаемое |
Полученное |
|||
|
66,54 |
65,73 |
98,79 |
8,88 |
8,84 |
99,56 |
4,44 |
4,36 |
98,29 |
|
66,54 |
66,55 |
100,02 |
8,88 |
8,85 |
99,64 |
4,44 |
4,36 |
98,12 |
|
66,54 |
66,52 |
99,97 |
8,88 |
8,91 |
100,38 |
4,44 |
4,45 |
100,27 |
|
106,56 |
110,22 |
103,43 |
14,22 |
14,11 |
99,20 |
7,08 |
7,10 |
100,23 |
|
106,56 |
107,81 |
101,17 |
14,22 |
14,28 |
100,44 |
7,08 |
6,98 |
98,63 |
|
106,56 |
107,37 |
100,76 |
14,22 |
14,79 |
103,99 |
7,08 |
6,95 |
98,20 |
|
133,20 |
134,20 |
100,75 |
17,76 |
17,73 |
99,815 |
8,88 |
8,96 |
100,96 |
|
133,20 |
138,48 |
103,97 |
17,76 |
17,81 |
100,27 |
8,88 |
9,13 |
102,77 |
|
133,20 |
135,90 |
102,03 |
17,76 |
17,91 |
100,85 |
8,88 |
8,93 |
100,53 |
|
159,84 |
165,75 |
103,70 |
21,30 |
21,93 |
102,95 |
10,68 |
10,80 |
101,10 |
|
159,84 |
159,32 |
99,67 |
21,30 |
21,97 |
103,14 |
10,68 |
10,80 |
101,14 |
|
159,84 |
164,13 |
102,68 |
21,30 |
21,41 |
100,51 |
10,68 |
10,81 |
101,18 |
|
Среднее значение выхода – |
||||||||
|
101,41% |
100,90% |
100,12 % |
||||||
Среднее значения выхода для метронидазола составляет 101,41±1,10%, для лидокаина гидрохлорида 100,90±1,00%, для преднизолона 100,12±0,95% и не превышает рекомендуемых значений.
Аналитическая область методики установлена по диапазону экспериментальных данных, удовлетворяющих линейной модели, и составила от 50 до 150%. Следует отметить, что диапазон применения для методик количественного определения должен составлять не менее чем от 80 до 120% от номинального значения определяемой аналитической характеристики.
В результате проведенных исследований установлено, что ВЭЖХ-методика определения метронидазола, преднизолона, лидокаина гидрохлорида в составе экспериментального препарата «Премелтоп» позволяет объективно оценить качество многокомпонентной лекарственной формы. Полученные результаты включены в ФСП и Лабораторный регламент на производство «Премелтоп», порошок для приготовления суспензии для приема внутрь.
Заключение
Разработанная методика качественного и количественного анализа метронидазола, лидокаина гидрохлорида, преднизолона методом ВЭЖХ может быть использована для оценки качества экспериментального препарата «Премелтоп», порошка для приготовления суспензии для приема внутрь, так как экспериментальным путем установлены параметры линейности (R2 = 0,9991; 0,9996; 0,9992), диапазона применения (от 50 до 150%), прецизионности в условиях повторяемости (RSD = 1,61%; 1,67%; 1,75%), правильности (![]() =101,41±1,10%; 100,90±1,00%; 100,12±0,95%) для метронидазола, лидокаина гидрохлорида, преднизолона соответственно, которые не превышают рекомендуемых значений.
=101,41±1,10%; 100,90±1,00%; 100,12±0,95%) для метронидазола, лидокаина гидрохлорида, преднизолона соответственно, которые не превышают рекомендуемых значений.
Рецензенты:
Карабинцева Н.О., д.фарм.н., профессор, зав. кафедрой фармацевтической технологии и биотехнологии ГБОУ ВПО «Новосибирский государственный медицинский университет» Минздрава России, г.Новосибирск.
Федосеева Л.М., д.фарм.н., профессор, зав. кафедрой фармацевтической химии с курсом органической и токсикологической химии ГБОУ ВПО «Алтайский государственный медицинский университет» Минздрава России, г.Барнаул.
Библиографическая ссылка
Воробьева В.М., Макарова О.Г. ВАЛИДАЦИОННЫЕ ИССЛЕДОВАНИЯ ВЭЖХ-МЕТОДИКИ АНАЛИЗА ЭКСПЕРИМЕНТАЛЬНОГО ПРЕПАРАТА «ПРЕМЕЛТОП» // Современные проблемы науки и образования. 2013. № 5. ;URL: https://science-education.ru/ru/article/view?id=10107 (дата обращения: 16.02.2026).



