Введение
В результате поиска биологически активных соединений в ряду производных 5-арил-4-ацил-3-гидрокси-1-гидроксиалкил-3-пирролин-2-она выявлено соединение КОН-1, превосходящее по антиамнестическому действию пирацетам [1]. В связи с рекомендацией к проведению доклинических испытаний нами проводятся исследования по разработке методов контроля качества и стандартизации субстанции и лекарственных форм этого соединения [3-5].
В основе синтеза КОН-1 лежит трёхкомпонентная реакция [1]. Возможными специфическими примесями (исходные вещества в синтезе) в субстанции этого соединения являются метиловый эфир ацетилпировиноградной кислоты (МЭАПВК), 4-бромбензальдегид (ББА) и 3-аминопропанол [5].
Целью настоящего исследования явилась разработка и валидация методики определения посторонних примесей МЭАПВК и ББА в субстанции КОН-1 методом обращённо-фазной ВЭЖХ.
Материалы и методы исследования
В исследованиях использовался высокоэффективный жидкостный хроматограф Shimadzu LC Prominence (Япония), оснащённый колонкой из нержавеющей стали (25 см ×4,6 мм, сорбент Discovery® С18 с размером частиц 5 мкм) и диодноматричным детектором.
Для приготовления подвижных фаз использовали воду бидистиллированную, фосфатный буфер (рН 7), ацетонитрил для хроматографии, метанол [2].
В работе использовали пять серий субстанции КОН-1, синтезированные на кафедре фармацевтической химии ФОО ПГФА в 2008-2012 гг.
Результаты исследований и их обсуждение
В результате проведенных исследований [6] для определения посторонних примесей в субстанции КОН-1 были выбраны следующие хроматографические условия:
- подвижная фаза: фосфатный буфер (рН 7) – ацетонитрил;
- режим элюирования – градиентный (исходная доля ацетонитрила в элюенте – 20% в течение 10 минут, с 10 по 20 мин. возрастание доли ацетонитрила до 80%);
- температура термостата колонки – 40 °С;
- скорость потока подвижной фазы – 1,5 мл/мин.
- объем вводимой пробы – 20 мкл;
- длина волны детектирования – 310 нм (для МЭАПВК), 260 нм (для ББА).
Методика определения примесей. 0,050 г субстанции КОН-1 помещают в мерную колбу вместимостью 25 мл, растворяют в 15 мл метанола, доводят объем колбы метанолом до метки и перемешивают. Концентрация субстанции КОН -1 в анализируемом растворе составляет 0,002 г/мл (2000 мкг/мл). Раствор хроматографируют не менее 3 раз.
Валидацию аналитической методики проводили по параметрам: специфичность, линейность, правильность, повторяемость (сходимость), предел обнаружения и предел количественного определения.
Для подтверждения специфичности методики проанализированы модельная смесь КОН-1 (2 мг/мл), МЭАПВК и ББА (10 мкг/мл) в метаноле и растворитель образца (метанол). Идентификацию веществ на хроматограмме осуществляли путем сопоставления времён удерживания аналитов и стандартных образцов. Анализ «холостой» хроматограммы (растворителя образца) показал отсутствие мешающих посторонних пиков.
При анализе модельной смеси оценены параметры, характеризующие пригодность хроматографической системы: коэффициент разделения (Rs), эффективность колонки, коэффициент асимметрии пиков, критерий воспроизводимости результатов измерений (воспроизводимости инжекций) (табл. 1). Полученные данные свидетельствуют о приемлемом разрешении и воспроизводимости хроматографической системы.
Таблица 1 - Параметры пригодности хроматографической системы
|
Вещество |
Время удерживания, мин* |
Коэффициент разделения пиков Rs |
Коэффициент асимметрии |
Эффективность колонки (N) |
RSD % площади пика* |
|
МЭАПВК |
2,40 ± 0,02 |
|
1,21 |
4020 тт |
0,55 |
|
КОН-1 |
5,45 ± 0,02 |
6 |
|
|
|
|
ББА |
18,78 ± 0,03 |
17 |
1,35 |
8900 тт |
0,32 |
|
|
|
Критерий приемлемости: не менее 2 |
Критерий приемлемости: 0,8 – 1,5 |
Критерий приемлемости: более 2000 |
Критерий приемлемости: не более 2 |
*- расчет проводился по 5 хроматограммам раствора
Линейность методики определяли на пяти или шести уровнях концентраций: для МЭАПВК - 0,1; 0,25; 0,35; 0,5; 1% от содержания в основном веществе – субстанции КОН-1; для ББА – 0,05; 0,1; 0,25; 0,35; 0,5; 1% от содержания в основном веществе. Для этого в мерные колбы вместимостью 25 мл помещали раствор МЭАПВК или ББА в метаноле с точной концентрацией около 50 мкг/мл (0,5, 1,0, 2,5, 3,5, 5,0 и 10,0 мл) и доводили объем колб метанолом до метки.
Каждый из полученных растворов хроматографировали в разработанных условиях не менее 3 раз. Рассчитывали среднее значение площадей пиков и строили кривую зависимости площади пика от концентрации вещества в растворе (табл. 2, рис. 1, 2).
Предел обнаружения МЭАПВК – 0,8 мкг/мл (0,04% от содержания в субстанции КОН-1); предел количественного определения – 1,5 мкг/мл (0,075% от содержания в субстанции КОН-1).
Предел обнаружения ББА – 0,3 мкг/мл (0,015% от содержания в субстанции КОН-1); предел количественного определения – 0,5 мкг/мл (0,025% от содержания в субстанции КОН-1).
Таблица 2 - Данные для построения калибровочных графиков МЭАПВК и ББА
|
Концентрация МЭАПВК, мкг/мл |
Площадь хроматографического пика |
Концентрация ББА, мкг/мл |
Площадь хроматографического пика |
|
- |
- |
1,03 |
81737 |
|
2,09 |
39540 |
2,06 |
160962 |
|
5,22 |
106792 |
5,16 |
438139 |
|
7,31 |
159601 |
7,22 |
565983 |
|
10,44 |
220885 |
10,32 |
854263 |
|
20,88 |
468876 |
20,64 |
1620573 |
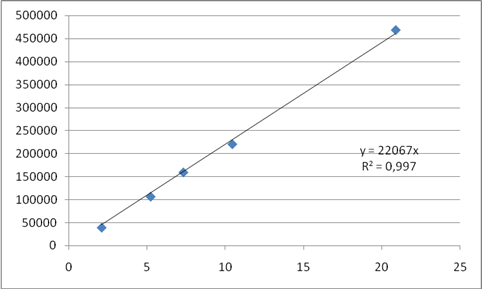
Рис. 1. Калибровочный график количественного определения МЭАПВК
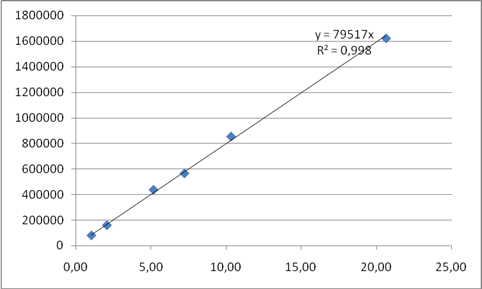
Рис. 2. Калибровочный график количественного определения ББА
Оценку внутрилабораторной повторяемости разработанной методики проводили на модельных растворах. Для этого 0,050 г субстанции КОН-1 помещали в мерную колбу вместимостью 25 мл, добавляли растворы МЭАПВК и ББА в метаноле с концентрацией 50 мкг/мл до получения концентраций, соответствующих 0,1; 0,25; 0,5 и 0,75% от содержания основного вещества, и доводили объем колб метанолом до метки. Каждый из растворов хроматографировался не менее 3 раз (табл. 3 и 4).
Относительное стандартное отклонение не превышает 10,0%, что свидетельствует об удовлетворительной сходимости результатов на всех уровнях рассматриваемых концентраций для обоих веществ.
Таблица 3 – Оценка внутрилабораторной повторяемости методики определения МЭАПВК
|
Содержание МЭАПВК в модельной смеси, мкг/мл |
Найденное содержание МЭАПВК, мкг/мл |
Метрологические характеристики (P =0,95; n=6) |
||||
|
n |
Хср. |
SD |
RSD |
ΔX |
||
|
2 |
1,66; 1,87; 1,78; 2,04; 1,63; 1,91 |
6 |
1,82 |
0,150 |
8,29 |
0,16 |
|
5 |
4,52; 5,11; 4,24; 4,72; 5,08; 4,50 |
6 |
4,70 |
0,334 |
7,12 |
0,36 |
|
10 |
10,12; 8,76; 9,78; 10,07; 8,88; 9,62 |
6 |
9,54 |
0,586 |
6,15 |
0,61 |
|
15 |
14,52; 15,06; 13,98; 14,83; 15,21; 14,56 |
6 |
14,69 |
0,44 |
2,98 |
0,44 |
Таблица 4 – Оценка внутрилабораторной повторяемости методики определения ББА
|
Содержание ББА в модельной смеси, мкг/мл |
Найденное содержание ББА, мкг/мл |
Метрологические характеристики (P =0,95; n=6) |
||||
|
n |
Хср. |
SD |
RSD |
ΔX |
||
|
2 |
1,58; 1,65; 1,84; 1,49; 1,88; 1,61 |
6 |
1,68 |
0,123 |
7,33 |
0,16 |
|
5 |
5,36; 4,72; 5,19; 4,92; 5,21; 5,09 |
6 |
5,08 |
0,223 |
4,51 |
0,24 |
|
10 |
9,74; 10,40; 10,18; 9,92; 9,67; 10,22 |
6 |
10,02 |
0,276 |
2,76 |
0,30 |
|
15 |
14,30; 15,27; 14,10; 14,82; 15,15; 15,38 |
6 |
14,84 |
0,472 |
3,19 |
0,56 |
При определении правильности методики оценивали открываемость известного количества посторонних примесей, введенных в плацебо (субстанцию КОН-1). Исследования проведены на трех уровнях содержания примесей (0,1; 0,5 и 0,75%). По 0,05 г субстанции КОН-1 помещали в мерные колбы вместимостью 25 мл, растворяли в 10 мл метанола, добавляли в каждую колбу раствор МЭАПВК и ББА в метаноле с концентрацией 50 мкг/мл (1,0; 5,0 и 7,5 мл) и доводили объем колб метанолом до метки. Результаты представлены в таблицах 5-6.
Границы открываемости МЭАПВК и ББА не выходят за пределы 75–125%, рекомендованные при количественном определении примесей с нормой содержания от 0,1 до 1%.
Анализ пяти серий субстанции КОН-1 показал, что содержание в них посторонних примесей МЭАПВК и ББА не превышает 0,1%.
Разработанная методика включена в проект ФС на субстанцию КОН-1.
Таблица 5 – Оценка правильности методики определения МЭАПВК
|
Содержание МЭАПВК в модельной смеси, мкг/мл |
Открываемость (R), %
|
Метрологические характеристики (P =0,95; n=6) |
||||
|
n |
R ср. |
SD |
RSD |
ΔR |
||
|
2 |
79,2; 82,5; 88,6; 77,2; 101,5; 86,2 |
6 |
89,2 |
8,47 |
9,50 |
9,00 |
|
10 |
100,1; 87,4; 94,2; 103,6; 89,1; 97,8 |
6 |
95,4 |
6,23 |
6,54 |
6,64 |
|
15 |
102,1; 98,9; 100,5; 97,3; 99,1; 97,8 |
6 |
98,8 |
2,61 |
2,65 |
2,78 |
Таблица 6 – Оценка правильности методики определения ББА
|
Содержание ББА в модельной смеси, мкг/мл |
Открываемость (R), % |
Метрологические характеристики (P =0,95; n=6) |
||||
|
n |
R ср. |
SD |
RSD |
ΔR |
||
|
2 |
99,7; 105,1; 93,4; 97,1; 102,7; 90,9 |
6 |
98,15 |
4,36 |
4,44 |
5,70 |
|
10 |
102,5; 95,6; 100,8; 95,2; 92,0; 98,1 |
6 |
97,37 |
3,87 |
3,97 |
4,07 |
|
15 |
96,2; 102,8; 100,3; 92,8; 98,4; 94,3 |
6 |
97,47 |
3,48 |
3,58 |
3,94 |
Выводы
1. Разработан способ определения примесей МЭАПВК и ББА в субстанции КОН-1 методом обращённо-фазной ВЭЖХ.
2. Валидация разработанной методики по параметрам специфичность, линейность, предел обнаружения и предел количественного определения, повторяемость (сходимость), правильность показала её приемлемость для определения 0,05-0,75% примесей МЭАПВК и ББА в субстанции КОН-1.
Рецензенты:
Коркодинова Любовь Михайловна, доктор фармацевтических наук, профессор, заведующий кафедрой фармацевтической химии ФОО ГБОУ ВПО «ПГФА» Минздрава России, г. Пермь.
Вихарева Елена Владимировна, доктор фармацевтических наук, доцент, заведующий кафедрой аналитической химии ГБОУ ВПО «ПГФА» Минздрава России, г. Пермь.



