Введение
Центральной органеллой как секреторного, так и вакуолярного путей клеток растений является комплекс Гольджи. Сведения о структурной организации КГ растительных клеток получены в основном на клетках одноклеточных водорослей и покрытосемянных растений [3; 4], у которых органелла представлена стопкой уплощенных мало перфорированных мембранных мешочков. Ранние электронно-микроскопические исследования показали, что КГ растительных и животных клеток имеет похожее строение [2]. Поэтому механизмы секреторного транспорта в растительных клетках объясняются, как правило, с позиции существующих для клеток млекопитающих ведущих моделей: «везикулярной» [2] и «созревания и прогрессии» цистерн [7].
Везикулам, образующимся в результате функциональной активности комплекса белков покрытия – СОРI, в «классических» моделях «везикулярной» и «созревания-прогрессии» цистерн отводится основная транспортная функция. Однако эксперименты на клетках цветковых растений выявили ряд плохо согласующихся с данными моделями фактов. Поэтому мы поставили своей целью проанализировать выраженность везикулярного компонента в растительных клетках для дополнительных доказательств или опровержения их возможного участия в качестве транспортных переносчиков.
Материал и методы
Комплекс Гольджи на клетках меристемы кончика корня гороха посевного, Pisum sativum Linnaeus, 1753. Использовались этиолизированные проростки гороха посевного, выращенные в темноте при температуре плюс 22 °С в кюветах на фильтровальной бумаге, смоченной прокипяченной водопроводной водой. Исходным материалом служили проростки, выращенные в течение 2 суток (с момента замачивания) до достижения корнем длины 2,0-2,5 см.
Образцы ткани размером 0,5 см инкубировались в течение 15 минут на льду с 100 mM раствором NEM. Затем отмывались дистиллированной водой, фиксировались фиксатором Милонинга при t 0-4 °C 2 часа, постфиксировались смесью 2%-ного тетраоксида осмия на дистиллированой воде и 3%-ного ферроцианида калия в пропорции 1:1 на 0,2 M какодилатном буфере, в течение 1 часа на льду, промывали шесть раз 0,05 М какодилатным буфером (pH 6,8). Затем проводили дегидратацию в спиртах восходящей концентрации: образцы находились по 10 минут в каждом растворе с трехкратной сменой (3 x 10 мин в 50%-ном этаноле, 3 x 10 мин в 70%-ном этаноле, 3 x 10 минут в 90%-ном этаноле, 3 x 10 минут в 100%-ном этаноле). Затем образцы находились 2 часа при комнатной температуре в смеси 100%-ного этанола и эпоксидной смолы (Epon) в пропорции 1:1. Смесь удалялась с помощью пипетки, затем добавлялась эпоксидная смола и через 2-3 часа образцы помещались в термостат на 24 часа при плюс 60 °C для полимеризации [1]. Анализировались не менее 30 случайно выбранных стопок КГ контрольной и экспериментальной серий.
Результаты и их обсуждение
Для доказательства наличия СОРI–производных везикул в структуре КГ растительных клеток и активности первого комплекса белков покрытия мы использовали экспериментальную модель, в которой применили свойства N-этилмалеимида (N-ethylmaleimide, NEM) избирательно инактивировать малую АТФазу NSF (N-ethylmaleimide sensitive factor), участвующую в работе особого механизма «адресного» слияния белков SNARE. Образовавшиеся с помощью СОРI везикулы могут вновь слиться с цистернами или трубочками КГ при наличии на донорской и акцепторной мембранах специфической комбинации SNARЕ-белков. Они не только могут приближать мембраны, но и удерживать их, способствуя слиянию даже при обычных концентрациях ионов кальция [5]. Подготовка SNARЕ-белков к следующему циклу слияния происходит с помощью белка SNAP и малой АТФазы - NSF, катализирующей структурные изменения в образовавшемся комплексе. Поэтому, если инактивировать NSF, сформировавшиеся СОРI–производные везикулы не смогут сливаться и будут накапливаться в «зоне» органеллы. В результате произойдет изменение структуры КГ, сопровождающееся постепенным уменьшением размеров цистерн и накоплением свободных везикул. Такую трансформацию можно описать как «везикуляция» органеллы.
Обработка N-этилмалеимидом клеток меристемы гороха не выявила значительных изменений в структуре КГ. В органелле сохраняется стопочное строение, однако на цистернах регистрируются мембранные почки, а также обнаружены единичные округлые профили в «зоне» КГ (рис. 1). Отсутствие характерной для клеток животных «везикуляции» может указывать как на отсутствие свободных везикул, так и на их малое количество. Однако выявленные на цис- и медиальных цистернах КГ с помощью ТЭМ окаймленные почки позволяют полагать, что в структуре КГ меристематических клеток гороха небольшое количество свободных СОРI–производных везикул все же существует. Однако их количество явно не достаточно для осуществления транспортной функции в качестве переносчиков карго.
Кроме того, если говорить о роли COPI-производных пузырьков как ретроградных переносчиков, то их локализация на уровне медиальных цистерн КГ и отсутствие на уровне транс-цистерны не позволяет объяснить механизм возврата ферментов КГ, локализующихся в транс-компартменте [8]. Против роли везикул в качестве транспортных переносчиков выступают данные о высокой подвижности стопки КГ растительных клеток, которые могут перемещаться вдоль цистерн ЭР со скоростью до 4 мкм/мин [2]. При этом механизм удержания не только везикул в структуре КГ, но и самих мешочков в стопке остается не понятным.
Полученные нами результаты о слабой выраженности везикулярного компонента в структуре КГ, а также ряд других опубликованных данных ставят под сомнение участие свободных везикул в качестве транспортных переносчиков через КГ в растительных клетках. Однако, как и в клетках животных, COPI является обязательным для секреторного транспорта молекулярным комплексом, полное блокирование работы которого приводит к прекращению секреции.
Было высказано предположение о возможном участии СОРI–производных везикул в качестве механизма, ингибирующего слияние мембран соседних компартментов КГ, в клетках человека и животных. Данный механизм лежит в основе предложенной А.А. Мироновым с соавторами (2012) модели «слияния и последующего разделения» компартментов («kiss-end-run») [6].
В растительных клетках, имеющих слабо развитую систему везикул, СОРI–механизм регуляции слияния-разделения непрерывностей между компартментами секреторного пути также возможен, однако, вероятнее всего, он менее развит, чем у организмов со стопочной фенотипической формой органеллы.
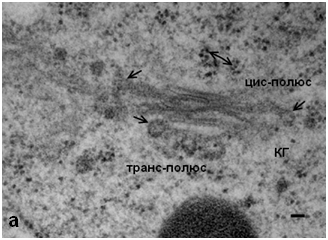
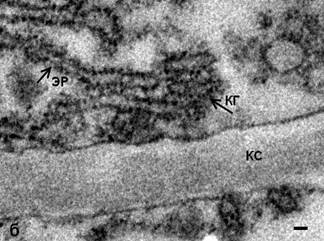
Рис. 1. Комплекс Гольджи меристемы корня гороха посевного, Pisum sativum: а – интактные клетки, одинарные стрелки – окаймленные почки, двойная стрелка – свободные рибосомы. ТЭМ. Бар 50 нм; б – КГ после воздействия NEM; КС – клеточная стенка, ЭР – эндоплазматический ретикулюм. ТЭМ. Бар 50 нм.
Рецензенты:
Диндяев Сергей Валерьевич, д.м.н., профессор кафедры гистологии, эмбриологии и цитологии ГБОУ ВПО «Ивановская государственная медицинская академия» Министерства здравоохранения Российской Федерации, г. Иваново.
Иванов Александр Викторович, д.м.н., профессор, заведующий кафедрой гистологии, эмбриологии, цитологии ГБОУ ВПО «Курский государственный медицинский университет» Министерства здравоохранения Российской Федерации, г. Курск.



