Круг препаратов для антиоксидантотерапии достаточно ограничен. Известно применение α-токоферола [8, 9, 12, 13], убихинона [5, 14], каратиноидов[2, 15, 16], витаминов А, К [3] флаваноидов[11] и природных продуктов [4, 6, 10], содержащих эти соединения. Причину активности антиоксидантов связывают, прежде всего, с наличием свободных гидроксильных групп. В предыдущих сообщениях (сообщ. 1, 2) кинетическими методами мы сравнили антиоксидантную активность ионола (2, 6-дитретбутил-4-метилфенола), α-токоферола (2, 5, 7, 8-тетраметил-2-(4, 8, 12-триметилтридецил)-6-оксихрома-на) в безводной и водно-липидной среде. Подтвердили литературные данные о том, что α-токоферол проявляет антиоксидантную активность в безводной среде, но обнаружили, что он является малоэффективным в водно-липидном субстрате. Отметили также, что ионол в водно-липидном субстрате обладает более сложным механизмом действия по сравнению с безводной средой.
В двух предыдущих сообщениях был впервые изучен антиоксидантный эффект гипотензивного препарата – капотена (1-[(2S)-3-метилпропионил]-L-пролина). Показано, что в безводной среде капотен является слабым ингибитором, а при более высоких концентрациях ускоряет процесс окисления. В то же время в водно-липидном субстрате при определенных концентрациях капотен проявляет высокий антиоксидантный эффект. Эти факты могут иметь значение для расширения области применения капотена и исследования механизма его фармакологического действия. Поскольку эффект антиоксидантотерапии часто связывают с устранением хрупкости капилляров и других кровеносных сосудов, то не исключена разработка новых программ гипотензивной терапии с учетом антиоксидантного эффекта капотена.
В фармакопее известно достаточно много лекарственных препаратов фенольной природы [4, 6, 10]. В настоящем сообщении приведены результаты тестирования с помощью разработанной нами водно-липидной модели, антиоксидантной активности ряда фенольных лекарственных препаратов: парацетамола (п-ацетаминофенола), осалмида (2-гидрокси-1-(N-4'-гидроксифенила), эмоксипина (3-гидрокси-6-метил-2-этилпиридина) и их полупродукта – фенола.
Методы эксперимента
В предыдущем сообщении (сообщ. 2) приведены результаты подбора состава водно-липидной системы, которая включает этилолеат и воду в соотношении 1 : 3 (V/V), цетилтриметиламмоний бромид (эмульгатор), хлорид меди (катализатор) в концентрациях (1–3)∙10-3 моль/л, соответствующих их максимальной эффективности. Окисление пробы субстрата проводят в термостатированной ячейке при 60±0,2оС при непрерывном перемешивании. Скорость перемешивания подбирается таким образом, чтобы процесс протекал в кинетической области. Методики получения или очистки цетилтриметиламмония бромида, хлорида меди, этилолеата описаны в сообщ. 2. Субстанции лекарственных препаратов выделяют из лекарственных форм по стандартным методикам государственной фармакопеи [1].
Для оценки антиоксидантных свойств лекарственных препаратов предварительно исследована антиоксидантная активность их полупродукта – фенола. С этой целью изучена кинетика окисления водно-липидного субстрата при различных концентрациях фенола. Кинетические кривые (КК) приведены на рис. 1.
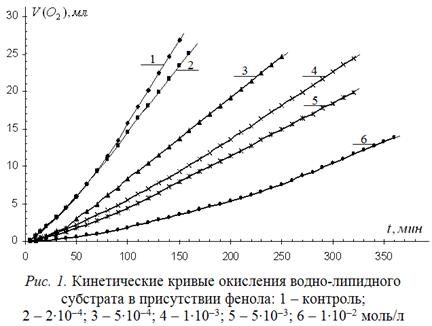
Таблица 1.
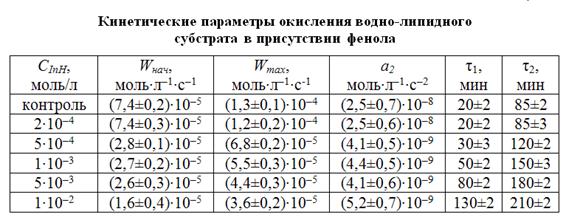
Из рисунка видно, что концентрации фенола выше 2∙10-4 моль/л замедляют процесс окисления, снижая начальную и максимальную скорости пропорционально концентрации. Известно, что снижение начальной скорости обусловлено участием ингибитора в обрыве цепей, а снижение максимальной скорости обычно связано с участием продуктов окисления ингибитора в обрыве цепей. Для исследования механизма действия фенола в водно-липидном субстрате кинетические кривые (КК) обработаны по описанной в сообщении 1 методике. Результаты приведены в табл. 1.
Из таблицы видно, что при десятикратном и более высоком избытке катализатора по отношению к фенолу последний не эффективен, он практически не влияет на начальные стадии окисления субстрата, незначительно снижая максимальную скорость окисления. При увеличении концентрации фенола его эффект заключается в снижении начальной и максимальной скоростей. При большом избытке фенола (в 5 раз и выше) по отношению к катализатору происходит более значительное снижение начальной и максимальной скоростей процесса.
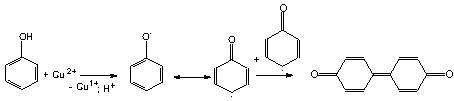
Результаты влияния фенола на кинетику окисления водно-липидного субстрата можно объяснить сопряженными и параллельными реакциями инициирования, продолжения и обрыва цепей (1-6) и возможным участием продуктов окисления фенола в обрыве цепей (7):
![]() (1)
(1)
![]() (2)
(2)
![]() (3)
(3)
![]() (4)
(4)
![]() (5)
(5)
![]() (6)
(6)
![]() (7)
(7)
При большом избытке катализатора параллельно протекают реакции (1) и (2), а затем (3) и (4), при этом суммарная скорость процесса не меняется по отношению к контрольной пробе. Небольшое снижение максимальной скорости, вероятно обусловлено реакцией (7). При увеличении концентрации ингибитора по отношению к концентрации катализатора возрастает вклад реакций (5) и (7), наблюдается снижение начальной и максимальной скоростей.
Превращение фенола в реакциях (2) и (5) описывается уравнением:
Парацетамол
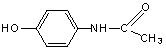
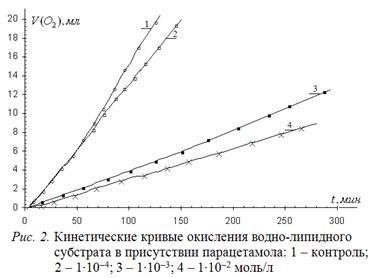
(4-(N-ацетил)аминофенол) обусловливает анальгетический, болеутоляющий эффект, отличается от фенола только заместителем в пара-положении. Характер его влияния на окисление водно-липидного субстрата меняется в зависимости от концентрации. Подобно фенолу, при концентрациях (1 – 2)∙10-4 моль/л отсутствует торможение процесса. При повышении концентрации парацетамола и увеличении его избытка по отношению к катализатору наблюдается снижение начальной и максимальной скоростей, подобно эффекту фенола. Что свидетельствует о слабом влиянии заместителя на кинетику и механизм действия и обусловленность эффекта парацетамола его фенольной природе. Типичные КК приведены на рис. 2.
Осалмид
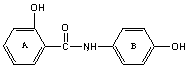
(2-гидроксибензол-(N-4´-гидрокси-фенил)-карбамид), применяемого в медицине в качестве желчегонного средства, содержит две гидроксильных группы в двух бензольных кольцах. Один гидроксил в кольце А содержит замещенную карбоксильную группу в п. 2. Второй гидроксил в кольце В содержит замещенную аминогруппу в п. 4. Типичные КК окисления водно-липидного субстрата в зависимости от концентрации осалмида приведены на рис. 3, а результаты математической обработки в табл. 2.
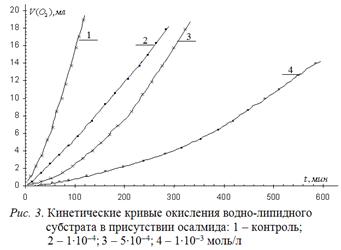
Таблица 2.

Показано, что все исследованные концентрации уменьшают начальные и максимальную скорости, увеличивают период торможения и период окончания ускорения. С учетом описанного выше механизма действия фенола, очевидно, что осалмид не участвует в реакции 2, а участвует в реакциях обрыва цепей (4), что приводит к снижению начальной скорости процесса. Участие продуктов превращения осалмида в реакциях обрыва цепей приводит к снижению максимальной скорости и ускорения.
Сравнение значений табл. 1 и 2 показывает, что добавки 1∙10-3 моль/л осалмида примерно в ~5 раз эффективнее снижает начальную и максимальную скорости окисления, в 2 раза – период торможения, в 1,4 раза – период окончания ускорения. В целом, по результатам сравнения, можно говорить о большей антиоксидантной активности осалмида, в отличие от фенола и парацетамола и другом механизме его действия. Последнее, как показано выше, сами легко окисляются.
Эмоксипин
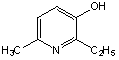
(3-гидрокси-6-метил-2-этилпиридин), применяемого в офтальмологической практике в качестве средства для лечения внутриглазных кровоизлияний, проявляет свойства одноатомных фенолов за счет гидроксильной группы в ароматическом пиридиновом цикле. КК окисления водно-липидного субстрата при различных концентрациях эмоксипина приведены на рис. 4.
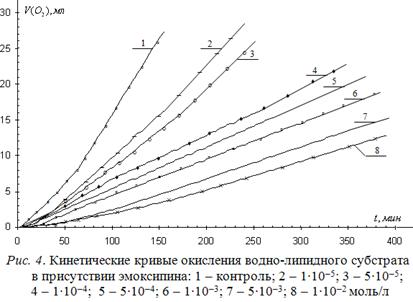
Результаты математической обработки КК приведены в табл. 3.
Таблица 3.
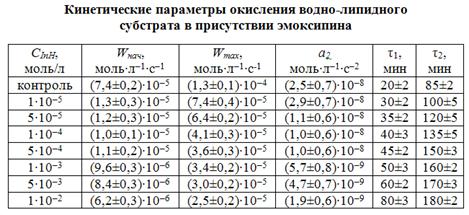
Показано, что при всех исследованных концентрациях эмоксипин тормозит начальные стадии процесса, уменьшает максимальные скорости и ускорение. Очень малые величины ускорения приводят к практически постоянным скоростям после периода торможения, что не позволило по техническим условиям определить период окончания ускорения.
В целом, результаты свидетельствуют об антиоксидантной активности эмоксипина в водно-липидном субстрате. Применение эмоксипина в офтальмологии при внутриглазных кровоизлияниях и обнаруженные в настоящем исследовании его антиоксидантные свойства позволяют уточнить механизм его фармакологического действия.
Сравнение кинетических параметров окисления водно-липидного субстрата в присутствии одинаковых концентраций лекарственных препаратов (табл. 4) показывает, что минимальная величина начальной скорости и наибольшее значение периода полного торможения свидетельствует об эффективном участии осалмида в реакциях обрыва цепей. Уменьшение максимальной скорости по сравнению с контрольной пробой свидетельствует об участии продуктов окисления в реакциях разветвления и продолжения цепей, но более слабым ингибитором, чем ионол при исследованных концентрациях.
Таблица 4.
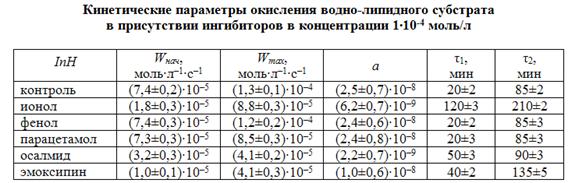
Парацетамол и эмоксипин действуют как слабые ингибиторы; они только замедляют начальные скорости окисления, не обеспечивая периодов полного торможения. Но в присутствии парацетамола и эмоксипина наблюдается снижение максимальной скорости пропорционально концентрации, что свидетельствует о возможности участия продуктов их окисления в обрыве цепей.
Показано, что фенол является слабым ингибитором каталитического окисления водно-липидных субстратов, потому что сам способен к окислению в этих условиях.
Монозамещенное производное фенола – парацетамол проявляет слабый антиоксидантный эффект подобно фенолу.
Осалмид, содержащий две гидроксильные группы в двух бензольных кольцах, является эффективным ингибитором окисления водно-липидного субстрата.
Эмоксипин является слабым ингибитором подобным фенолу.
СПИСОК ЛИТЕРАТУРЫ:
1. Государственная фармакопея СССР. – М.: Медицина, 1987. – 333с.
2. Касаикина О.Т., Карташева З.С., Гагарина А.Б. // Изв. АН СССР сер. хим. – 1981. – Т. 276. – № 3. – С. 540-556.
3. Конь И.Я., Горшидзе Л.Ш., Васильева О.Н., Кулакова С.Н. // Биохимия. – 1986. – Т. 51. – № 1. – С. 70-76.
4. Керман Н.Б., Орлов А.А., Маевский Е.И., Милютина Н. П., Ипполитов В.П., Мариничева И.Г., Петрова И.Н. Средства для защиты головного мозга от гипоксически-ишемического повреждения. Пат. 2275195 Россия. МПК А61К 31/41 68, А61Р 9/10. N 2003118198/15; Заявл. 19. 06. 2003; Опубл. 27.04.2006.
5. Наумов В.В., Храпова Н.Г. // Биофизика. – 1985. – Т. 30. – № 1. – С. 5-9.
6. Рыжикова М.А., Габитова Д.М, Рыжикова В.О. Фитопрепарат из багульника – перспективное антиоксидантное средство для лечения бронхолегочных патологий // Химические реактивы, реагенты и процессы малотоннажной химии: Материалы 19 Международной научно-технической конференции г. Уфа 2 – 4октября 2006. – Уфа, изд-во Реактив, 2006. – Т. 1. – С. 107-108.
7. Сыров В.Н., Хушбактова З.А., Гусаков В.М., Батиров Э.Х., Каплан Е.Я. // Химико-фармацевтический журнал. – 1987. – № 1. – С. 59-62.
8. Халилов Э.М., Торховская Т.И. / В сб.: Эссенциальные фосфолипиды в лечении атеросклероза, Ленинград, 1989. – С. 36-44.
9. Храпова Н.Г.Токоферолы – регуляторы интенсивности перекисного окисления липидов биомембран // Медицина и охрана здоровья. Медтехника и аптека: Материалы международного симпозиума г. Тюмень 16 – 19 сентября 1997.– Тюмень, изд-во Наука Сервис, 1997. – С. 24.
10. Хишбактова З.А., Юсупова С.М., Замараева М.В., Тадживаева Э.Т., Сыров В.Н., Батиров Э.Х., Юлдашев М.П. // Химия природных соединений. – 1996. – № 3. – С 350-356.
11. Шилова и.В., Краснов Е.А., Кувачева Н.В., Новожеева Т.П. Средство, обладающее антиоксидантной активностью Пат. 2292214 Россия, МКП А61К 36/28, А61Р 17/18. N 2005123760/15; Заявл. 26.07.2005; Опубл. 27.01.07, Бюл. № 3.
12. Esterbauer H., Puhl H., Waeg G., Krebs A., Dieber-Rotheneder M. / In.: Packer L., Fuchs J. eds. Vitamin E: Biochemistry and clinical applications. N. Y.: Marcel Dekker, Inc., 1992. – P. 649-671.
13. Yanishlieva N., Marinova E. Natural antioxidants in lipid oxidation // Buld. Chem. Commun. 2003. – Vol. 35. – N. 2. – P. 79-91/
14. Landi L., Carbini L., Tadolini B. et al // Ital. I. Biochem. – 1985. – Vol. 34. – N. 5. – P. 356-363/
15. Palozza P., Krinski N. // Free Rad. Biol et Med. – 1991. – N. 4. – P. 407-414.
16. Terao I. // In.: All rigst reserved Flontiers of reactive oxygen species in biology and medicine. – 1994. – P. 329-332.



