Введение
Фотохромные соединения способны под действием активирующего излучения изменять свои электронный спектр поглощения в совокупности с прочими физико-химическими характеристиками. Такие соединения являются перспективной основой функциональных «умных» материалов с переключаемыми характеристиками и могут найти свое применение при создании компонентов молекулярной электроники, новых систем хранения электронной информации и хемосенсорных устройств [5]. Спиропираны (1) – один из наиболее исследуемых и перспективных классов органических бистабильных фотоконтролируемых систем. Их фотохромные свойства основаны на фотоиндуцируемом разрыве связи в бензопирановом фрагменте и изомеризации относительно образовавшейся системы двойных связей, приводящей к «открытой» мероцианиновой форме (рисунок 1) [3].
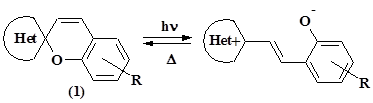
Рисунок 1. Общая схема изомеризации спиропиранов
Одним из несомненных достоинств таких фотохромных соединений являются потенциально достижимые высокие значения эффективности фотоокрашивания, отличная спектральная различимость фотоперключаемых изомеров и хорошие возможности «настройки» различных характеристик фотохромного равновесия за счет варьирования структуры. Несмотря на то, что фотоиндуцируемые процессы затрагивают геометрию бензопирановой части молекулы, строение гетаренового фрагмента может оказывать решающее влияние как на динамику протекания фотоизомеризации, так и на спектральные характеристики.
Цель исследования
Ранее нами были исследованы спиропираны оксазиноновой серии (2). При изучении этих соединений было показано, что строение гетареновой компоненты может быть определяющим для эффективности протекания фотоизомеризации [1]. В частности, было установлено, что геометрия фотохромного узла O-Cспиро –N-C=O определяет эффективность участия неподеленной электронной пары атома азота при заселении разрыхляющей орбитали Cспиро-O, что может уменьшить стабильность циклических изомеров и привести к улучшению фотохромных свойств. Целью работы стало получение и исследование аналогов соединений (2) акцепторными заместителями в бензопирановой компоненте и с системно-модифицированным гетареновым фрагментом для продолжения исследования механизмов связи структуры спиропиранов с различными фотодинамическими параметрами [4]. Основными направлениями модификации оксазинонового фрагмента стало увеличение в нем размера системы сопряжения, увеличение размера заместителей у атома азота рядом со спиро-центром, а также ликвидация карбонильной эндоциклической группы. Для конструирования необходимых гетареновых фрагментов и их инкорпорирования в спиропирановые структуры были получены азосоединения (3–5).
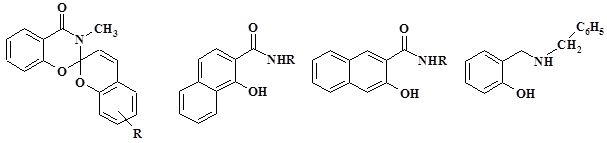
(2) (3) (4) (5)
Амиды (3, 4) были получены на основе орто-гидрокси-нафтойных кислот (6,7) при реакции с соответствующим амином в присутствии треххлористого фосфора.
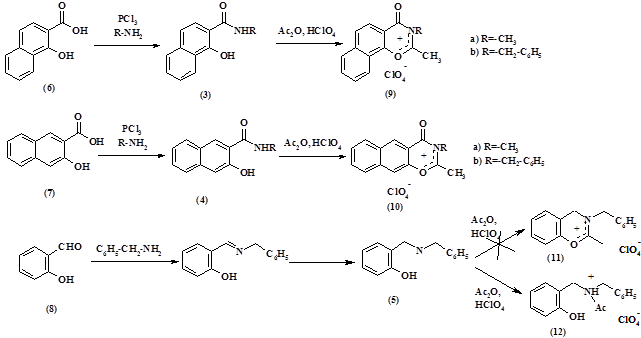
Амин (5) был получен на основе салицилового альдегида (8) и бензиламина путем их конденсации и последующего восстановления соответствующего основания Шиффа. При взаимодействии амидов (3, 4) с уксусным ангидридом в присутствии хлорной кислоты были получены соли (9, 10) с активной экзоциклической метильной группой. Попытка получения соединения (11) на основе амина (5) в аналогичных условиях привела не к желаемому циклическому продукту, а к перхлорату моно-ацилированного производного (12). В ходе дальнейших исследований предполагается отработать методики получения гетероциклических солей (11) с различными заместителями при атоме азота путем циклизации соответствующих аминов в 2-метил-3,4-дигидро-2Н-бензоксазины и их последующего мягкого окисления в присутствии хлорной кислоты.
Необходимый нам для синтеза целевых спиропиранов 2,4-дигидроксиизофталевый альдегид (13) был получен по разработанной ранее методике [2]. Используя активность метильной группы в реакциях конденсации с орто-гидрокисароматическими альдегидами, по двухстадийной методике с промежуточным выделением стирильных производных были синтезированы спиропираны (14) с модифицированными гетареновыми фрагментами.
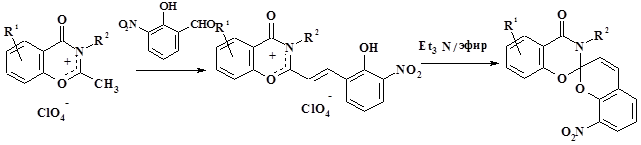
(9, 10) (14)
(14 a) R1 = 7,8-бензо; R2=СH3
(14 b) R1 = 6,7-бензо; R2=СH3
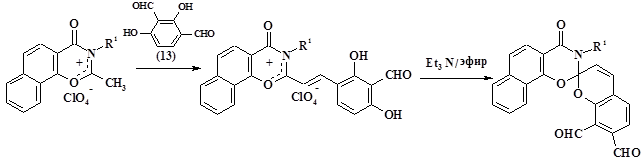
(14 c) R1 = СH3;
(14 d) R1 = СH2-C6H5;
Структура полученных соединений была подтверждена с использованием элементного анализа, а также ИК- и ЯМР 1Н спектроскопии.
Были проведены фотохимические исследования полученных соединений (14a-c). В стационарных условиях при облучении растворов спиропиранов светом с длиной волны 365 нм наблюдается появление максимумов в длинноволновой области электронных спектров поглощения (таблица 1), свидетельствующих о появлении открытой изомерной формы вследствие разрыва связи Сспиро-О в молекулах спиросистем.
При сравнении полученных данных с результатами фотохимических исследований ранее полученных соединений (2) показано, что введение дополнительно аннелированного бензольного кольца приводит к уменьшению времени жизни открытых фотоиндуцированных изомеров [2].
Таблица 1. Характеристики спектров поглощения спиропиранов в толуоле при t = 20 °С
|
Соединение |
|
e ( M-1см-1 |
Фотоиндуцированная форма |
|
|
|
t, сек |
|||
|
(14a) |
298 327 |
8000 7740 |
576 пл 615 |
3,1 |
|
(14b) |
298 337 |
10300 4450 |
583 пл 625 |
2,2 |
|
(14c) |
343 |
6690 |
не наблюдается в условиях эксперимента |
– |
Несмотря на наличие электроноакцетпорных заместителей в 8' положении в соединении (14с), этот спиропиран не проявляет фотохромных свойств, очевидно из-за конкурирующего влияния донорных гидроксильных групп в 7´-положении.
Заключение
При разработке подходов к получению спиропиранов с модифицированным оксазиновым фрагментом в структуре получена серия новых спиросоединений. Часть полученных соединений проявляет фотохромные свойства в условиях стационарного облучения с образованием открытой мероцианиновой формы. Продемонстрировано влияние электронодонорных заместителей в бензопирановом фрагменте на увеличение стабильности закрытого спироциклического изомера.
Экспериментальная часть
ИК-спектры поглощения регистрировались на инфракрасном Фурье-спектрометре (Excalibur HE 3100, PC). Съемка ИК-спектров осуществлялась с помощью метода нарушенного внутреннего полного отражения. Съемка электронных спектров поглощения проводилась в толуольных растворах на спектрофотометре Agilent 8453. В качестве источника облучения применялась ртутная лампа ДРШ-250 с использованием стандартного набора фильтров. Съемка спектров ЯМР 1Н проводилась на радиоспектрометре Bruker 250 (250 MГц) в импульсном Фурье-режиме в дейтерохлороформе. Положение сигналов исследуемого вещества определялось по δ – шкале, отнесение сигналов проведено относительно остаточных сигналов протона дейтерорастворителя – дейтерохлороформа, константа спин-спинового взаимодействия J дана в герцах.
Перхлорат 2,3-диметил-2,3-дигидронафто[2,1-e][1,3]оксазин-4-ония (9а)
В трехгорлую круглодонную колбу, снабженную мешалкой, поместили 22,1 г (0,33 моль) метиламин гидрохлорида, добавили 150 мл сухого пиридина, при охлаждении прилили 4,4 мл PCl3 в 25 мл сухого пиридина (по каплям) и перемешивали 30 минут, убрав охлаждение. Добавили 18,8 г (0,1 моль) α-гидрокси-нафтойной кислоты, нагревали на водяной бане в течение трех часов. Охладили раствор, отфильтровали выпавший осадок полифосфорной кислоты. Пиридин отогнали при уменьшенном давлении. Осадок обработали смесью этилацетат:соляная кислота (1:1). Органический слой отделили, промыли 10 % раствором NaHCO3, водой, высушили над безводным Na2SO4. Этилацетат отогнали на водяной бане. Осадок перекристаллизовали из гексана. Выход – 5 г (15 %).
К 2 г N-метиламида α-гидрокси-нафтойной кислоты добавили 6 мл уксусного ангидрида, затем при охлаждении добавили 1 мл хлорной кислоты. Через 24 часа отфильтровали выпавший осадок, промыли диэтиловым эфиром. Выход – 2,28 г (70 %).
Перхлорат 2-метил-3-бензил-2,3-дигидронафто[2,1-e][1,3]оксазин-4-ония (9b).
Получен по методике, аналогичной синтезу (9a), с использованием бензиламина и α-гидрокси-нафтойной кислоты. Выход – 1,93 г (48 %).
Перхлорат 2,3-диметил-2,3-дигидронафто[3,2-e][1,3]оксазин-4-ония (10a).
Получен по методике, аналогичной синтезу (9a) с использованием 2-гидрокси-3-нафтойной кислоты и метиламин гидрохлорида. Выход – 2,44 г (75 %).
Перхлорат 2–метил-3-бензил-2,3-дигидронафто[3,2-e][1,3]оксазин-4-ония (10b).
Получен по методике, аналогичной синтезу (9a), с использованием 2-гидрокси-3-нафтойной кислоты и бензиламина. Выход – 1,73 г (43 %).
3-Метил-8´-нитро-спиро(2,3-дигидро-нафто[2,1-e][1,3]оксазин-4-оксо-2,2′-[2Н]-хромен) (14а).
К горячему раствору 1,67 г (0.01 М) 5-нитросалицилового альдегида в 10 мл уксусной кислоты прибавили 3,25 г (0.01 М) перхлората 2,3-диметил-2,3-дигидро-нафтооксазин-4-ония (9а). Полученную реакционную смесь кипятили в течение 5 минут, далее охладили, отфильтровали и промыли этиловым эфиром (3*15 мл) выпавший осадок темно-коричневой стирильной соли. Осадок соли поместили в абсолютный этиловый эфир (50 мл) и по каплям добавили 1,5 мл (0.01 М) триэтиламина. Через 12 часов эфир декантировали, растворитель отогнали, а оставшееся желтое масло перекристаллизовали из этилового спирта. Выход – 33 %.
Т пл = 176-178 °С. Найдено (%): C, 67,45; H, 3,71; N, 7,45 С21H14N2O5. Вычислено (%): C, 67,38; H, 3,74; N, 7,49. ИК-спектр, n/см–1: 1673 (С=О); 1647, 1620 (С=С); 971 (Сспиро-О). Спектр ЯМР 1Н (CDCl3), δ, м. д. (J, Гц): 3.21 (3Н, с, N-СН3), 6.33 (1Н, д, J = 9.6, 3′-Н), 7.06 – 7.19 (2Н, м, 4′-Н, 6′-Н), 7.34 (1Н, т, J = 6.9, 9-Н), 7.45 – 7.57 (2Н, м, 8-Н, 5′-Н ), 7.61 (1Н, д, J = 8.9, 10-Н), 7.75 (1Н, д, J = 8.1, 7′-Н), 7.81 (1Н, д, J = 8.1, 7-Н), 7.87 (1Н, д, J = 8.5, 6-Н), 8.02 (1Н, д, J = 8.5, 5-Н).
3-Метил-8´-нитро-спиро(2,3-дигидро-нафто[3,2-e][1,3]оксазин-4-оксо-2,2′-[2Н]-хромен) (14b).
Получен аналогично синтезу соединения (14а) на основе 2,3-диметил-2,3-дигидронафто[3,2-e][1,3]оксазин-4-ония (10a) и 5-нитросалицилового альдегида. Выход – 18 %. Т пл =206-208 °С. Найдено (%): C, 67,45; H, 3,74; N, 7,42 С21H14N2O5. Вычислено (%): C, 67,38; H, 3,74; N, 7,49. ИК-спектр, n/см–1: 1678 (С=О); 1624, 1598 (С=С); 982 (Сспиро-О). Спектр ЯМР 1Н (CDCl3), δ, м. д. (J, Гц): 3.22 (3Н, с, N-CH3), 6.29 (1Н, д, J = 9.8, 3′-Н), 7.10 (1Н, д, J = 9.7, 4′-Н), 7.15 (1Н, д, J = 7.8, 5′-Н), 7.25 (1Н, с, 10-Н), 7.40 – 7.58 (3Н, м, 7-Н, 8-Н, 6′-Н), 7.70 (1Н, д, J = 8.2, 9-Н), 7.82 (1Н, д, J = 8.2, 7′-Н), 7.98 (1Н, д, J = 8.1, 6-Н), 8.65 (1Н, с, 5-Н).
3-Метил-7´-гидроксил-8´-альдегидоспиро(2,3-дигидро-нафто[2,1-e][1,3]оксазин-4-оксо-2,2′-[2Н]-хромен) (14с).
Получен по методике, аналогичной синтезу соединения (14а), на основе 2,4-дигидрокси-изо-фталевого альдегида и перхлората 2,3-диметил-2,3-дигидро-нафтооксазин-4-ония (9а). Выход – 45 %. Т пл =190-192 °С. Найдено (%): C, 70,75; H, 3,99; N, 3,71 С22H15NO5. Вычислено (%): C, 70,78; H, 4,02; N, 3,75. ИК-спектр, n/см–1: 1673 (С=О); 1647(С=С); 973 (Сспиро-О). Спектр ЯМР 1Н (СDCl3), δ, м. д. (J, Гц ): 3.21 (3H, с, N-CH3); 6.06 (1Н, д, J = 10.0, 3′-H); 6.59 (1H, д, J = 8.5, 6′-Н); 7.01 (1H, д, J = 9.6, 4'-H); 7.35-7.44 (2H, м, 5′-Н, 9-Н); 7.51 – 7.67 (2Н, м, 8-Н, 10-Н);7.83 (1H, д, J = 8.1, 7-Н); 7.96 (1H, д, J = 8.5, 6-Н); 8.03 (1H, д, J = 8.5, 5-Н), 9.78 (1H, c, -CHO); 11.62 (1H, c, -OH).
3-Бензил-7´-гидроксил-8´-альдегидоспиро(2,3-дигидро-нафто[2,1-e][1,3]оксазин-4-оксо-2,2′-[2Н]-хромен) (14d).
Получен по методике, аналогичной синтезу соединения (14а), на основе 2-метил-3-бензил-2,3-дигидронафто[2,1-e][1,3]оксазин-4-ония (9b) и 2,4-дигидрокси-изо-фталевого альдегида. Выход 48%. Т пл =198-199 °С.
Найдено (%): C, 74,10; H, 4,31; N, 3,15 С22H15NO5. Вычислено (%): C, 74,14; H, 4,35; N, 3,2. ИК-спектр, n/см–1: 1671 (С=О); 1641(С=С); 971 (Сспиро-О). Спектр ЯМР 1Н (СDCl3), δ, м. д. (J, Гц ): 4.85 (1H, д, J = 15.8, N-CH2), 5.13 (1H, д, J = 15.8, N-CH2), 5.95 (1H, д, J = 9.8, 3'-Н), 6.58 (1H, д, J = 9.2, 6'-Н), 6.9 (1H, д, J = 9.8, 4'-Н), 7.1 – 8.1 (7Н, расщ. м.., 5-H, 6-H, 7-H, 8-H, 9-H, 10-H), 9.61 (1H, c., OH), 11.6 (1H, c, -COH).
Работа выполнена при финансовой поддержке грантов РФФИ (грант № 12-03-31455 мол_а и грант № 12-03-90017-Бел_а). Исследование выполнено при поддержке Министерства образования и науки Российской Федерации, соглашение 14.132.21.1460.
Рецензенты:
Дубоносов А. Д., д.х.н., гл.н.с., ЮНЦ РАН, г. Ростов-на-Дону.
Стариков А. Г., д.х.н., в.н.с., НИИ ФОХ ЮФУ, г. Ростов-на-Дону.



